核壳Fenton催化剂CuFe2O4@PDA-Cu的制备、表征及其活化H2O2降解染料的性能
2018-07-13江银枝李静袁辉强陈燕慧
江银枝, 李静, 袁辉强, 陈燕慧
(浙江理工大学 化学系, 浙江 杭州 310018)
水污染一直是我国最突出的环境安全问题之一,水体中广泛存在难降解的有机生物污染物,如合成染料、农药、医药、自然激素等,威胁水体生物和人类健康. 自2013年来,为了遏制水污染恶化,相应法规制度和措施的实施使现有处理技术受到了挑战. 改进现有的环境处理技术,开发有效的新型水处理材料,已成为目前的研究热点.
现有的水体有机污染物的处理方法主要有物理法、化学法、生物法,这些方法各有优缺点[1-2]. 1987年GLAZE等提出的高级氧化技术[3-5](AOPs)是通过活化手段 (光、电、催化剂)活化氧化剂(O2、H2O2等)产生羟基自由基,将废水中的有机污染物氧化成 CO2、H2O 和无机盐等,包含Fenton法、光催化、电催化等,这些方法成为处理生物难降解有机物的重要手段. 其中发现于1894年的Fenton法,20世纪60年代首次将其用于废水中苯酚和烷基苯的降解,由于条件温和、操作方便、成本低、速度快,广受环境催化领域研究人员的关注[6]. 传统的Fenton法,H2O2利用率低,催化剂参与反应产生大量Fe泥,增加了处理成本. RACHE等[7]报道了非均相Fenton催化剂具备较宽的pH值范围,且易于回收,使得非均相Fenton催化剂的研究和使用成为水处理领域的热点[8-11].
尖晶石型铁酸盐的制备及应用备受关注.尖晶石型CuFe2O4具有优良的磁学性能、吸附性能和催化性能,但其金属中心易于流失[12-13]. 聚多巴胺(PDA)几乎可以黏附在任何类型的材料表面,文献[14-15]报道了PDA包裹在纳米Fe3O4表面,可以减少纳米粒子的团聚,提高重复利用率. 加之PDA表面存在共轭环和电活性的N、O原子,可以螯合金属离子,具有一定的电子传导功能. 基于课题组在Cu配合物催化染料降解方面的工作积累[16-17],在弱碱性条件下设计了原位制备核壳结构材料CuFe2O4@PDA,进而将Cu(Ⅱ)螯合在PDA骨架上(见图1), 得到核壳复合型催化剂,并对其组成结构进行表征,考察其活化H2O2降解染料的性能.

图1 催化剂CuFe2O4@PDA-Cu的制备Fig.1 Preparation of catalyst CuFe2O4 @ PDA-Cu
1 实验部分
1.1 试剂与仪器
傅里叶红外光谱仪Nicolet 5700(美国,尼高力仪器公司),X射线衍射分析仪DX-2700(中国,上海精密仪器仪表有限公司),X射线光电子能谱仪XPS K-Alpha(美国,赛默飞世尔仪器公司),液相色谱SPD-15C&LC-15C(日本,岛津公司),紫外可见光谱仪UV2450(日本,岛津公司).
所用制备试剂均为分析纯或化学纯,购自国药试剂公司. 液相色谱用甲醇为色谱纯(美国,天地公司),水为纯水(中国,娃哈哈).
1.2 实验方法
1.2.1 催化剂的制备
顺次向250 mL的烧杯中加入乙二醇(40 mL)、FeCl3(1.35 g)、CuCl2·2H2O(0.708 3 g),搅拌至溶解. 向溶液中加入CH3COONa(3.6 g)和聚乙二醇(2000)(2.0 g),搅拌均匀,转移至反应釜200 ℃下反应11 h. 将反应混合物转移至烧杯中,用磁铁分离, 用蒸馏水和无水乙醇洗涤,得黑色固体CuFe2O4, 0.65 g.
称取0.2 g CuFe2O4于250 mL锥形瓶中,加入Tris缓冲液(10 mmol·L-1,100 mL),超声5 min,使CuFe2O4分散在缓冲液中,加入多巴胺(0.2 g),于常温下反应12 h. 用磁铁分离, 蒸馏水和无水乙醇洗涤,干燥,得黑色固体CuFe2O4@PDA, 0.29 g.
将CuFe2O4@PDA(0.20 g)Tris缓冲液(10 mmol·L-1,pH=8.4, 100 mL),Cu(Ac)2(0.50 g)依次加入反应器中,室温超声分散,升温80 ℃下反应12 h. 磁铁分离,用蒸馏水和无水乙醇洗涤,干燥,得黑色固体CuFe2O4@PDA-Cu, 0.22g.
Cu负载量测定: 采用EDTA络合滴定,PAN(1-(2-吡啶偶氮)-2-萘酚)为指示剂,分别测定反应前Cu量(n1mmol)和反应后Cu量(n2mmol). 利用式(2)计算铜负载量:

(1)
1.2.2 催化剂催化甲基橙降解
实验溶液: 甲基橙废水(250 mL,30 mg·L-1)+ H2O2(CH2O2=10 mmol·L-1)+ CuFe2O4@PDA-Cu (2.5 mg).
Blank实验: 甲基橙废水(250 mL,30 mg·L-1)+ H2O2(CH2O2=10 mmol·L-1).
对比溶液1: 甲基橙废水(250 mL,30 mg·L-1)+ H2O2(CH2O2=10 mmol·L-1)+ CuFe2O4@PDA (2.5 mg).
对比溶液2: 甲基橙废水(250 mL,30 mg·L-1)+ H2O2(CH2O2=10 mmol·L-1)+ CuFe2O4(2.5 mg).
在T=30℃, pH=9的条件下,用分光光度计和UV-Vis光谱仪跟踪脱色进程. 脱色率按下式计算:

(2)
其中,A0为初始吸光值,At为t时刻吸光值.
1.2.3 降解产物HPLC分析
用高效液相色谱(HPLC)对降解液进行分析,采用外标法确定降解产物. HPLC条件: ODS-SP C18柱: 4.6 mm×150 mm, 5μm,流动相:v甲醇:v水=2: 8,流速: 1.0 mL·min-1,进样量: 20 μL,检测器: SPD-15C型UV检测器.
2 结果与讨论
2.1 催化剂的制备
依据表1进行了不同条件下催化剂的制备, 同时给出了不同条件下制备的催化剂的Cu负载量.

表1 制备CuFe2O4@PDA-Cu条件筛选
发现在不同反应温度下,用不同铜盐为原料制备的催化剂,其铜负载量存在差异. 对实验制备的编号为1~3号的催化剂进行甲基橙降解实验,结果见图2. 3~5号催化剂的催化效果见图3.

图2 不同铜盐制备的催化剂对甲基橙的脱色曲线Fig.2 Decolorization curves of methyl orange with the catalysts prepared from different copper salts
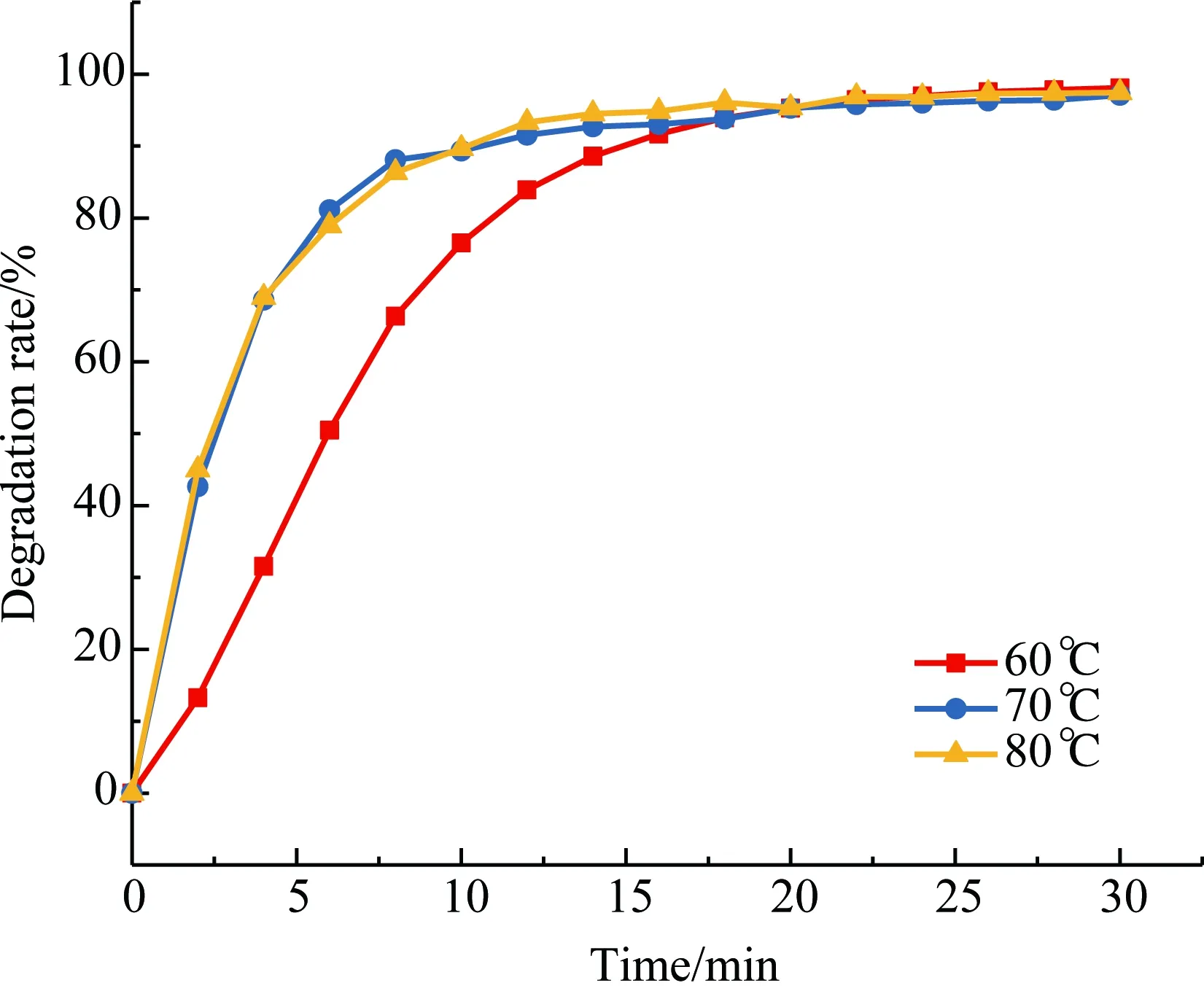
图3 不同温度下制备的催化剂对甲基橙的脱色曲线Fig.3 Decolorization curves of methyl orange with the catalysts prepared at different temperatures
从图2中可发现,以CuCl2和Cu(Ac)2制备的催化剂对甲基橙的脱色速率较快,CuSO4制备的催化剂对甲基橙的脱色速率较慢. 考虑到反应Cu的负载率(见表1),选择Cu(Ac)2作为催化剂的制备原料.从图3中可发现,70 ℃和80 ℃下制备的催化剂对甲基橙的脱色效果最好,脱色较为彻底,同时脱色速率也较快. 考虑到Cu的负载率,选择制备的温度为80 ℃.
2.2 催化剂的表征
确定催化剂的制备条件: 以10 mmol·L-1Tris为溶剂, 制备温度80 ℃, Cu(Ac)2为原料. 对这一条件下制备的催化剂进行表征, 图4为CuFe2O4@PDA-Cu、CuFe2O4@PDA、CuFe2O4的红外谱图. 图5为CuFe2O4@PDA-Cu、CuFe2O4@PDA、CuFe2O4的固体漫反射图. 图6为CuFe2O4@PDA-Cu、CuFe2O4@PDA、CuFe2O4的广角XRD图. 图7为催化剂CuFe2O4@PDA-Cu在循环4次前后的广角XRD图. 图8 为CuFe2O4@PDA-Cu的XPS全图. 图9~图11分别为CuFe2O4@PDA-Cu的XPS的O、N、Cu元素分峰图.
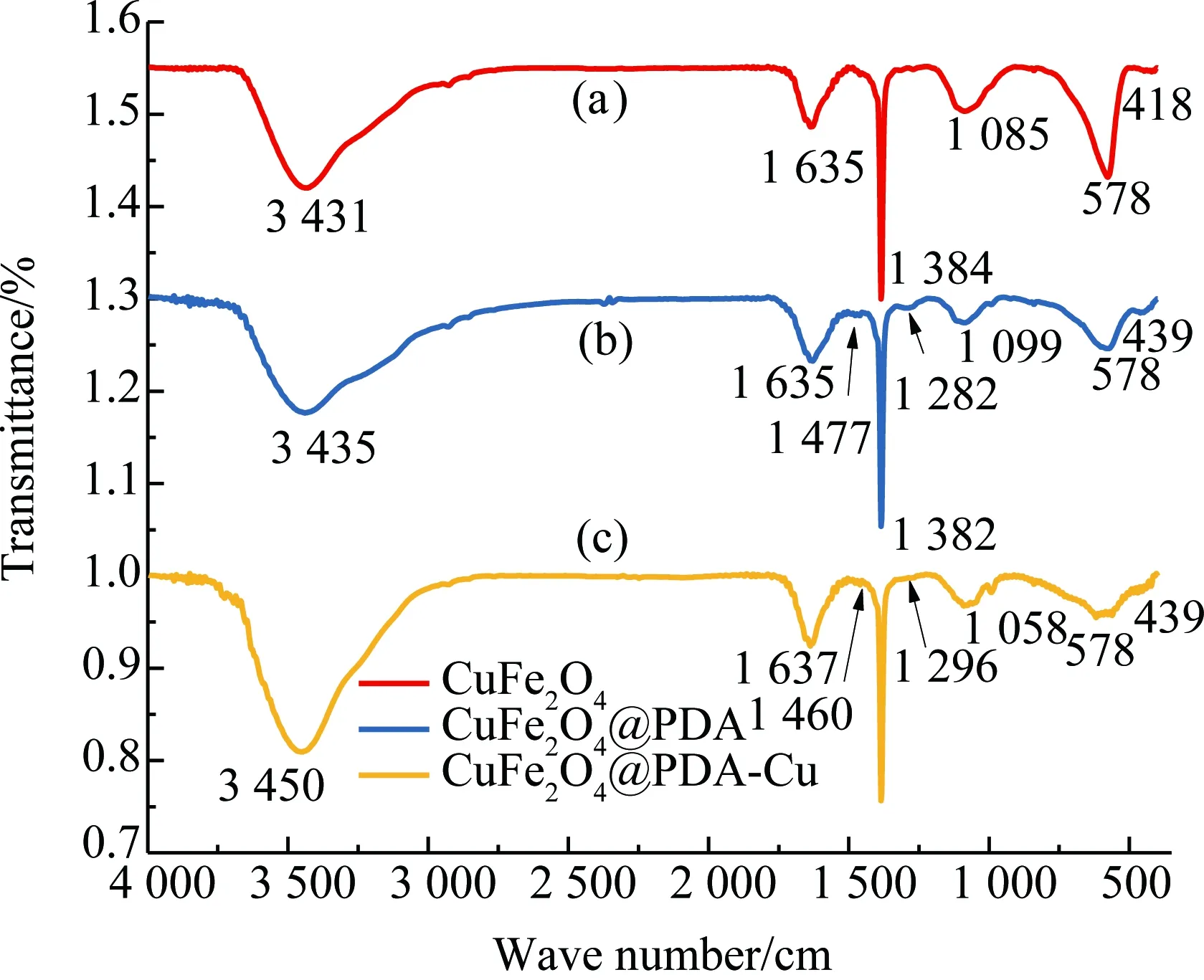
图4 催化剂的红外谱图Fig.4 The infrared spectrum of the catalyst
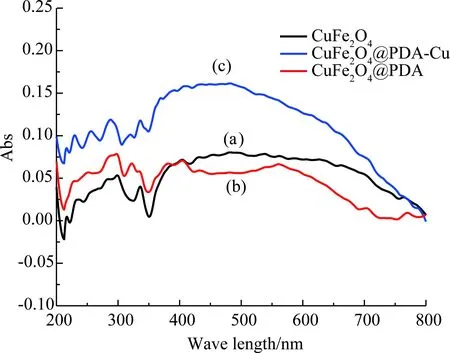
图5 催化剂的固体漫反射Fig. 5 Solid diffuse reflection of catalyst

图6 CuFe2O4@PDA-Cu、CuFe2O4@PDA、CuFe2O4的XRDFig. 6 XRD of CuFe2O4 @ PDA-Cu, CuFe2O4 @ PDA, CuFe2O4
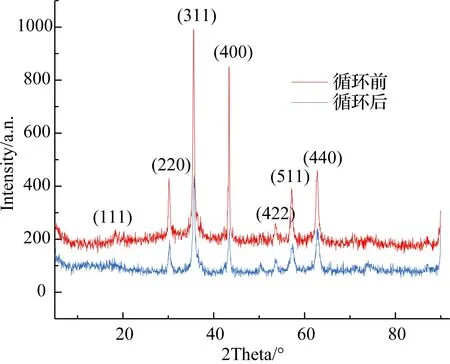
图7 CuFe2O4@PDA-Cu在循环4次前后的广角XRD图Fig.7 Wide-angle XRD pattern of CuFe2O4 @ PDA-Cu before and after four cycles
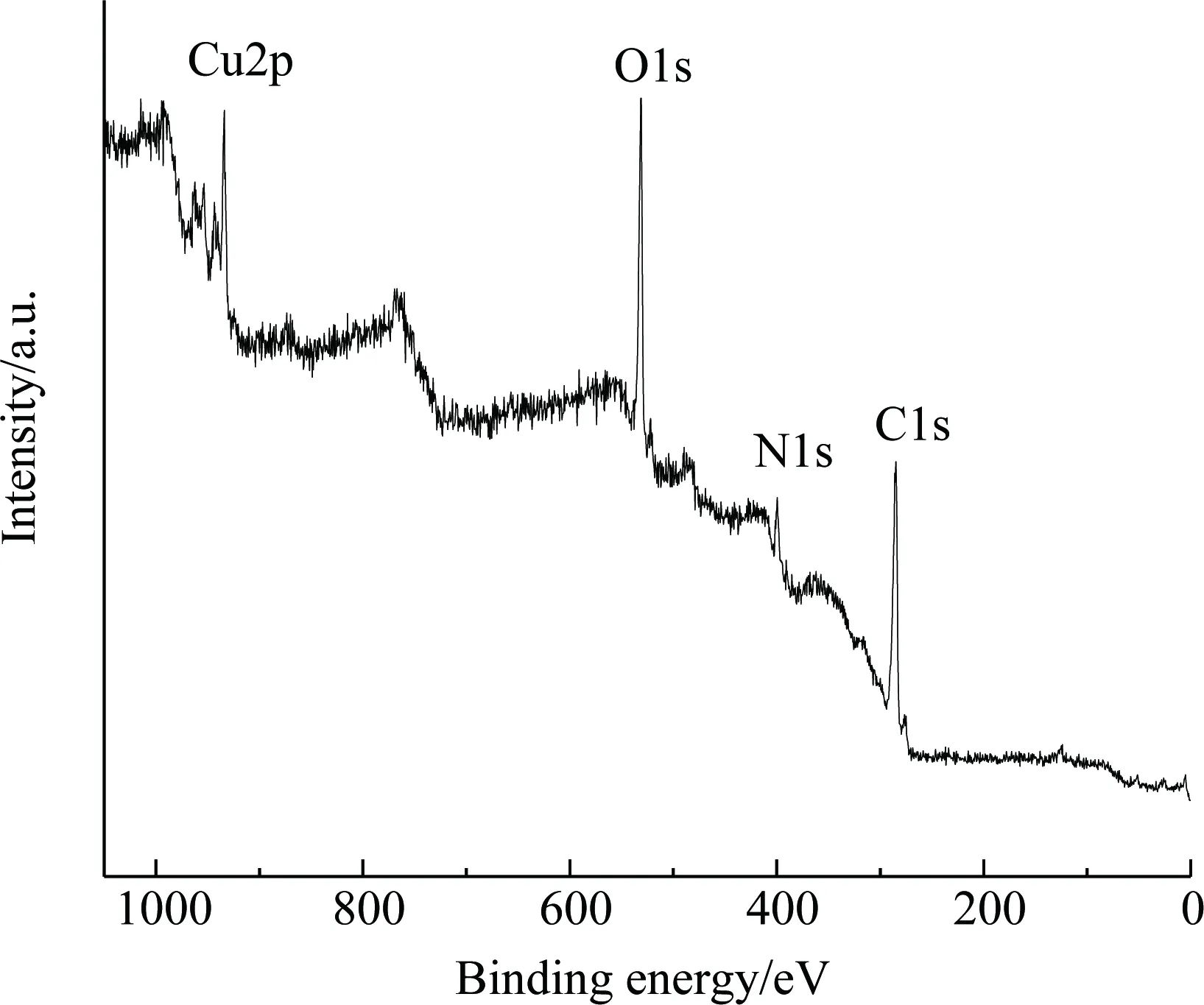
图8 CuFe2O4@PDA-Cu的XPS全谱图Fig.8 XPS full spectrum of CuFe2O4 @ PDA-Cu

图9 O元素的XPS分峰图Fig.9 XPS peak map of oxygen element

图10 N元素的XPS分峰图Fig.10 XPS peak map of nitrogen element

图11 Cu元素的XPS分峰图Fig.11 XPS peak map of copper element
从图4中可发现,CuFe2O4@PDA-Cu、CuFe2O4@PDA与CuFe2O4在578 cm-1处都有Fe-O在O2-离子所形成的四面体位置的伸缩振动. CuFe2O4在418 cm-1处有Cu-O在O2-离子所形成的八面体位置的伸缩振动,负载PDA生成CuFe2O4@PDA的Cu-O伸缩振动蓝移至439 cm-1, 578 cm-1处Fe-O伸缩振动变宽;进一步,负载Cu生成CuFe2O4@PDA-Cu,439 cm-1处出现Cu-O伸缩振动, 578 cm-1处出现Fe-O伸缩振动,且幅度进一步增宽. CuFe2O4@PDA 相对CuFe2O4在1 099,1 282,1 382,1 460,1 635 cm-1处出现吸收,CuFe2O4@PDA-Cu相对CuFe2O4在1 058,1 296,1 382,1 477,1 637 cm-1处出现吸收,说明有机质PDA在CuFe2O4负载成功[14-15]. CuFe2O4@PDA-Cu相对CuFe2O4@PDA对应的有机基团出现红移或蓝移,说明Cu2+在PDA上配位负载. 比较图5中的CuFe2O4@PDA和CuFe2O4的固体漫反射发现,在紫外-可见光区(200 ~800 nm)的吸收有改变,CuFe2O4@PDA相对于CuFe2O4在紫外区吸收增强, 在可见光区吸收减弱,说明PDA覆盖在CuFe2O4上生成核壳结构材料. 比较图5中的CuFe2O4@PDA和CuFe2O4@PDA-Cu的固体漫反射发现,在紫外-可见光区吸收有改变,说明Cu2+以配位键的方式与PDA键合. 图6显示,制备的CuFe2O4的衍射峰位: 2θ= 30.2°,35.5°,37.2°,43.5°,53.6°,57.2°和62.5 °,与标准CuFe2O4(JCPDS卡77-0010)一致,为尖晶石型CuFe2O4.CuFe2O4@PDA、CuFe2O4@PDA-Cu的衍射峰与CuFe2O4衍射峰无明显不同,说明CuFe2O4@PDA、CuFe2O4@PDA-Cu制备过程依然保持了CuFe2O4的结构. 图7显示催化剂CuFe2O4@PDA-Cu在循环4次后仍保留了核CuFe2O4的尖晶石型结构,磁性中心稳定存在. 图8显示,CuFe2O4@PDA-Cu表面探测到了Cu,C,O,N元素,无Fe元素. 图9和图10的N,O元素分峰图显示有O-Cu键和N-Cu键,说明PDA覆盖在CuFe2O4表面,从图11的Cu2p谱图中可以看到典型的Cu2p1/2(954.2 eV)和Cu2p3/2(933.8 eV)峰,以及Cu2+(943.7 eV)的特征峰,说明Cu2+与PDA配位键与红外光谱和固体漫反射的结果一致.
综上所述,CuFe2O4@PDA-Cu是一个核壳复合结构,Cu2+在PDA上配位负载.
2.3 催化染料降解的性能
2.3.1 CuFe2O4@PDA-Cu催化染料降解效果及条件
图12给出了以CuFe2O4、CuFe2O4@PDA、CuFe2O4@PDA-Cu为催化剂,在30 ℃条件下催化甲基橙的脱色效果.

图12 CuFe2O4@PDA-Cu催化甲基橙脱色效果Fig.12 CuFe2O4 @ PDA-Cu catalytic methyl orange decolorization effect前40 min不加H2O2, 甲基橙浓度30 mg·L-1, H2O2浓度10 mmol·L-1; blank为无催化剂.Without H2O2 in the first 40 min, 30 mg·L-1 methyl orange, and 10 mmol·L-1 hydrogen peroxide; Blank has no catalyst.
从图12中发现,前40 min,体系中没有加入H2O2,可见CuFe2O4、CuFe2O4@PDA、CuFe2O4@PDA-Cu对甲基橙染料无吸附作用,空气中的O2也难以活化氧化甲基橙. 40 min后体系中加入H2O2,发现H2O2可以缓慢氧化甲基橙. CuFe2O4、CuFe2O4@PDA、CuFe2O4@PDA-Cu都可以活化H2O2氧化降解甲基橙,CuFe2O4、CuFe2O4@PDA效果相同,CuFe2O4@PDA-Cu效果最好. 说明脱色过程是化学氧化脱色,PDA的负载不改变CuFe2O4的催化活性,但Cu2+在PDA上的配位负载能使其活性增强. 制备的核壳复合催化剂CuFe2O4@PDA-Cu能有效活化双氧水降解甲基橙.
以CuFe2O4@PDA-Cu为催化剂,考察了pH、温度、H2O2浓度、盐、染料初始浓度和催化剂用量对催化降解效果的影响,实验结果见图13~图17.
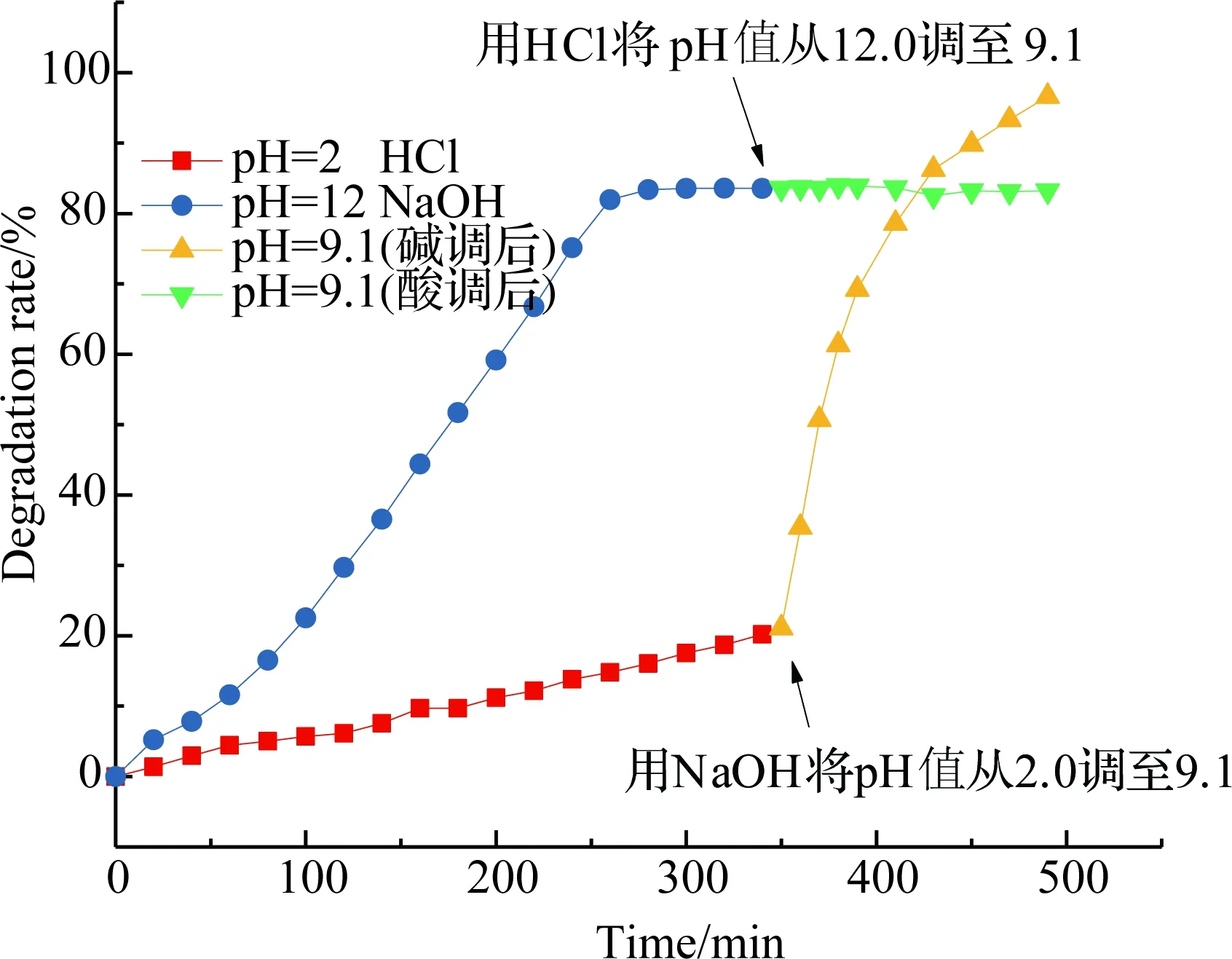
图13 不同pH值条件下甲基橙的降解效果Fig.13 Degradation of methyl orange at different pH conditions
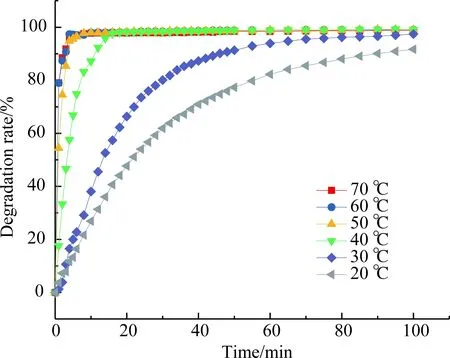
图14 不同温度条件下甲基橙的降解效果Fig.14 Degradation of methyl orange at different temperatures
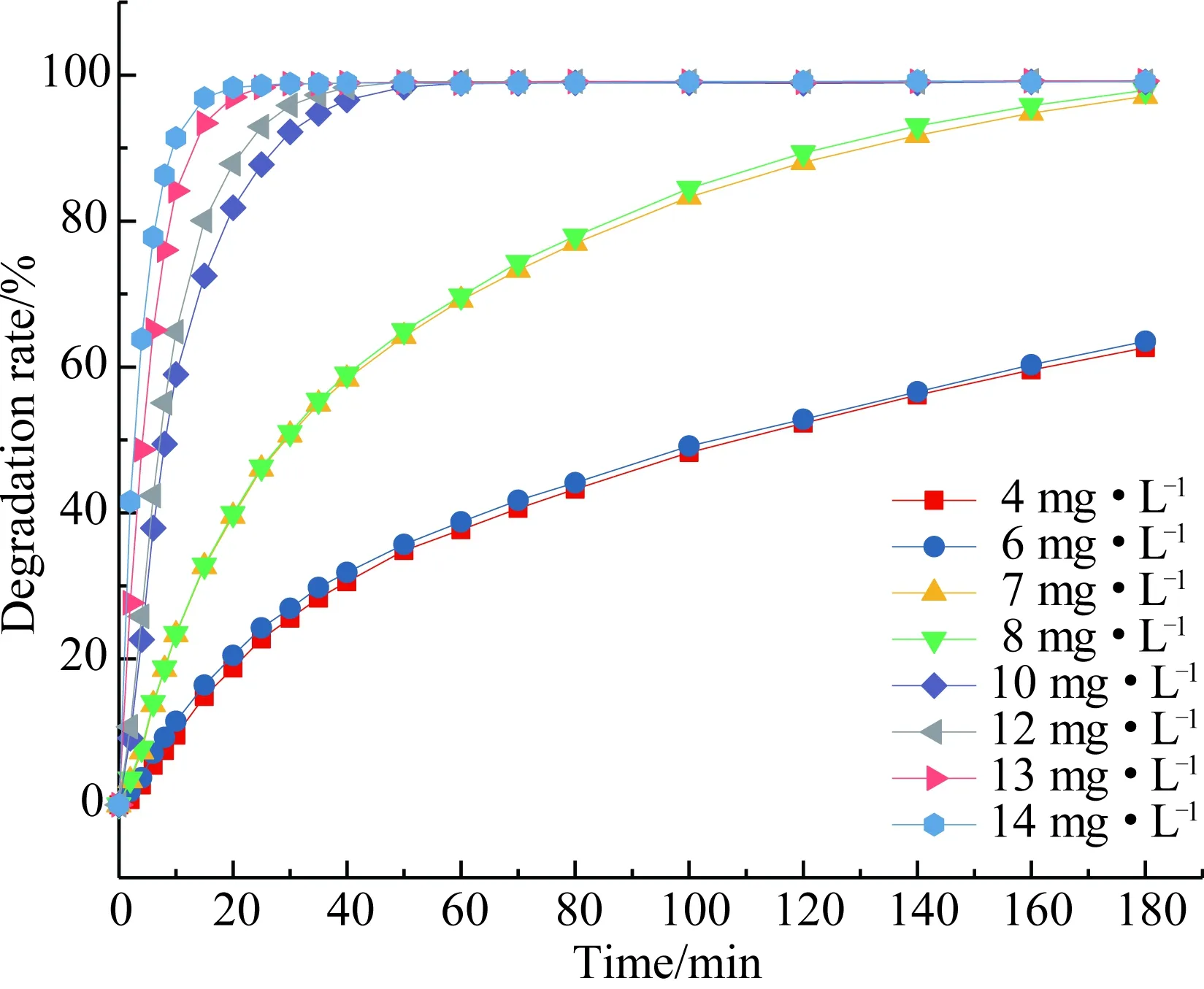
图15 不同催化剂用量条件下甲基橙的降解效果Fig.15 Degradation of methyl orange at different catalyst loadings

图16 不同 H2O2用量条件下甲基橙的降解效果Fig.16 Degradation of methyl orange at different H2O2 concentrations

图17 0.02 mol·L-1的5种盐处理下甲基橙脱色曲线Fig.17 Methyl orange decolorization curve of five kinds of 0.02 mol·L-1 salt
从图13中发现,在酸到中弱碱性(pH=2~10)条件下,随着pH值的增大,催化活性增强. 在0.01 mol·L-1的NaOH强碱性介质中,催化活性下降,200 min后降解达到平衡,降解率约为85%. 此时向降解体系中加入HCl中和到pH=9,发现不再继续降解,即催化剂失活,认为强碱性条件下催化剂结构被破坏,难以再生. 在0.01 mol·L-1的HCl强酸介质中,催化活性下降,200 min降解率约为20%. 200 min后,向体系中加入NaOH中和到pH=9, 催化活性显著增强,说明在强酸性介质中活性降低,但催化剂不会失活,当体系回到弱碱性条件时,催化活性增强. CuFe2O4@PDA-Cu活化H2O2的pH=2~10,最有利条件为pH=8.5~10,pH范围较一般的Fenton试剂宽[6-7].
从图14中不难发现,温度升高有利于增强催化活性. 当T=30 ℃,60 min后,甲基橙的脱色率达到97%以上;T=40 ℃,60 min后,甲基橙的脱色率达到99%以上,所以选择30 ℃进行实验. 从图15中可以发现,催化剂用量的增加,有利于甲基橙的降解. 对于30 mg·L-1的甲基橙溶液,催化剂用量≥ 10 mg·L-1,可以快速实现甲基橙的完全去除,所以选择加入催化剂的用量为10 mg·L-1. 图16显示,H2O2用量增加,有利于甲基橙的降解. 对于30 mg·L-1的甲基橙溶液,当H2O2用量≥ 10 mmol·L-1时,可以快速实现甲基橙的完全去除,所以选择H2O2的用量为10 mmol·L-1. 图17先在降解体系中加入0.02 mol·L-1的氯化物、硫酸盐、磷酸盐、硝酸盐,不影响催化降解甲基橙的效率,60 min后甲基橙去除完全;降解体系中加入0.02 mol·L-1的亚硝酸盐、溴化物抑制甲基橙的催化降解,20 min后降解趋于平衡, 60 min后降解率约为70%,甲基橙不能完全去除. 一般印染过程中使用的电解质为NaCl、Na2SO4,在用于这些染料废水处理时,可以不进行脱盐处理.
对于30 mg·L-1的甲基橙废水,为了经济有效地去除甲基橙,推荐使用条件:T=30~40 ℃,pH=8~10,H2O2为 10 mmol·L-1,催化剂为10 mg·L-1.
2.3.2 CuFe2O4@PDA-Cu的循环使用与底物拓展
在推荐条件下,采用磁铁吸附分离催化剂进行催化剂的循环回收使用,结果见图18.
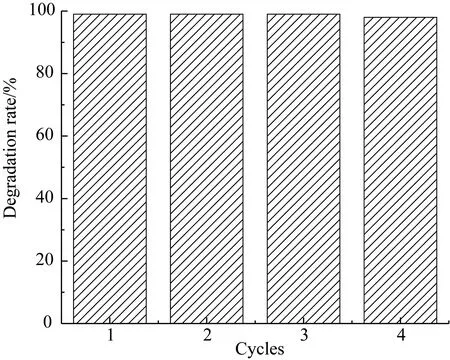
图18 CuFe2O4@PDA-Cu的催化循环Fig.18 Catalytic cycling of CuFe2O4 @ PDA-Cu
图18显示,催化剂循环使用4次后,仍能保持95%以上的去除率.催化剂可以循环使用,而且磁回收方便.下面进一步考察催化剂对底物的适应性. 利用UV-Vis光谱跟踪,进行底物拓展实验,结果见图19. 脱色率(可见吸收最大波长处的吸光值的下降率)、UV254 及利用高锰酸钾法测定的COD值见表2.

表2 不同染料降解24 h后的脱色率、CODMn值和UV254
注括号内为高浓度染料溶液降解前后的COD值.
图19和表2的数据显示,甲基橙、罗丹明B在45 min后完全去除,茜素红可以在24 h内完全去除,B0115、O0118、R0123在24 h后的脱色率分别为64%,62%和60%. 染料分子不仅仅使生色团的吸收下降,而且使芳香环的吸收也减弱,UV254也明显下降. CODMn值在降解后明显减小,说明生色团断裂,芳香环开环,这不仅仅是氧化脱色过程,更是氧化开环降解矿化过程. 同时说明芳环上含有硝基、Br或氯代基团难以开环降解,但是CuFe2O4
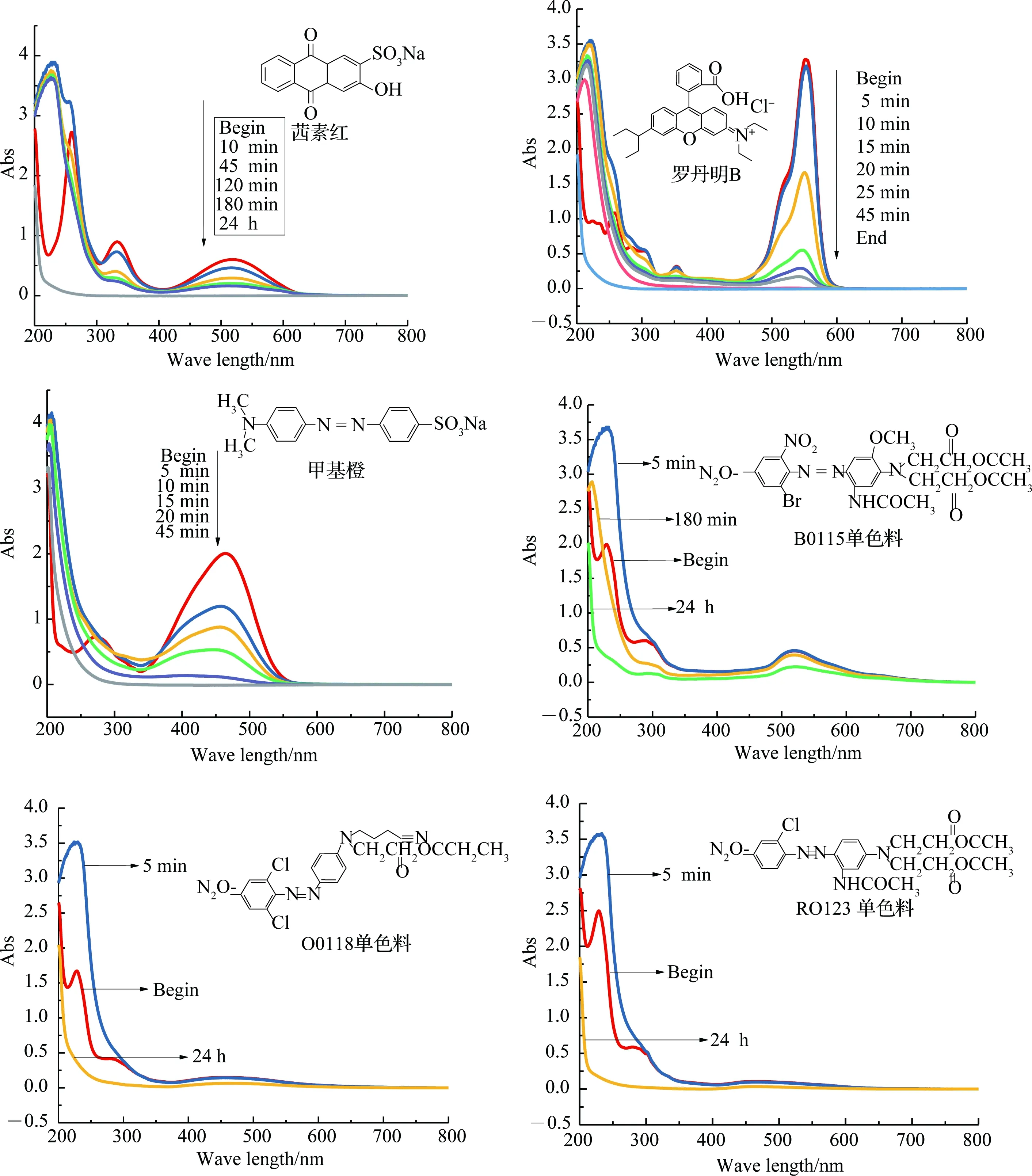
图19 CuFe2O4@PDA- Cu催化不同染料的紫外-可见光谱随反应时间的变化图Fig.19 UV-Vis spectra of CuFe2O4 @ PDA-Cu catalyzed different dyes with reaction time
@PDA-Cu相对于简单的金属配合物催化剂,对这类染料的降解性能有明显提高. 选择可以完全去除的甲基橙、茜素红、罗丹明B的高浓度(甲基橙150 mg·L-1, 茜素红300 mg·L-1,罗丹明B 150 mg·L-1)进行降解实验,24 h后测定其CODMn,结果见表2,发现高浓度下也可以有效去除CODMn.
2.3.3 脱色过程的产物分析
用HPLC对降解60 min后的甲基橙、罗丹明B、茜素红的降解液进行HPLC分析,采用外标保留时间进行定性,结果见表3. 用石灰水吸收降解过程中逸出的气体(见图20).
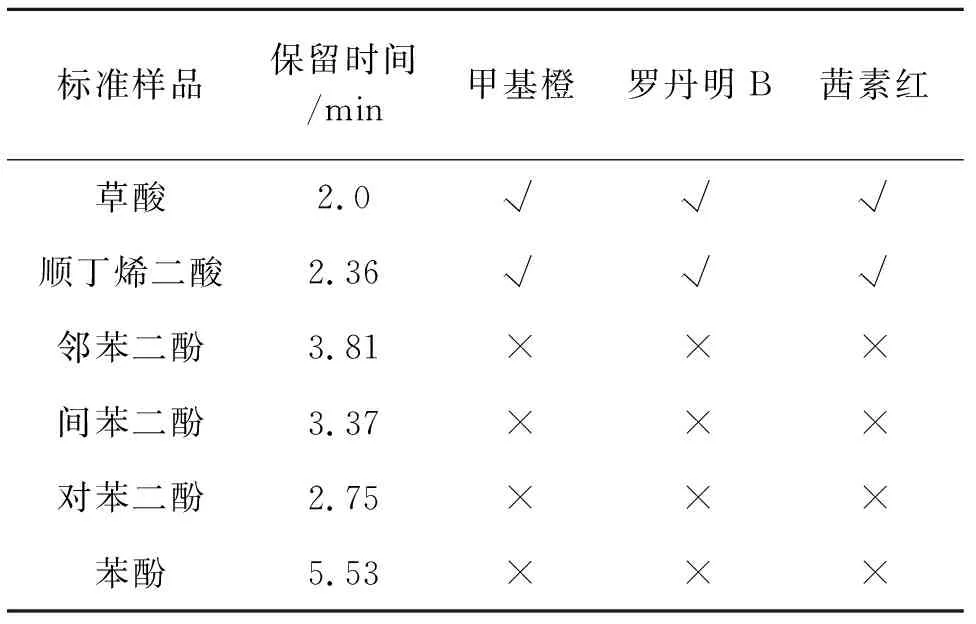
表3 染料降解产物分析
注√ 表示检出,× 表示未检出.

图20 甲基橙降解产物CO2验证Fig.20 Methyl orange degradation products CO2 verification从左往右依次是初始、降解中间过程、降解完全.From left to right followed by initial, intermediate degradation, degradation completely.
表3和图20的数据显示,降解产物及中间产物有二氧化碳、草酸、顺丁烯二酸.
2.3.4 催化降解机理
由于降解过程中用到的氧化剂是H2O2,文献[18]报道催化剂活化H2O2的催化氧化过程中往往通过H2O2裂解产生HO·、HO2-、O2-等活性氧自由基进攻底物分子,实现底物的氧化. 以水杨酸为羟基自由基捕捉试剂代替甲基橙进行实验, 结果见图21.以叔丁醇为羟基自由基反应抑制试剂进行的实验,结果见图22.
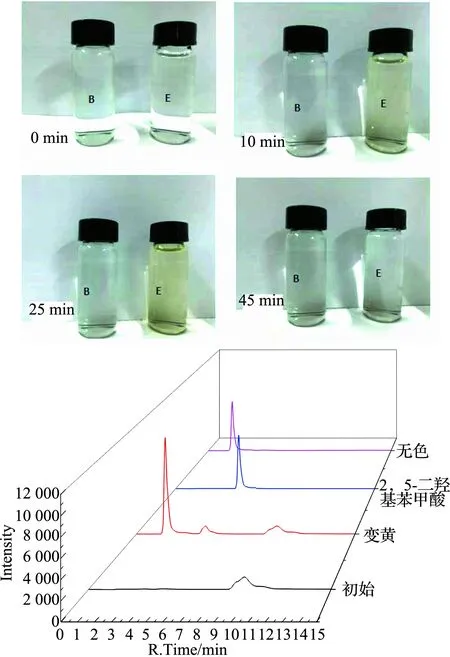
图21 羟基自由基捕获实验和实验组E的HPLC跟踪Fig.21 Hydroxyl radical capture experiment and HPLC track of the experiment
B(空白): 水杨酸浓度30 mg·L-1, H2O2为氧源,T=30 ℃, H2O2浓度=10 mmol·L-1, pH=9;E(实验): 水杨酸浓度30 mg·L-1,催化剂用量10 mg·L-1, H2O2为氧源,T=30 ℃, H2O2浓度=10 mmol·L-1, pH=9, CuFe2O4@PDA-Cu为催化剂.
B(blank): Salicylic acid concentration: 30 mg·L-1, H2O2as oxygen source,T=30 ℃, H2O2concentration: 10 mmol·L-1, pH=9;E(experiment): Salicylic acid concentration: 30 mg·L-1, catalyst dosage: 10 mg·L-1, H2O2as oxygen source,T=30 ℃, hydrogen peroxide concentration: 10 mmol·L-1, pH=9, CuFe2O4@PDA-Cu as catalyst.
由图21可知,在中间过程中实验组变成了黄色,随着时间的延长黄色稍有加深,最终黄色消失. 这是由于此过程中水杨酸( HPLC出峰时间9.6 min)捕捉了羟基自由基,生成2,5-二羟基苯甲酸(HPLC出峰时间4.7 min),使得溶液变黄. 2,5-二羟基苯甲酸进一步捕捉羟基自由基,最终开环降解,所以45 min后溶液变成无色.
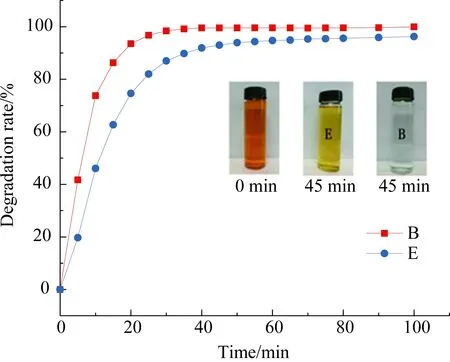
图22 叔丁醇抑制自由基实验 (B: 空白 E: 实验)Fig.22 Tertiary-butanol inhibition of free radical experiments (B: blank,E: experiment)B: 甲基橙浓度30 mg·L-1,催化剂用量10 mg·L-1, H2O2为氧源, T=30 ℃, H2O2浓度=10 mmol·L-1, pH=9, CuFe2O4@PDA-Cu为催化剂;E: 甲基橙浓度30 mg·L-1,催化剂用量10 mg·L-1, H2O2为氧源, T=30 ℃, H2O2浓度=10 mmol·L-1, pH=9, CuFe2O4@PDA-Cu为催化剂, 1mL·L-1叔丁醇.B: methyl orange concentration: 30 mg·L-1, catalyst dosage: 10 mg·L-1, H2O2 as oxygen source, T=30 ℃, hydrogen peroxide concentration : 10 mmol·L-1, pH=9, CuFe2O4@PDA-Cu as the catalyst; E: methyl orange concentration: 30 mg·L-1, catalyst dosage: 10 mg·L-1, H2O2 as the oxygen source, T=30℃, hydrogen peroxide concentration: 10 mmol·L-1, pH=9, CuFe2O4@PDA-Cu as the catalyst, tertiary butyl alcohol concentration: 1 mL·L-1.
图22显示,没加入叔丁醇的对照组甲基橙的去除速率比加入叔丁醇的实验组快. 这是由于羟基自由基进攻甲基橙, 同时也进攻叔丁醇, 使得甲基橙的氧化降解过程受到抑制.
图21和图22圴说明催化剂活化H2O2产生了羟基自由基, 羟基自由基进攻染料分子发生氧化开环降解直至矿化.
3 结 论
3.1制备得到了核壳催化剂CuFe2O4@PDA-Cu,Cu2+以配位键负载在PDA上.
3.2温度升高,催化剂用量增加,H2O2用量增加有利于增强催化活性. 氯化物、硫酸盐、磷酸盐、硝酸盐不影响催化活性;溴化物、亚硝酸盐抑制催化活性. 当pH=2~10时,随着pH值的升高活性增强,催化剂结构稳定;强碱性条件下,催化剂因结构破坏而失活.
3.3浓度为30 mg·L-1的染料废水,适宜的降解条件为T=30 ℃,催化剂用量10 mg·L-1,H2O2用量10 mmol·L-1,pH=8.5~9.5. 在此条件下,催化剂可循环使用,循环4次后,仍保留95%活性.
3.4催化剂具有较宽的底物适应性. 甲基橙、茜素红、罗丹明B可以完全被清除,含硝基和氯代溴代基团的染料24 h后脱色率可达60%以上.
3.5降解染料的效果和自由基实验结果说明,催化剂能有效活化H2O2产生羟基自由基,羟基自由基进攻染料分子实现开环降解矿化,产物有草酸、顺丁烯二酸、二氧化碳,COD值明显下降.

