应用于Suzuki偶联反应的金属催化剂研究进展
2018-07-13胡玲君聂晶晶
胡玲君,聂晶晶
(1. 浙江大学 化学系, 浙江 杭州 310027; 2. 中节能大地(杭州)环境修复有限公司, 浙江 杭州 310020)
0 引 言
金属钯催化碳碳偶联反应是合成转变中最有效、使用最多的一种技术,主要由5种反应组成: Negishi反应、Sonogashira反应、Heck反应、Stille反应以及Suzuki-Miyaura反应,反应方程式如图1所示.
其中钯催化有机硼化合物与亲电有机物进行的偶联反应,称为Suzuki-Miyaura偶联反应(也称为Suzuki偶联反应),近几十年来,一直颇受关注,是合成双芳烃化合物的重要手段之一.双芳烃化合物是制备药物、天然产物、OLED发光材料的重要中间体. 研究Suzuki偶联反应比较有名的课题组有: MICHAEL G. ORGAN、MATTHIAS BELLER、STEPHEN L. BUCHWALD、JOHN F. HARTWIG等.

图1 碳碳偶联反应Fig.1 Reactions of C-C coupling
Suzuki偶联反应常用的催化剂有均相催化剂和非均相催化剂. 均相催化剂是指催化剂与反应底物处于同一相中,有气相和液相2种,处于液相的均相催化剂居多,绝大多数均相催化剂为金属有机化合物;非均相催化剂正好相反,催化剂与反应底物处于不同体相中. 均相催化剂与反应底物处于同一相,使得反应底物更易与活性中心接触,反应速度较快,较非均相催化剂的反应速度与选择性更优. 其不足是难回收,且当产物中含有微量均相催化剂时,清除困难,在一定程度上增加了其使用成本,制约其大规模使用. 而非均相催化剂则不存在此缺陷,且具有易分离、耐高温、寿命长等优点. 随着研究的不断深入,新型的非均相催化剂载体不断被发现,比如石墨烯[1]、金属有机框架[2]等,新型载体制备的非均相催化剂在特定的催化反应中其催化性能部分达到甚至优于均相催化剂[3-4]. 金属钯为Suzuki反应常用的活性金属. 过去几十年,有大量文献阐述了Suzuki偶联反应的研究成果,如使用PdCl2[5]、Pd(OAc)2[6]等钯前驱体在配体作用下催化偶联反应,但其产物收率较低. 随着研究的不断深入,开发了不少较高效的均相与非均相催化剂,其优良的催化性能、独特的物理特性,引得研究者的广泛关注. 相较碘代芳烃和溴代芳烃,用非活性的氯代芳烃进行Suzuki反应难度较大,但由于氯代芳烃易得、价格低廉,一直是人们研究的热点. Suzuki偶联反应的机理如图2所示.

图2 Suzuki偶联反应机理Fig. 2 The mechanism of Suzuki cross-coupling reaction
下文将对均相催化剂中常用的配体以及非均相催化剂中使用的载体分别进行阐述.
1 均相催化剂
配体对金属类均相催化剂具有极其重要的影响,在不同的配体作用下,相同的底物可以生成不同的目标产物. 配体通常可提供一对孤对电子,从而与金属之间形成配位键,提供电子对的配体可以看作Lewis碱,而接收孤对电子的金属可看作Lewis酸,常见的提供孤对电子的元素有N(如四氨基二氯化钯)、C(如卡宾)、P(如四三苯基膦钯),除了元素可以提供孤对电子外,官能团同样能提供双键(如Karster催化剂)、大π键(如二茂铁)等,两者均可提供孤对电子. 而Suzuki偶联反应中使用的有机配体主要有膦配体、卡宾配体等,虽然氮与磷有类似的电子结构,但其配位能力较弱,氮配体的催化性能稍逊膦配体.膦配体与卡宾配体是20世纪80、90年代发现的新型高效配体,对其研究已取得了很大进展.
1.1 膦配体
1.1.1 钯/膦配体催化Suzuki偶联反应
在Suzuki偶联反应研究早期,通常使用均相催化剂实施该反应,20世纪末,三芳基膦类配体开始广泛应用于Suzuki偶联反应. 此后膦配体家族不断发展,比如三苯基膦、二金刚烷膦、三异丙基膦、三叔丁基膦等高效配体.
四(三苯基膦)钯是一种常用的偶联催化剂,YU等[7]用四(三苯基)膦钯为催化剂,通过偶联反应制备了二噻吩环戊二烯光学分子开关,其在光电设备中具有非常重要的地位. Suzuki反应主要是C-R键的断裂以及C-C键的形成,SI等[8]利用该原理用Pd完成了C-O单键的断裂与C-C单键的形成,通过有机酸与二(4-甲氧基)硼酸的C-C偶联生成更复杂的酮衍生物,使用Pd(OAc)2/PPh3催化体系,在室温下进行偶联反应,测试了氢化肉桂酸、溴戊酸以及苯甲酸衍生物与二(4-甲氧基)硼酸的偶联反应,当苯甲酸衍生物含有缺电子基团时收率较低,其产物收率达90%左右,当苯甲酸含有富电子基团时,产物收率降低至50%~60%,即便如此,此研究提供了一种合成复杂酮类化合物的方法.
ARANYOS等[9]在合成二芳基醚中发现,当使用1-二金刚烷膦-联苯作为配体时,能催化富电子的氯代芳烃的脱氯反应,且效果远好于三苯基膦配体,研究认为,金刚烷较苯基拥有更大的空间位阻,更有利于脱氯反应的进行. ZAPF等[10]首次使用二金刚烷膦配体催化对氯甲苯与苯硼酸的Suzuki反应,并将其与三苯基膦配体做比较. 三苯基膦作为配体时,金属钯使用量0.1 mol%,收率仅为5%,但当配体改为丁基二金刚烷膦时,0.01 mol%的Pd使用量就可将反应收率提高至94%. 在拓展反应的研究中发现,即使氯苯含有非活泼的富电子基团,产物收率仍能达到80%以上,当含有活性的缺电子基团时,产物收率可达99%,金刚烷膦配体较其他膦配体有较大优势(见图3).

图3 Pd(OAc)2/BuPAd2催化氯苯衍生物与苯硼酸的Suzuki偶联反应[10]Fig. 3 Pd(OAc)2/BuPAd2 catalyzed chlorobenzene derivatives and phenyl boronic acid[10]
吡啶类衍生物是一种具有生物活性的天然产物,可用于合成抗菌、抗癌类药物, PARK等[11]使用更大空间位阻的苄基取代正丁基,制备了Pd(OAc)2/BnPAd2催化剂,用其合成了三取代吡啶衍生物,BnPAd2配体的催化活性均高于BrettPhos、Sphos、Xphos等配体. 二金刚烷膦衍生物配体虽具有很高的催化活性,但其大多对空气敏感,易被氧化,失去活性,从而影响使用.CHEN等[12]制备了具有抗氧化的Ad3P-Pd催化剂,使用条件得到了极大改善,检测了各类大分子杂环与氟苯硼酸进行的偶联反应,得到的产物收率均高达90%以上(见图4).

图4 Pd/Ad3P催化芳基氯与芳基硼酸的Suzuki偶联反应[11]Fig. 4 Pd/Ad3P catalyzed aryl chloride and aromatic boric acid[11]
环低聚糖次苯基近年来逐渐成为OLED中的双极电荷载流子传输材料[13],在聚合物合成中,环低聚糖次苯基通常是合成线性高分子量聚次苯基的副产物[14],SUGITA等[15]首次选择性地合成了环次苯基聚合物,且线性聚合物无副产物生成(见图5).

图5 选择性合成环次苯基聚合物[15]Fig. 5 Selectively synthesis cyclic polyphenylene[15]
多孔材料具有高比表面、较好的热稳定性,还可作为气体吸附剂、储气材料以及催化剂(或催化剂载体),为了使合成的多孔材料具有一定的功能,研究者开始热衷于使用具有功能性官能团的单体,聚合生成多孔材料,同时试图使多孔材料内部空腔尽可能大(大于600 m2·g-1). 传统的多孔共价有机聚合物虽然具有高吸附能力,但其物理化学稳定性较差,在实际应用中难以重复利用.BEN等[16]于2009年首次制备了聚四苯基多孔材料;受此启发,GUO等[17]制备了具有高比表面(891 m2·g-1)、高热稳定性(升温至1 000 °C时,仅失重40%)、特殊化学特性(不溶于有机溶剂)的聚六苯基二金刚烷多孔材料,并以六-(4-溴苯基)-1,1’-二金刚烷与二硼酸芳烃化合物为底物,在四(三苯基)膦钯、碳酸铯的条件下催化合成(如图6所示),可以吸附H2、CO2、CH4、苯蒸气、正己烷蒸气等有机蒸气. 因此,可用于工业化储气和作为去除有害蒸气的吸附剂.

图6 Suzuki反应合成聚六苯基二金刚烷多孔材料[17]Fig. 6 Synthesis polyhexaphenylbiadamantane through Suzuki reaction[17]
1.1.2 其他金属/膦配体催化Suzuki偶联反应
2003年大阪大学KAKIUCHI等[18]使用Ru催化剂(RuH2(CO)(PPh3)3)将2’-甲基苯乙酮邻位的C-H断裂,与频哪硼烷偶联生成联苯衍生物. 次年,该课题组使用该催化体系将2’-甲基-6’-甲氧基苯乙酮的甲氧基去除与频哪硼烷反应生成联苯化合物[19],此法是当时实现C-O键断裂生成C-C键的有效手段. UENO等[20]发现RuH2(CO)(PPh3)3有断裂C-H和C-O的能力,将2种催化功能综合并应用于同一反应中,同样使用RuH2(CO)(PPh3)3为催化剂,将邻甲氧基苯乙酮苯环上邻位C-H的断裂用于与乙烯基三甲基硅烷的加成反应,苯基与甲氧基的C-O键断裂后与芳基硼偶联生成偶联反应,最终生成联苯三甲基硅烷衍生物(其反应机理见图7). TOBISU等[21]随后使用[Ni(COD)2]/PCy3催化体系,在碱CsF的作用下,将苯甲氧基衍生物拓展至2-甲氧基萘及其衍生物与芳基硼的碳碳偶联.

图7 RuH2(CO)(PPh3)3催化芳基酮脱羰基形成C-C键的反应机理[21]Fig. 7 The formation of C-C catalyzed by RuH2(CO)(PPh3)3[21]
现有理论认为,有机配体的给电子能力与催化活性有非常重要的联系,KUMAR等[22]的研究证实了该理论,发现当增加吡啶邻位的氮原子数目时,配体的给电子能力得以增强,增加了Co的催化活性,其反应机理如图8所示.
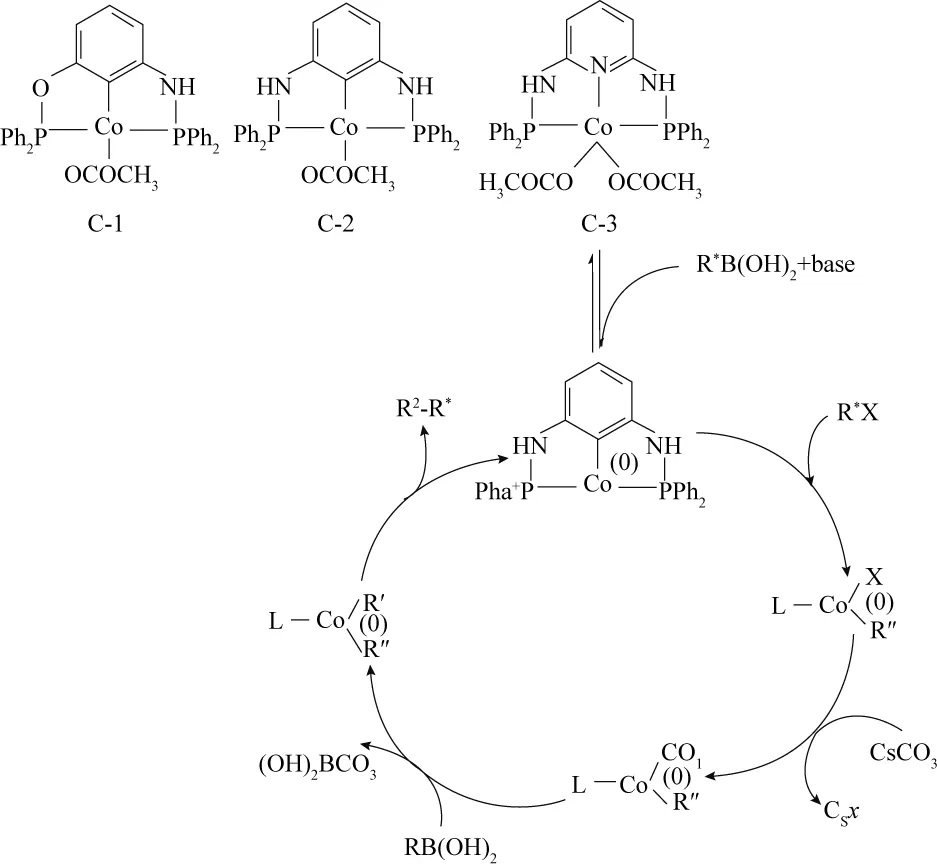
图8 Co(COOCH3)2/N,N-二(二苯基膦)-1,5-二氨基苯催化Suzuki反应机理[22]Fig. 8 Mechanism of Co(COOCH3)2/N,N-di(PPh2)-1,5- diaminobenzene in Suzuki reaction[22]
1.2 氮杂环卡宾(N-Heterocyclic Carbene)配体
自从ARDUENGO等[23]首次制备出稳定的NHC以来,NHC与金属配位后的催化性能研究广受关注,相继发表了大量研究成果,如Pd-NHC[24]、Ru-NHC[25]、Rh-NHC[26]、Ni-NHC[27]等.
2002年,GSTÖTTMAYR等[28]使用钯/二金刚烷膦咪唑卡宾在室温下催化氯苯衍生物的偶联反应,其对非活泼的富电子氯苯产物的收率高达99%. 由于金刚烷与环己烷具有类似的分子结构,ALTENHOFF等[29]将金刚烷基更改为环己基,制备了双环己烷咪唑卡宾配体,同样可在室温下催化非活泼氯苯与苯硼酸的偶联反应,产物收率为66%~95%,稍逊色于文献[28]的结果.
BEN等[30]开发了一种新型Pd-Carbene催化剂用于芳基酯的偶联反应(见图9),当硼酸取代基为电中性或富电子基团时,产物收率大于80%,但4-羟基苯硼酸的产物收率只有58%,含有缺电子基团时,产物收率稍低(>70%). 当用芳基酯取代基时,无论在电中性、富电子、缺电子时,其产物收率都较好. 结果表明,该反应收率主要与有机硼取代基的极性有关.

图9 Pd(IPr)(cinnamyl)Cl催化芳基酯与有机硼酸的偶联反应[30]Fig.9 Pd(IPr)(cinnamyl)Cl catalyzed cross-coupling aryl esters with organoboron acids[30]
BEGUM等[31]将咪唑类卡宾固载于SiO2后与金属钯配位,在卤代芳烃的偶联反应中,即便溴代芳烃含有富电子基团,其产物收率也可高于90%,但氯代芳烃即使在缺电子基团时其活性也较差(产物收率低于80%),但相较于均相的卡宾催化剂,氯代芳烃具有可重复使用的优势,2016年,PAHLEVANNESHAN等[32]也发表了类似的研究成果.
OHTSUKI等[33]将Ni-Carbene(imidazol-2-ylidene bearing 2-adamantyl)应用于催化芳基酯/芳基甲酸盐与苯硼酸的偶联反应, 发现其适用的非活泼产物较之前报道的三环己基膦更广. 无论取代基为富电子还是缺电子基团,反应产物收率均高达60%以上,即使是非活性的杂环硼酸酯,产物收率也可达67%~76%.当磺酸酯取代基为富电子基团或苯基邻位有取代基时,会产生75%的硼酸酯的自偶联产物,但当邻位为甲基时,产物收率可达75%,这可能是由于苯基的大π键的供电子能力较强且空间位阻大,阻止了偶联副产物的生成(见图10).

图10 Ni(COD)2/carbene 催化芳基甲酸盐与芳基硼的偶联反应[33]Fig.10 Ni(COD)2/carbene catalyzed cross-coupling of aryl carbamate with aryl boron reagents[33]
1.3 其他配体
ZAWARTKA等[34]开发了独特的具有手性结构的咪唑类钯催化剂,其结构如图11所示. 此均相催化剂在空气中稳定,无须在惰性气体下保存. 将其应用于催化苯硼酸与溴苯衍生物的偶联反应中,即使是低活性的对溴苯酚、大位阻的1-溴萘醇,其产物收率均高达95%,甚至100%,但2-溴苯乙酮反应产物收率只有50%,在羰基化Suzuki-Miyaura反应中,使用对碘苯甲醚、苯硼酸、CO(1atm)作为反应底物,其反应物能够完全转化,且二酮的选择性可达90%(见图11).
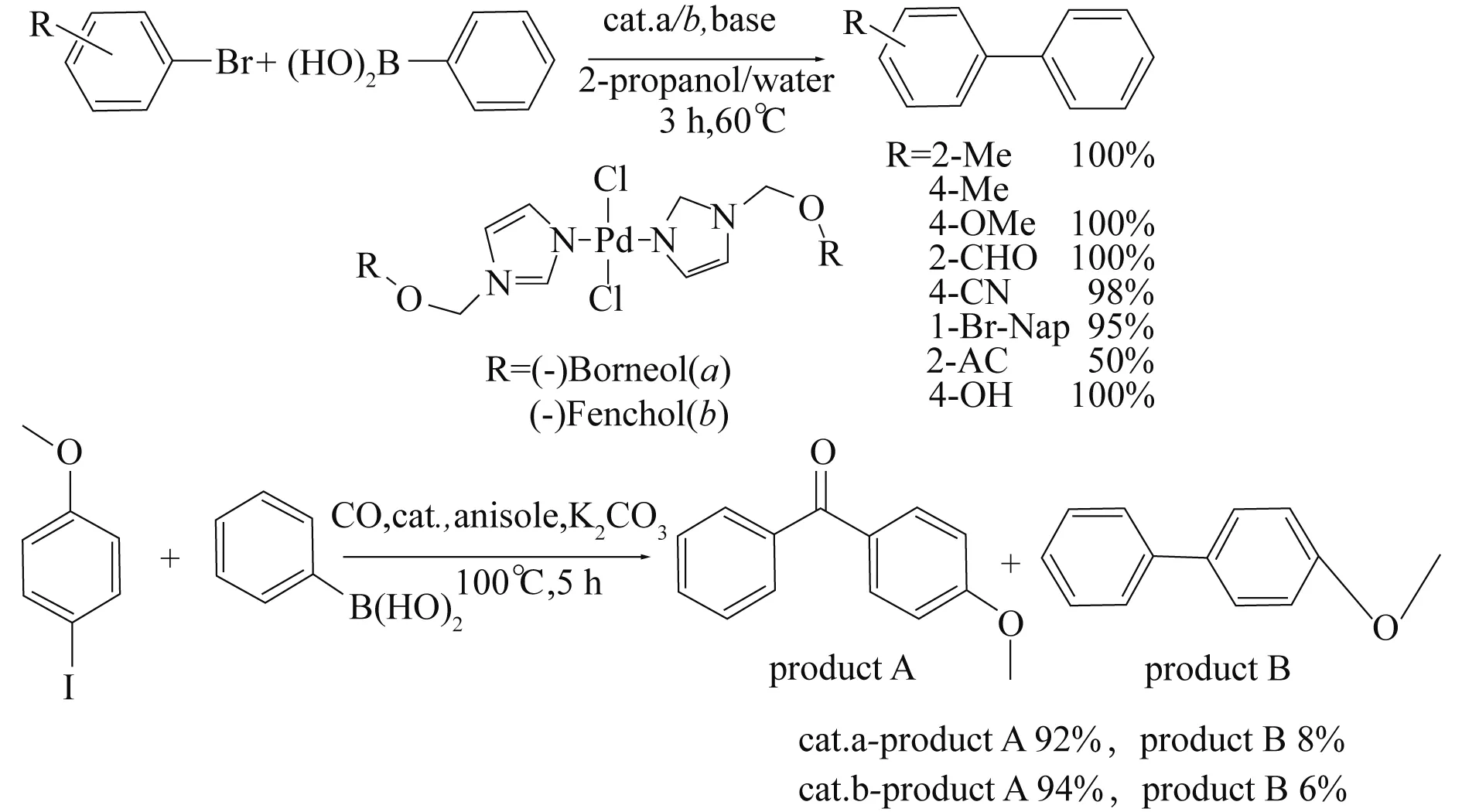
图11 Pd-手性咪唑配体催化溴(碘)代芳烃的Suzuki反应[34]Fig. 11 Pd-chiral imidazole ligands catalyzed the Suzuki reaction of aryl chloride(iodide)[34]
2 非均相催化剂
在非均相催化剂的反应中,由于催化反应发生在表面(界面). 为使催化剂具有更多的活性位,要求非均相催化剂具有尽可能大的比表面积,其主要的途径就是增加催化剂载体的内比表面积,即增加非均相催化剂的多孔性,使其更有利于金属颗粒的分散,提升反应底物与活性位接触的概率,增加反应活性.同时,不同的载体孔道对反应产物的择型有一定的影响,载体的表面官能团、电子特性等均对非均相催化剂的稳定性、催化活性、催化选择性影响很大. 在非均相催化剂中,虽然金属颗粒的大小对反应有一定的影响,但在某些催化体系中,在相同的金属颗粒尺寸范围内,载体对催化剂的催化性能起到类决定性作用. 金属钯作为Suzuki反应常用的活性金属,已开发了各种钯负载类非均相催化剂,如Pd/C[35]、Pd/分子筛[36]、Pd/水滑石[37]Pd/SiO2[38]、Pd/Al2O3[39]以及其他无机氧化物[40]. 近年来,新型载体如氧化石墨烯(GO)、离子液体(ionic liquids)、金属有机框架(MOFs)广受关注,并将这类新型载体应用于各种有机反应中. 除钯之外,其余金属如Ni[41]、Cu[42]、Fe[43]等均可作为Suzuki反应的活性中心.
2.1 常见载体
MARCK等[44]报道了Pd/C、配体Ph3P作用下催化溴苯衍生物与苯硼酸衍生物的Suzuki偶联反应,产物收率高于85%(见图12).

图12 Pd/C在Ph3P作用下催化溴苯衍生物的偶联反应[44]Fig.12 Pd/C with Ph3P catalyzed cross coupling of Bromobenzene derivatives[44]
2001年,LEBLOND等[45]报道了一项突破性进展,即在无有机配体的条件下,使用5% Pd/C、乙酰胺(DMA)/水(v∶v=20∶1)共溶剂系统催化氯苯衍生物与苯硼酸偶联反应,虽然氯苯取代基为缺电子基团,但联苯产物收率仍高达79%~90%,当缺电子基团更改为富电子基团时,产物收率大幅下降,降至32%~54%(见图13).

图13 Pd/C在80 °C下催化氯苯衍生物的偶联反应[45]
Fig.13 Pd/C catalyzed cross coupling of chlorobenzene derivatives at 80 °C[45]
根据LEBLOND等[45]的研究,Pd/C体系中,反应溶剂的极性对催化效果影响较大,随后HEIDENREICH等[46]同样使用高极性溶剂(NMP/H2O),在较低钯使用量(0.25 mol%)下,对氯苯乙酮与苯硼酸反应的产物收率可高达98%,这可能是由于在120 °C高温下,载体上的Pd(II)溶解于反应体系中,从而加速了反应进程(见图14).
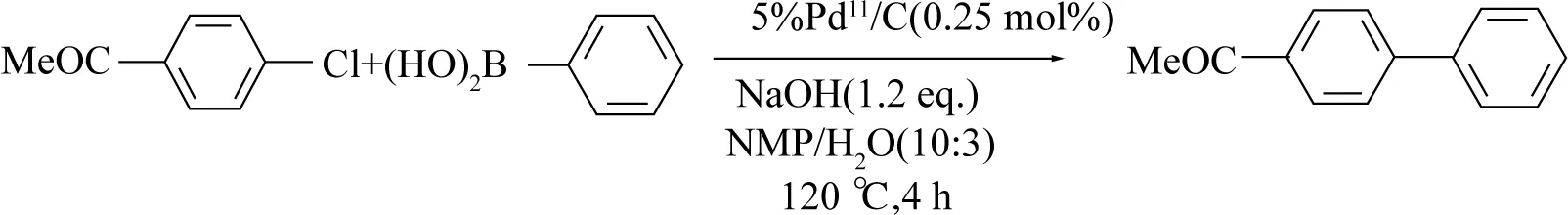
图14 Pd(II)/C催化对氯苯乙酮与苯硼酸的偶联反应[46]Fig. 14 Pd(II)/C catalyzed cross-coupling of chloroacetophenone with phenylboronic acid [46]
随着环境意识的不断增强,研究者一直致力于寻找更清洁、更环保的方法合成目标产物,用非毒性溶剂水代替有机溶剂已是一种趋势,且水具有较高的极性,符合LEBLOND的研究结果. ARCADI等[47]发现,使用水作为反应溶剂时,加入表面活性剂CTAB可以加速芳基氯与苯硼酸的C-C偶联反应,可能是由于CTAB作为相转移催化剂,有利于有机物转移至水相中,水相转移至有机相中,从而加快反应速度. 虽然CTAB在芳基溴以及含有缺电子基团的芳基氯的反应中催化效果较好,但是富电子芳基氯的产物却不尽如人意. LYSN等[48]发现,当用同为相转移催化剂的TBAB代替CTAB时,芳基氯衍生物拓展至富电子基团,收率可达到66%~81%,且可以在空气体系下完成反应(见图15).
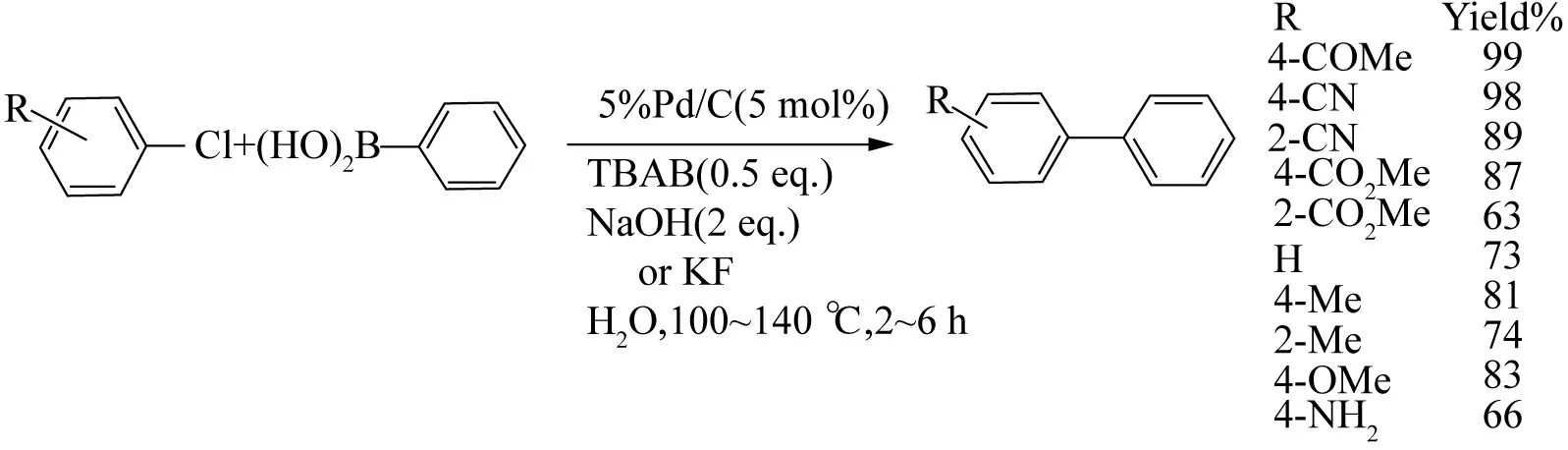
图15 Pd/C在水相中催化氯苯偶联[48]Fig. 15 Pd/C catalyzed cross-coupling chlorobenzene[48]
XIA等[49]合成了核壳结构的Ni-Pd/炭黑催化剂,以等体积的乙醇/水作溶剂,在室温下反应45 min,即可将溴苯转化为90%的联苯,且对于大位阻的1-碘萘、1-溴萘的偶联反应,其产物收率也可达到89%. 于是又将Pd/C拓展至催化杂环类卤代芳基的偶联反应中[50].
除了用传统的活性炭作为载体,目前纳米碳纤维[51]、纳米碳球[52]、石墨烯[53]等碳源载体不断被开发. DONG等[54]将钯颗粒负载于规则的纳米碳球上,用乙醇/水作为反应溶剂,溴苯衍生物与苯硼酸产率高达90%~99%.
分子筛是由硅铝组成的一类微孔晶体,硅铝为分子筛提供了一定强度的Born酸和Lewis酸2种酸性位,可用于合成化学中间体、精细化学品,由于其具有极好的热稳定性,被广泛应用于石油化工行业. DEY等[55]将PdCl2负载于4A分子筛上,TBAB为相转移催化剂,DMF为溶剂,在120 °C下反应16 h,含缺电子基团的对氯苯甲醛与苯硼酸偶联后的产物收率高达98%. 即使是含富电子基团的对甲氧基氯苯,其产物收率也高达73%. STIJN等[56]于2015年合成了类金属酶分子筛并将其用于催化C-C偶联反应. 虽然,分子筛拥有比较大的比表面和均一大小的孔径,有利于金属颗粒的分散,但是,由于大多数分子筛具有一定的酸性中心,而Suzuki偶联反应的反应体系需要碱性环境,故当反应底物活性较低时,其催化活性较弱,一定程度上抑制了分子筛在Suzuki偶联反应中的应用.
ESMAEILPOUR等[57]将纳米钯负载于含有聚乙烯吡咯烷酮支链的磁性SiO2载体上,NMP作为溶剂,在K2CO3作用下,90 °C反应4 h后,氯甲苯与苯硼酸的收率可达89%,卤代杂环与苯硼酸的收率也高达80%以上,且用磁铁简单回收催化剂后,可重复使用6次.合成催化剂所需原料价格低廉、合成方法简单、重复利用性能好,较均相催化剂优势明显(见图16).

图16 Pd/NMP@SiO2结构示意图[57]Fig. 16 The structure of Pd/NMP@SiO2[57]
2.2 聚合物载体
虽然均相催化剂拥有低使用量、高选择性等优点,但异相催化剂的纳米金属具有可回收性、高比表面积等优势. 高度分散的纳米金属对催化性能的提升较明显. GALLON等[58]于2007年使用聚苯胺作为纳米钯的载体(其还可以作为纳米钯制备过程中的还原剂与稳定剂), 发现即使是活性较弱的氯芳基以及含有富电子基团的氯芳基与苯硼酸反应后的产物,收率也达到了89%~99%. 由于C-F键的键能较强,故能作用于氟芳基的偶联反应较少,即使是均相催化剂亦不能得到理想的产物收率,但增加催化剂使用量、升高反应温度、延长反应时间,对二氟苯与苯硼酸的产物收率可高达60%,这可能与PANI上大量的苯环大π键与钯的协同作用有关.鉴于PANI具有一定的还原性能,文献[58]对4-叔丁基氯苯的自偶联反应(Ullman偶联)进行了研究,在0.5 mol% Pd/PANI, 80oC下反应2 h即得到99%的产物收率,即便是活性较高的Cu在Ullman偶联反应中也需要较高的反应条件才能达到如此高的收率. ANDERSON等[59]发现氯代芳烃在KOH作用下可生成相应的芳基酚,Pd/PANI作为串联催化剂,2-氯苯与苯硼酸反应生成2-氯联苯后,加入等体积的1,4-二氧六环、5倍当量的KOH,继续反应6 h后,2-苯基苯酚收率可达70%(见图17).

图17 Pd/PANI催化非活性卤代芳烃[59]Fig. 17 Pd/PANI catalyzed unactivated aryl halides[59]
RANGEL等[60]在嵌段共聚物F-127的作用下,通过水热法合成了与PANI类似结构的聚酰亚胺(PI),使用溴苯与苯硼酸衍生物研究Pd/PI的催化性能,发现苯硼酸对位为富电子基团时,在溴苯的自偶联产物增多的同时,偶联产物也增多,说明富电子取代基加速了催化活性. 但当苯硼酸对位为缺电子基团时,在同等反应条件下,未见任何偶联产物生成.
YU等[61]合成了多孔离子共聚物(PIC),并将其作为Pd(OAc)2的载体,用于催化芳基氯与苯硼酸的偶联反应.催化过程未使用金属钯颗粒制备的催化剂,而是利用反应机理将Pd(II)还原为Pd(0)参与催化循环,不仅可以在空气中进行催化,而且对富电子取代基的活性也较好.PIC结构示意图如图18所示.

图18 PIC结构示意图以及用于催化芳基氯C-C偶联[61]Fig. 18 The structure of PIC and catalyzed cross-coupling of aryl chlorides[61]
Pd负载于聚合物胶体上形成钯金属胶体催化剂,同样可用于催化Suzuki反应[62],YE等[63]使用六齿配体(L)与钯配位后,形成钯金属溶胶异相催化剂Pd3L,该催化剂虽然不能催化乙醇为溶剂的氯苯衍生物与苯硼酸的偶联反应,但是在溴苯及其衍生物的偶联反应中,产物的收率高达99%,并且催化剂的使用量只有0.005 mol%,很少有催化剂(即便是均相催化剂)在使用量如此少时能达到如此高的反应活性,Pd3L循环使用7次,其催化活性只降低了3%. DELL’ANNAA等[64]用poly(Pd(AAEMA)2)(AAEMA=2-(acetoacetoxy)ethyl methacrylate)作为催化剂、水为溶剂,在不添加相转移催化剂(如TBAB、CTAB)的条件下,氯代芳烃的收率可达98%. 这可能是由于聚合物Pd-pol在水中的溶胀作用[65],促使底物与活性中心更好接触,从而最大化完成转化过程,相较某些均相催化剂,其金属使用量减少了10倍多,文献[64]只使用0.1 mol的Pd进行催化反应,且使用“一锅法”重复利用催化剂5次后,催化活性无明显降低(见图19).
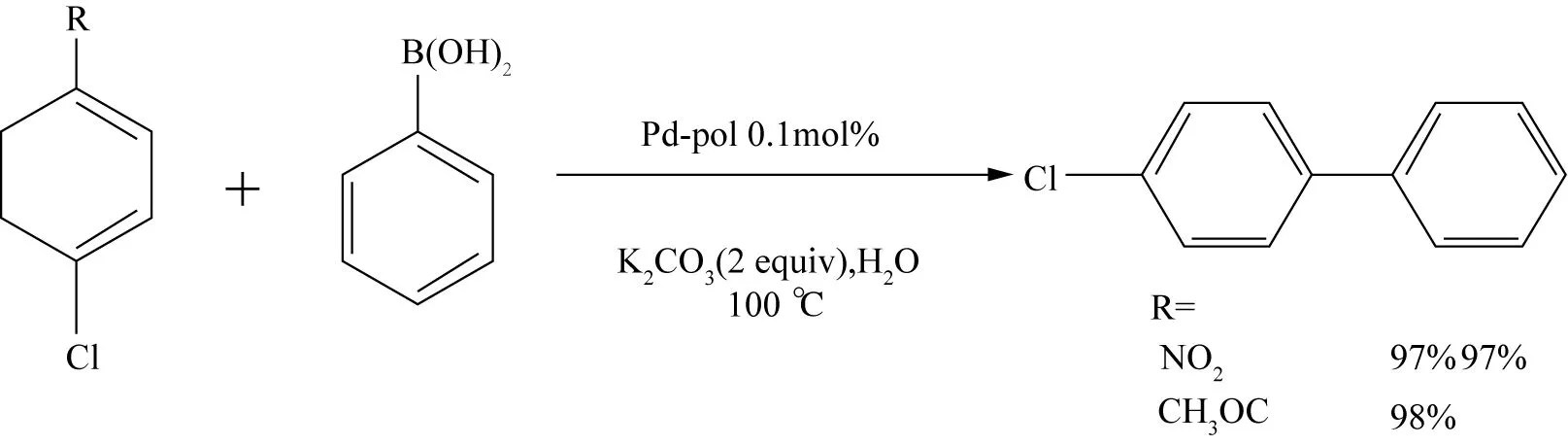
图19 Pd-pol催化4-取代氯苯与苯硼酸的偶联反应Fig. 19 Pd-pol catalyzed cross-coupling of para substituted chlorobenzene with phenylboronic acid
2.3 金属有机框架
金属有机框架(metal organic frameworks,MOFs)是由有机配体和金属离子或团簇通过配位键自组装形成的具有分子内孔隙的有机-无机杂化材料,其示意图如图20所示.

图20 MOFs 结构示意图[66]Fig. 20 The structure of MOFs[66]
MOFs具有高比表面积(现今发现的MOFs比表面积最高可达5 000 m2·g-1)[67]、多孔、化学可调性、均一的孔径,其可作为一类功能性材料. 在异相催化、气体吸附、气体或有机蒸汽分离中有其独特的特性. 2007年, XAMENA等[68]使用Pd-MOFs在150 °C下催化对溴苯甲醚与苯硼酸的偶联反应,其产物收率只有90%. YUAN 等[69]首次将纳米金属负载于MOFs并用于催化Suzuki偶联反应,通过湿法浸渍将钯纳米颗粒负载于具有类分子筛结构的MIL-101(比表面积达4 000 m2·g-1)上[70],在甲醇钠作用下,氯苯衍生物Suzuki反应产物收率为81%~97%. 当氯苯邻位为甲氧基时,由于邻位甲氧基的位阻以及供电子能力,使2-甲氧基氯苯的产物收率降低至90%以下(81%). 较使用Pd/ZIF-8催化对氯苯甲醚的偶联反应[71]有极大提高.

图21 Pd/MIL-101催化氯苯衍生物偶联反应[69]Fig. 21 Pd-MIL-101 catalyzed cross-coupling of chlorobenzenederivatives[69]
PASCANU等[72]将钯负载于氨基改性后的MIL-101(MIL-101_NH2),并将反应拓展至杂环与硼酸的偶联,使用碘代、溴代芳烃化合物的偶联产物均高达99%,并研究了各类杂环硼酸与卤代苯衍生物的反应,在20 °C或者50 °C下,反应产物收率均达91%以上,此研究将Suzuki偶联反应产物拓展至各类五元、六元类杂环(见图22).

图22 Pd/MIL-101_NH2室温下催化氯苯衍生物偶联反应[72]Fig. 22 Pd/MIL-101_NH2 catalyzed chlorobenzene derivatives at room temperature[72]
DONG等[73]不同于传统的将负载金属钯负载于MOFs-5表面,而是将金属钯颗粒渗透至MOFs-5孔道内部,并研究MOFs-5在不同焙烧条件下对Suzuki反应催化性能的影响. 实验结果表明,当MOFs-5在氮气下900 °C焙烧后,催化反应活性最好,虽然对氯芳烃的催化性能较差,但是对含有富电子基团的溴芳烃的催化活性较好(见图23).
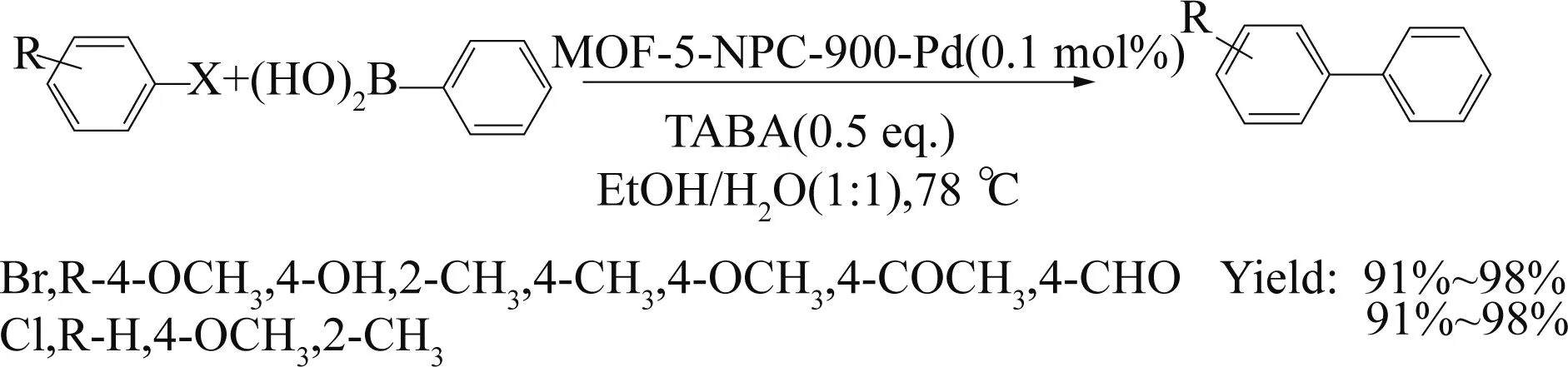
图23 MOF-5-Pd催化溴苯、氯苯的偶联反应[73]Fig. 23 MOF-5-Pd catalyzed cross-coupling bromobenzene, chlorobenzene[73]
研究者制备了不同配位金属的MOFs,并将其作为载体,研究其对Suzuki反应性能的影响,如Ni-MOFs[74]、Zr-MOFs[75]、Cu-MOFs[76]、Zn-MOFs[77]等.
2.4 氧化石墨烯(graphene oxide,GO) /石墨烯(graphene)
由于石墨烯与氧化石墨烯具有归一的2D结构、高比表面积等特性,近年来被广泛用于异相催化剂的研究,其可用于各类金属纳米颗粒的载体,如Pd[78]、Au[79]、Co3O4[80]、Fe3O4[81]以及Au@Pt[82]. 同时发现,对石墨烯掺杂改性可以提高石墨烯的原有特性,SCHEUERMANN等[1]通过离子交换法将Pd(II)负载于GO,并阐述了在Suzuki偶联反应中,钯纳米颗粒大小较GO上功能化基团更重要. KWON等[53]将离子聚合物(芘-聚甲基丙烯酸二甲胺乙酯-b-聚乙二醇甲基醚甲基丙烯酸酯)嵌入至还原氧化石墨烯(rGO)中,制备了离子聚合物掺杂型石墨烯载体(IPG),使用苯甲酸还原负载于IPG上的Pd(II). 使用碘苯衍生物与苯硼酸的反应来检测Pd-IPG的催化性能,虽然对于溴苯的催化活性较弱(收率24%),但其在碘苯的偶联反应中,对于活性较弱的富电子取代基的碘苯的催化活性非常好(收率98%). 实验结果表明,与未掺杂离子聚合物的Pd-rGO催化性能对比,Pd-IPG的TON高出Pd-rGO 16倍,这是因为离子聚合物有利于Pd纳米颗粒的均匀分布,由离子聚合物的协同作用所致(见图24).

图24 Pd-IPG空气下催化碘苯的偶联反应[53]Fig. 24 Pd-IPG catalyzed cross-coupling of iodobenzene under air[53]
FAREGHI-ALAMDARI等[83]使用氯代二苯基膦(ClPh2P)配体与GO制备了膦功能化氧化石墨烯载体(PFG),通过乙醇还原Pd(OAc)2-PFG制备了催化剂Pd-PFG,其反应条件与KWON类似,虽然其催化溴苯、氯苯的收率较高,但其催化剂使用量是KWON的12倍,且重复使用次数较KWON低一半,Pd-PFG能够催化氯苯、溴苯,一定程度上是由于P-Pd的配位增加了金属钯的催化活性(见图25).

图25 Pd-PFG催化卤代苯的偶联反应[83]Fig. 25 Pd-PFG catalyzed cross-coupling of halogenated benzene[83]
BAI等[84]报道了将N-氨乙基-γ -氨丙基三甲氧基硅烷(AATPS)通过共价键连接至GO,从而形成N-Pd(II)配位催化剂(见图26).从图26中可以看出,随着卤代芳烃活性的降低,反应所需时间越来越长,GO-2N-Pd(II)的催化活性明显高于Pd-PFG,且不需要在惰性气体条件下完成,重复使用性能与Pd-PFG相近(可重复使用5次).

图26 GO-2N-Pd(II)示意图以及用于催化卤代芳烃[84]Fig. 26 The structure of GO-2N-Pd(II) and catalyzed aryl halides[84]
对于Suzuki偶联反应而言,Fe的催化活性较Pd要弱很多,Fe通常需要特定的配体、高使用量或苛刻的反应条件,但WANG等[85]使用双性配体tris(triazole)-polyethylene glycol与FeCl3配位后,加入NaOH制备α-Fe2O3,再将此预催化剂负载于氧化石墨烯上(GO),从而制备了催化剂α-Fe2O3/GO,只使用了极少量的催化剂(150× 10-6)催化溴苯衍生物与苯硼酸的反应. 研究发现,溴苯取代基的缺电子、富电子特性对产物收率并无明显影响,此特点与金属钯催化Suzuki偶联反应的机理有一定差别,通常卤代苯取代基为吸电子基团时产物收率明显高于推电子基团衍生物,此由Suzuki偶联反应的反应机理决定(见图 27).此外,文献[85]还考察了Fe(0)、GO、α-Fe2O3、α-Fe2O3/AC在同等条件下的催化活性,Fe(0)、GO、α-Fe2O3均无催化活性,α-Fe2O3/AC反应产物的收率只有23%,这可能是由于GO的高比表面特性使活性中心(α-Fe2O3)周围反应底物的浓度增加,从而提高了反应效率,但对α-Fe2O3/GO催化Suzuki反应的反应机理尚不明朗,需进一步研究.
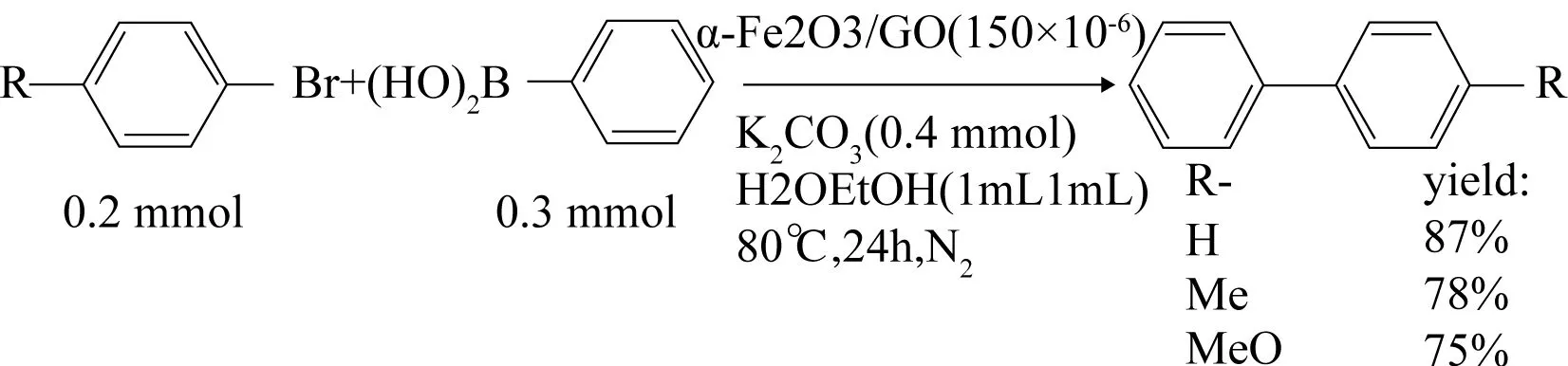
图 27 α-Fe2O3/GO应用于4-取代溴苯偶联反应[85]Fig. 27 α-Fe2O3/GO catalyzed cross-coupling of p-substitudebromobenzene[85]
2.5 其他载体
SHARMA等[86]抛开常规载体,从大自然中去寻找高效载体植物叶,正因为植物叶表面具有微孔结构/纳米孔结构,该特性使纳米钯颗粒与植物叶表面形成强作用力,有效防止纳米钯颗粒的聚集与流失,该催化剂在溴苯(对甲氧基溴苯)与苯硼酸的反应中,联苯(4-甲氧基联苯)的收率为80%左右,达到该催化剂效果,这很可能是由于植物叶表面与纳米钯的强相互作用,虽然该催化剂不能回收利用,但为制备催化剂提供了一种全新的思路.
LEBASCHI等[87]用黑茶叶浸泡后的滤液作为PdCl2的还原剂和溶剂,制得Pd NPs,通过TEM测试,Pd颗粒大小为7 nm左右时,其催化4-甲基溴苯与苯硼酸的产物收率高达98%,较文献[86]的研究结果有显著提升. 其另一个优点是,钯纳米颗粒在无载体的情况下,重复使用5次后,产物收率仍高达80%,重复利用性能较传统纳米钯有显著提升,且未出现聚集、流失等情况. 以上研究给人们制备催化剂打开了新的视角. 此后,用天然产物制备催化剂的研究成果越来越多.
LICHTENEGGER等[88]用(NH4)2Ce(NO3)6、SnC2O4、PdCl23种前驱体在甘氨酸、硝酸作用下生成多孔固体产物CexSnyPd0.01O2-z(x+y=0.99),并使用溴苯衍生物与苯硼酸的反应对其催化及重复使用性进行研究,其特殊点在于不再是简单的负载金属钯,而是合成了含有钯、锡、铈的3金属氧化物,具有统一的晶型结构,而不是3种氧化物的简单混合. 因其重复使用性能优良,故对其在固定床中进行试验,并有望大规模工业化使用,这是均相催化剂难以企及的优势.
QI等[89]首次发现氯代全氟烷烃与苯硼酸偶联生成联苯化合物的方法,更重要的是在室温下就可以完成该进程,且未使用贵金属(Pd、Ni等),而只是使用了易得的铜粉. 研究发现,铜粉催化氯代全氟烷烃的偶联反应条件与传统Suzuki偶联反应条件有较大区别: 1)铜粉催化反应必须有氧气存在才能顺利完成,而传统条件大多数需要在惰性气体下完成;2)不需要碱的协助. 虽然全氟烷烃偶联产物收率较低,但提供了一种合成全氟芳烃的全新方法,且催化剂廉价、易得,还可将偶联反应放大生产,文献[89]还给出了可能的反应机理(见图 28).
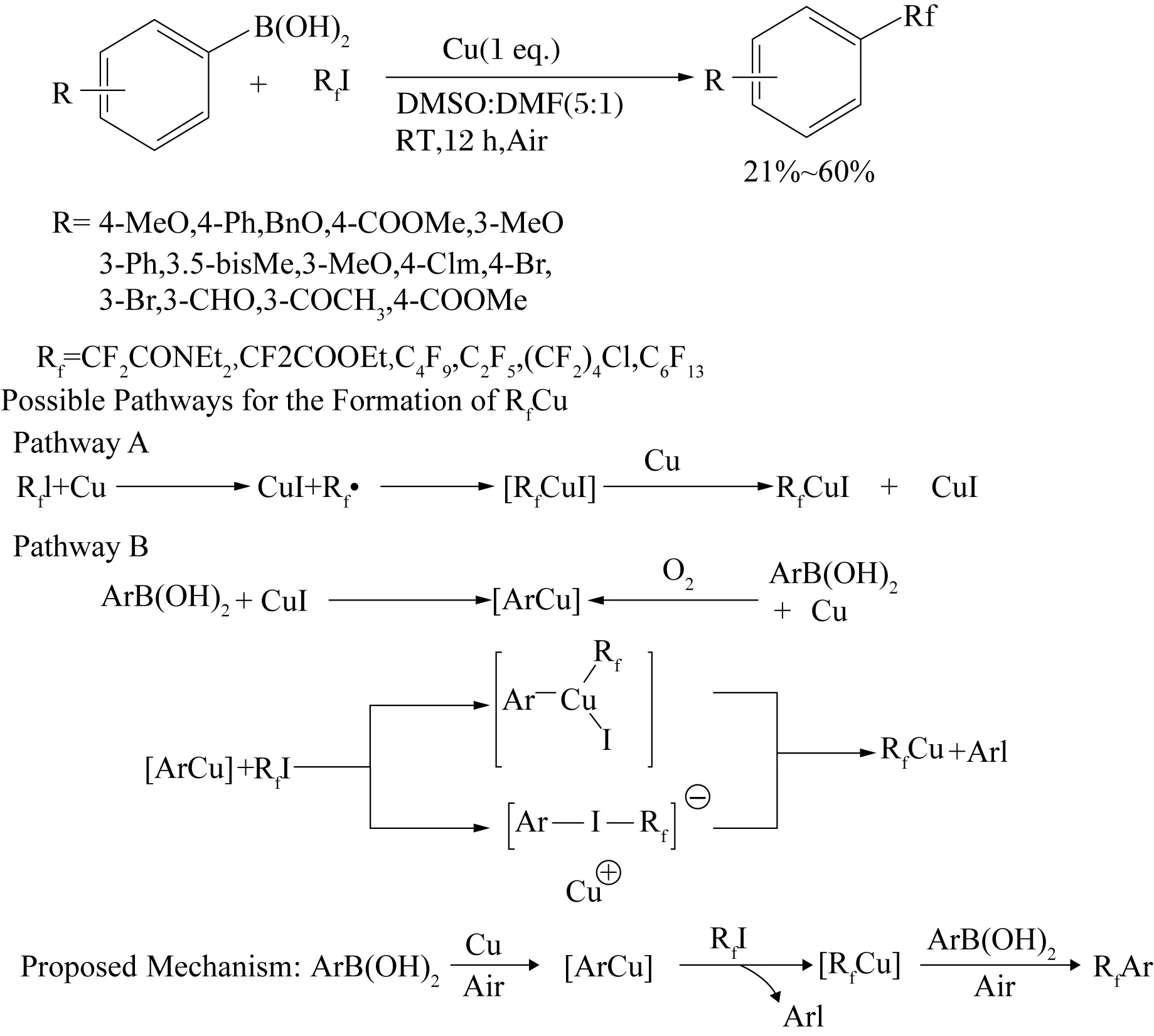
图28 铜粉催化碘代全氟烷烃的偶联反应以及可能的反应机理[89]Fig. 28 The possible pathways of copper powder catalyzed cross-coupling of perfluoroalkyliodides[89]
3 结果与展望
近几十年来,Suzuki偶联反应的研究得到了飞速发展,人们不断开发出新型配体、新型载体,虽然Pd/MOFs、Pd-P、Pd-NHC等均为较优催化剂,但MOFs反应产物收率低、制备步骤烦琐、有机配体通常需要在惰性气体下完成、价格高昂,迄今为止,鲜有研究在不降低活性的条件下,将均相催化剂进行固载化后用于催化反应. 新型高效的载体经过近10 a的发展,尚无法在成本、稳定性、产量上达到传统载体的条件.随着科学技术的发展和研究的不断深入,正在逐步开发可回收的均相催化剂和能低成本、大规模生产的载体,以逐步消除均相与非均相催化剂之间的界限.

