色氨酸在Nafion-聚半胱氨酸修饰电极上的 电化学行为及分析测定
2018-07-11秦会安侯婷婷
王 玲,秦会安,侯婷婷,李 倩
(郑州师范学院化学化工学院,河南郑州 450044)
色氨酸(tryptophan,Trp)是人体必需氨基酸之一,具有调节蛋白合成,促进人体免疫消化的功能,其代谢异常会引起神经功能障碍。人和动物自身不能合成色氨酸,需要通过食物获取,因此,色氨酸被广泛应用于食品、饲料以及医疗行业。规范及检测市场产品中色氨酸的含量是一项重要的工作,建立色氨酸测定方法具有重要意义。目前测定色氨酸的方法主要有荧光光谱法[1]、高效液相色谱法[2]、分光光度法[3]和毛细管电泳[4]等技术。电化学方法与上述方法相比,具有快捷、灵敏,检测成本低的优点。但是,色氨酸在传统电极上的电化学氧化有较高的过电位[5],直接测定灵敏度不高。另外,酪氨酸与多个氨基酸在很多发酵产物中同时存在,氧化电位与色氨酸几乎重叠,传统电极无法选择性检测色氨酸。许多新材料修饰的电极被应用于色氨酸的测定[5-11]。但是在实际样品中,直接实现高灵敏、高选择性的测定色氨酸仍然是一个挑战。
氨基酸由于含有氨基和羧基两种官能团,具有许多优良的特性,常被用作电极修饰材料。L-半胱氨酸(L-cys)是常见的20种天然氨基酸之一,具有良好的电化学活性,在电极表面聚合形成的高分子膜具有良好的催化功能和生物兼容性。Nafion膜是一种全氟磺化聚合物,具有较强的成膜性,在电极表面形成的高分子膜对电极具有较好的保护作用,被广泛用作电极修饰剂应用于电化学领域[12]。目前Nafion/L-cys/GCE用于色氨酸的检测还未见有报道。
本文通过电聚合和滴涂方式将半胱氨酸和Nafion共修饰于玻碳电极(GCE)上,制备了Nafion-聚半胱氨酸修饰电极(Nafion/L-cys/GCE)。该修饰电极对色氨酸电化学反应具有较强的催化作用,据此建立了灵敏检测色氨酸含量的新方法。与目前报导的色氨酸电化学检测方法相比,该修饰电极制备过程简便,灵敏度高,为色氨酸定量分析提供了方法参考。
1 材料与方法
1.1 材料与仪器
色氨酸和L-半胱氨酸 阿拉丁试剂(上海)有限公司;Nation 上海河森电器有限公司;磷酸氢二钠、磷酸二氢钠、磷酸、氢氧化钠、精氨酸,赖氨酸、精氨酸、谷氨酸、柠檬酸、抗坏血酸等 国药集团化学试剂有限公司;香蕉 某百货超市;水 超纯水。
RST5000电化学工作站 苏州瑞斯特仪器有限公司;pHS-3D酸度计 上海精密科学仪器公司;81-2型恒温磁力搅拌器 上海司乐仪器有限公司;KQ-100DE型数控超声波清洗器 昆山市超声仪器有限公司;艾科蒲ABW-0501-U高纯水机 长沙市秋龙仪器设备有限公司;BS224S 电子分析天平 北京赛多利斯天平有限公司;H1850离心机 湖南湘仪离心机仪器有限公司;BCD-218EMG3C新飞冰箱 河南新飞电器集团有限公司;三电极体系(玻碳电极、甘汞电极和铂柱电极) 武汉高仕瑞联科技有限公司。
1.2 实验方法
1.2.1 Nafion/L-cys/GCE的构筑 修饰之前,玻碳电极先在附有0.03 μm Al2O3抛光粉的麂皮上抛光,然后依次在无水乙醇和二次蒸馏水中超声清洗干净,取出电极,吹干。将该电极置于L-cys溶液中(0.1 mol/L pH7.0 PBS缓冲溶液配制),在-0.6~2.5 V电位窗口范围内以0.1 V/s循环伏安扫描10圈[13]。取出,超纯水清洗表面,红外灯下烤干,得L-cys/GCE。微量进样器移取8 μL 0.1% Nafion(无水乙醇)溶液滴涂在L-cys/GCE表面得Nafion/L-cys/GCE,晾干待用。
1.2.2 修饰电极制备条件优化 实验条件研究中,除特殊说明外,电位范围为0.25~0.9 V,扫速为0.1 V/s。制备的Nafion/L-cys/GCE为工作电极,铂柱电极为辅助电极,甘汞电极为参比电极,PBS缓冲溶液(pH6)作为支持电解质,搅拌富集2 min,采用循环伏安法研究不同修饰条件对2.0×10-5mol/L的色氨酸溶液峰电流的影响。
半胱氨酸溶液浓度的影响:聚合圈数为10,Nafion滴涂量8 μL,改变半胱氨酸浓度分别为1.0×10-2、1.0×10-3mol/L,利用制备的修饰电极循环伏安法测定2.0×10-5mol/L的色氨酸溶液。色氨酸氧化峰电流最大时,半胱氨酸浓度为最佳。
聚合圈数的影响:半胱氨酸浓度固定为1.0×10-2mol/L,Nafion滴涂量8 μL,改变聚合圈数分别为5、10、15、20,利用制备的修饰电极测定2.0×10-5mol/L的色氨酸溶液。色氨酸氧化峰电流最大时,聚合圈数为最佳。
1.2.3 色氨酸测定条件及电化学反应机理研究方法 支持电解质pH的影响:将Nafion/L-cys/GCE置于含有色氨酸的PBS溶液中,搅拌富集2 min,改变溶液pH(4、5、6、7、8),以0.1 V/s的扫描速度进行循环伏安扫描。色氨酸峰电流最大时介质的酸度选为测定的最佳酸度,并以氧化峰电位Epa(V)对pH作图,研究色氨酸在修饰电极上的反应机理。
扫描速度的影响:Nafion/L-cys/GCE置于含有色氨酸的PBS(pH6)溶液中,搅拌富集2 min,改变扫描速(0.06、0.08、0.10、0.12、0.16、0.20、0.25 V/s)进行循环伏安扫描。以氧化峰电流Ipa(μA)与扫描速度v(V/s)作图,研究反应机理。
1.2.4 标准曲线的建立 在优化的实验条件下,将Nafion/L-cys/GCE置于不同浓度的色氨酸的PBS溶液中(0、0.4×10-6、0.8×10-6、2.0×10-6、4.0×10-6,10.0×10-6,20.0×10-6,40.0×10-6mol/L),搅拌富集2 min,以0.1 V/s的扫描速度进行线性伏安扫描。以氧化峰电流Ipa(μA)对色氨酸浓度c作图,建立标准曲线方程。
1.2.5 样品处理及测定方法 取新鲜香蕉,去皮后研钵研成糊,用分析天平准确称取约10 g,置于锥形瓶中,加入100 mL PBS缓冲溶液(pH6),振荡6 h,转速6000 r/min离心5 min,将上清液转入250 mL容量瓶,用PBS缓冲溶液定容,冷藏备用。
Nafion/L-cys/GCE置于5 mL待测样品中,搅拌富集2 min,以0.1 V/s的扫描速度进行线性伏安扫描,记录峰电流并进行加标回收,计算回收率。
2 结果与分析
2.1 Nafion/L-cys/GCE制备过程优化
不同浓度半胱氨酸溶液对色氨酸峰电流的影响如图1所示。结果表明,半胱氨酸浓度为1.0×10-2mol/L时,色氨酸氧化峰电流响应较大,故选用1.0×10-2mol/L半胱氨酸进行电化学聚合。

图1 半胱氨酸浓度对2.0×10-5 mol/L色氨酸峰电流的影响Fig.1 The effect of L-cys concentration on the peak currents of Trp注:a为1.0×10-2,b为1.0×10-3 mol/L。
修饰膜的厚度会影响电极表面性质和功能,聚合圈数直接影响膜的厚度。实验结果表明(图2),当聚合圈数从5增加到10时,色氨酸峰电流逐渐增加;超过10圈以后,峰电流反而降低。原因可能是,开始圈数增加,电极表面反应位点增加,电子传送能力较强,峰电流逐渐增加。当聚合圈数达到某一个值时(10圈),修饰膜太厚,逐渐阻碍了电子及色氨酸与电极表面间的传输,色氨酸峰电流降低。因此,本实验选择聚合圈数为10圈。
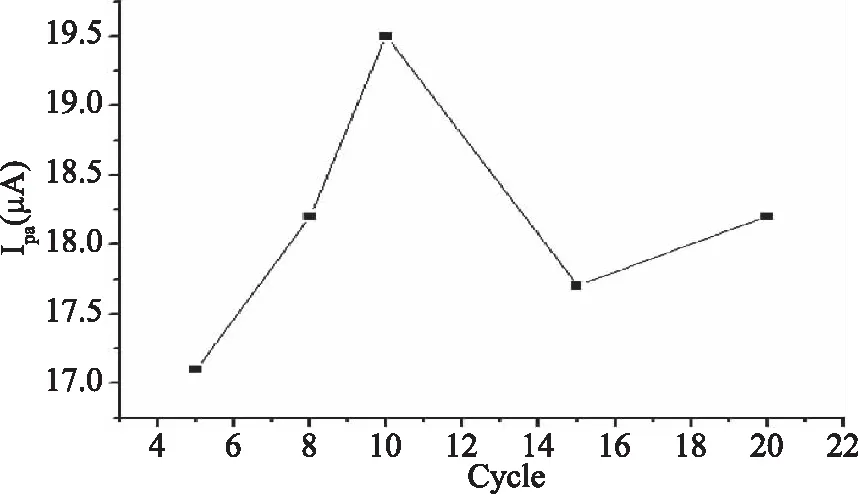
图2 聚合圈数对色氨酸峰电流的影响Fig.2 The effect of circle number on the peak currents of Trp
2.2 色氨酸在不同电极上的电化学行为
研究色氨酸在不同电极上的电化学行为如图3所示,Nafion/L-cys/GCE在空白溶液中无氧化还原峰,而在色氨酸溶液中,于0.7 V处出现一强氧化峰。同样实验条件下,GCE对色氨酸溶液几乎没有电化学响应,说明Nafion/L-cys/GCE对色氨酸具有较强电催化作用。Nafion/L-cys/GCE反向扫描时,无还原峰出现,表明色氨酸在该修饰电极上是不可逆的电化学氧化过程。

图3 不同电极循环伏安图Fig.3 Cyclic voltammograms of the different electrodes 注:a. Nafion/L-cys/GCE在色氨酸溶液中的循环伏安图;b. Nafion/L-cys/GCE在空白溶液中的循环伏安图;c. GCE(a)在色氨酸溶液中的循环伏安图。
2.3 色氨酸测定条件及电化学反应机理探索
不同pH对色氨酸电化学行为研究结果如图4。据图看出,当pH为6.0时色氨酸的峰形较好,背景电流相对较低,且接近人体酸度,因此,选用pH6.0作为测定的介质酸度。另外,色氨酸峰电位随pH增大而负移,判断质子参与了色氨酸电氧化过程[14],以氧化峰电位Epa(V)对pH作图,得Epa(V)=1.01-0.05pH(R2=0.9952),方程的斜率与理论值0.059 V/pH相近,说明参加色氨酸在Nafion/L-cys/GCE上的电极反应是一个等质子等电子的电极反应过程。

图4 色氨酸在Nafion/L-cys/GCE 上不同pH溶液中的循环伏安图Fig.4 Cyclic voltammograms of the Nafion/L-cys/GCE in Trp solution in different pH
不同扫描速度下,色氨酸的电化学响应研究如图5。由图看出,峰电流随着扫描速度增大而增大,扫描速度过大时,背景电流也较强,稳定性较差,扫速为0.1 V/s时,具有较高的氧化峰电流且稳定性较好。因此,确定0.1 V/s作为最佳扫速。另外,氧化峰电流与扫速之间成线性关系,回归方程为Ipa(μA)=11.3 v(V/s)+0.61(R2=0.9683)。电流与扫描速率呈线性关系,说明色氨酸在Nafion/L-cys/GCE上电极反应是一个受吸附控制的电化学氧化过程[15]。
2.4 标准曲线
在最优实验条件下,利用线性扫描伏安法对不同浓度的色氨酸进行定量分析,线性扫描伏安图如图6。随着色氨酸浓度增大,峰电流逐渐增大,在0.4×10-6~40.0×10-6mol/L的浓度范围内,峰电流与浓度有良好的线性关系。以峰电流对色氨酸浓度作图(图7),回归方程为Ipa(μA)=0.6997c(10-6mol/L)+5.3(R2=0.9844),检测限为1.0×10-8mol/L(S/N=3)。将Nafion/L-cys/GCE与其他测定色氨酸的电化学传感性能进行对比,结果如表1。对比发现,本研究中构筑的Nafion/L-cys/GCE,不仅方法简单,且具有更低的检测限,检测灵敏度高。

表1 不同修饰电极性能比较Table 1 Comparison of the analytical performances of different modified electrode
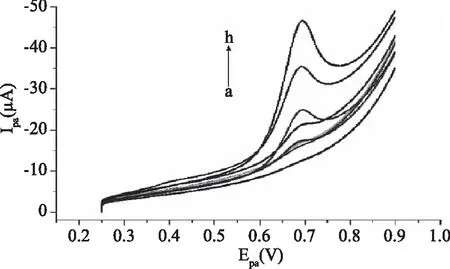
图6 不同浓度的色氨酸线性扫描伏安图Fig.6 Linear sweep voltammograms of different concentration of Trp注:a~h浓度分别为 0、0.4×10-6、0.8×10-6、2.0×10-6、 4.0×10-6、10.0×10-6、20.0×10-6、40.0×10-6 mol/L。

图7 峰电流与色氨酸浓度校准曲线图Fig.7 The calibration curve was the peak current vs the concentration of Trp
2.5 选择性及重现性考察
为了考察Nafion/L-cys/GCE的重现性,制备4支Nafion/L-cys/GCE,置于2.0×10-5mol/L色氨酸溶液,测定峰电流,相对标准偏差为3.6%,表明Nafion/L-cys/GCE修饰电极具有较好的重现性。
在最优实验条件下,考察了常见氨基酸及化合物对测定的干扰。色氨酸浓度为定为2.0×10-5mol/L,允许测定的相对误差为<±5%。实验结果表明,100倍的赖氨酸、精氨酸、谷氨酸、L-半胱氨酸对色氨酸测定无干扰。500倍的NaNO3、MgSO4、ZnSO4、CuSO4、葡萄糖、200倍的柠檬酸、抗坏血酸对色氨酸的氧化峰电流无明显干扰。因此,该修饰电极对色氨酸有良好的选择性,可以应用到实际样品测定。
2.6 实际样品测定
为了验证本工作中构筑的修饰电极的可行性,利用线性扫描伏安法对香蕉中的色氨酸含量进行了测定。被测样品中没有检测出色氨酸,采用标准加入法进行回收测定实验。由表2结果可以看出,回收率在95%~98%之间,相对标准偏差≤5.0%,因此本研究所建立的方法可以用于香蕉中色氨酸含量的测定。

表2 香蕉中色氨酸含量测定(n=5)Table 2 The determination for Trp in banana
3 结论
本研究构筑了聚半胱氨酸和Nafion修饰的玻碳电极;该修饰电极对色氨酸电化学氧化具有强的电催化作用,基于此建立了灵敏检测色氨酸含量的电化学方法。在优化实验条件下,色氨酸浓度在0.4×10-6~40.0×10-6mol/L范围内与氧化峰电流有良好线性关系,最低检出限为1.0×10-7mol/L。该方法为食品中色氨酸含量的测定提供了方法参考。
