蛋白质氧化 对核桃蛋白质结构的影响研究
2018-07-11王丹丹毛晓英孙领鸽田洪磊
王丹丹,毛晓英,孙领鸽,田洪磊,詹 萍
(石河子大学食品学院,新疆石河子 832000)
蛋白质氧化的概念最初起源于医学领域,是指在自由基及相关氧化产物的作用下,血浆或组织细胞的蛋白质中某些特定的氨基酸残基被氧化,导致蛋白质结构发生变化,使蛋白质与氧化物之间的亲和力增强,蛋白质易发生聚合、水解和交联,最终导致细胞功能损害直至细胞死亡的现象[1]。后来,蛋白质氧化这一概念被引入食品领域,目前已逐渐成为食品研究领域的热点。在食品领域中,蛋白质氧化是指活性氧(ROS)在直接作用或间接作用下氧化蛋白质分子,而导致蛋白质共价结构修饰,从而导致蛋白质功能特性下降、风味恶化以及营养损失的现象[2]。因此,食品中蛋白质氧化的研究,对提高产品质量、保护人体健康方面具有重要的现实意义[3]。
在正常的食品加工过程中,导致蛋白质氧化主要因素是ROS诱导脂质过氧化和加速非酶糖基化,再利用其活性中间产物间接介导蛋白质氧化,其过程中LOX(脂肪氧合酶)是氧化的关键因素。此外,蛋白质在自由基的作用下,可发生包括脂质过氧化化合物的生成、二硫键的连接、酪氨酸侧链的硝基化和氨基酸的羰基化等一系列共价修饰作用[4]。与动物性原料相比,植物性食品原料,如大豆、核桃中的脂肪氧合酶(LOX)活性较高。无论是在榨油的过程中,还是在大豆蛋白、核桃蛋白的制备过程中,始终存在LOX诱导多不饱和脂肪酸脂质过氧化的应激环境。在此环境中产生的脂质自由基、脂质氢过氧化物及活性次生氧化产物均能诱导蛋白质氧化。前期研究人员对大豆蛋白、花生蛋白的脂质自由基氧化进行了探索[4-7]。核桃蛋白质是一种优良的植物蛋白质资源,且氨基酸比例较合理,是一种营养平衡的植物蛋白,具有很好的开发价值[8]。由于核桃及核桃蛋白产品始终存在LOX诱导多不饱和脂肪酸脂质过氧化的应激环境,从而导致核桃蛋白的结构及功能性发生改变,从而影响了核桃及蛋白产品的品质。
目前,关于核桃蛋白质氧化的研究尚未见报道。因此,为了深入明晰氧化促使核桃蛋白发生结构性修饰的机理,本文以核桃分离蛋白为研究对象,采用2,2′-盐酸脒基丙烷(AAPH)热降解形成的过氧自由基代表脂质自由基,建立过氧自由基-核桃分离蛋白氧化体系,以期在分子水平上对核桃蛋白质发生结构性氧化修饰的机理进行探索和研究,为核桃蛋白产品在加工及储藏过程中品质控制提供理论依据。
1 材料与方法
1.1 材料与仪器
薄皮核桃 新疆石河子农贸市场(和田产);5,5-二硫代二硝基苯甲酸、1-苯氨基萘-8-磺酸 上海源叶生物科技有限公司;三氯乙酸(TCA) 天津永晟精细化工有限公司;乙二胺四乙酸(EDTA) 上海金锦乐实业有限公司;十二烷基硫酸钠(SDS) 天津市凯通化学试剂有限公司;牛血清蛋白(67000 Da) 上海金穗生物科技有限公司;甲状腺球蛋白(669000 Da)、醛缩酶(158000 Da)、过氧化物酶(40200 Da)、腺苷酸激酶(32000 Da)、肌红蛋白(17000 Da)、核糖核酸酶(13700 Da)、抑肽酶(6500 Da)、维生素B12(1350 Da) 上海一基实业有限公司;卵清蛋白(43000 Da) 北京索莱宝科技有限公司;其它试剂均为分析纯。
LGJ-18S冷冻干燥机 北京松源华兴科技有限公司;23R台式高速冷冻离心机 力康发展有限公司;MOS450圆二色光谱仪 法国Bio-Logic;F-7000 荧光光谱仪 日本日立公司;Water 2690型液相色谱系统 美国Waters公司。
1.2 实验方法
1.2.1 核桃分离蛋白的制备 参照毛晓英的方法[9],核桃仁用2% NaOH溶液在室温下浸泡4 min,后手动去皮、用中草药粉碎机粉碎,采用正己烷以 1∶5 (w/v)的料液比脱脂1 h,抽滤,收集残渣再进行提取,以滤液为无色透明时,收集残渣,置于通风橱挥干正己烷溶剂。将残渣用粉碎机粉碎后过80目筛,即得到核桃脱脂粉。将核桃脱脂粉用95%乙醇醇洗(1∶10,w/v)一次,以除去剩余的油脂,挥干乙醇溶剂。按照1∶26 (w/v)料液比加入去离子水溶解,用0.2 mmol/L的NaOH调节蛋白溶液pH11,室温下搅拌1.5 h,然后在室温下离心(4000×g,15 min),取上清液,用0.2 mmol/L的HCl调节上清液pH4.5,磁力搅拌1 h,室温下离心(8000×g,15 min),取沉淀,用去离子水调节至中性,最后冷冻干燥,得到核桃分离蛋白,至于4 ℃贮藏备用。
1.2.2 核桃氧化蛋白的制备 参照Huang[6]的方法,将制备的核桃分离蛋白(10 mg/mL)溶解于0.01 mol/L pH8.0的磷酸盐缓冲溶液中(含NaN3浓度为0.5 mg/mL)。将一定量的AAPH与核桃蛋白溶液混合,使AAPH的最终浓度分别为0、0.04、0.2、1、5和25 mmol/L,25 ℃密封避光条件下振荡反应 24 h。随后将反应液温度降至4 ℃以下,并在4 ℃条件下10000 r/min离心15 min,移除少量冷却过程中出现的不溶性物质。在4 ℃去离子水中,每隔6 h更换一次去离子水,透析72 h去除多余的AAPH,最后冷冻干燥得到核桃氧化蛋白,并置于4 ℃条件下贮存备用。
1.2.3 核桃氧化蛋白羰基含量的测定 参照Huang等[10]的方法略改。将核桃氧化蛋白用去离子水配制为5 mg/mL的蛋白溶液,以双缩脲指示剂法测定蛋白质溶液的浓度(y=0.2412x+0.0135,R2=0.997)。在367 nm处用2,4-二硝基苯肼比色法进行比色,每毫克蛋白质羰基衍生物的摩尔数通过以22000 M-1cm-1消光系数进行计算,公式如下:
蛋白羰基含量(nmol/mg)=45.45A367n/c
其中,n为稀释因子;c为蛋白质溶液的浓度,mg/mL。
1.2.4 核桃氧化蛋白游离巯基和总巯基含量的测定 根据Wu等[4]的方法略改,采用DNTB比色法。核桃蛋白样品溶于0.1 mol/L含有1 mmol/L EDTA和1%十二烷基硫酸钠(SDS)pH8.0的磷酸盐缓冲液中,双缩脲指示剂法测定上清液中蛋白浓度。取上清液在412 nm波长下测定吸光度,以14150 M-1cm-1消光系数计算巯基和总巯基含量。公式如下:
SH含量(umol/g)=70.67A412n/c
其中,n为稀释因子(SH为2.03,总SH为10.08);c为蛋白质溶液的浓度,mg/mL。
1.2.5 核桃氧化蛋白表面疏水性的测定 采用ANS荧光探针法[10]。核桃蛋白样品溶解于0.01 mol/L pH8.0 磷酸盐缓冲液中,双缩脲指示剂法测定上清液中蛋白质浓度,将蛋白浓度控制在 0.005~0.5 mg/mL之间,加入0.008 mol/L 1-苯氨基萘-8-磺酸,在395 nm激发波长和473 nm发射波长下测定荧光强度(灵敏度设定为6)。以荧光强度对蛋白质浓度作图,外推至蛋白质浓度为0,曲线初始阶段的斜率即为蛋白质表面疏水性指数。
1.2.6 核桃氧化蛋白二级结构的测定 参照Wu等[4]的方法,核桃蛋白分散于去离子水中,稀释上清液蛋白浓度至50 μg/mL。在25 ℃条件下,采用MOS-450 圆二色光谱仪测定样品的远紫外CD光谱(190~250 nm)。三次扫描取平均值,CD谱图用摩尔椭圆率[θ]((°)cm2dmol-1)表示。
1.2.7 核桃氧化蛋白内源荧光的测定 核桃蛋白样品溶解于0.01 mol/L pH7.0的磷酸盐缓冲液,使溶液中蛋白质的浓度为0.1 mg/mL。用荧光分光光度计测定氧化修饰核桃蛋白的光谱,以溶解样品的磷酸盐缓冲液为空白。激发波长为295 nm,扫描波段为300~400 nm,灵敏度为2。
1.2.8 核桃氧化蛋白粒径分布的测定 根据Huang等[10]的方法略改。将核桃蛋白样品溶解于0.01 mol/L pH7.0 磷酸盐缓冲液中,使蛋白浓度最终为1 mg/mL,采用纳米粒度分析仪测定核桃蛋白粒径分布。
1.2.9 核桃氧化蛋白相对分子量的测定 根据Huang等[10]的方法略改。将核桃蛋白样品分散于去离子水中。使上清液蛋白浓度为1 mg/mL,上清液过孔径0.45 μm的醋酸纤维素膜,收集滤液采用Water 2690型液相色谱系统检测,紫外检测波长:280 nm,流速:1 mL/min,柱温:25 ℃。用10种化学物质对进行曲线校正(甲状腺球蛋白、醛缩酶、牛血清蛋白、卵清蛋白、过氧化物酶、腺苷酸激酶、肌红蛋白、核糖核酸酶、抑肽酶、维生素B12)。
1.3 数据处理
2 结果与分析
2.1 核桃氧化蛋白羰基含量分析
蛋白质暴露在氧化环境下,羰基形成是主要的化学特性之一。羰基化是蛋白质不可逆转的非酶促修饰的过程,它涉及到氧化应激下羰基的形成[11]。蛋白质氧化程度通常以羰基含量变化多少为指标。氧化后核桃蛋白羰基含量变化如图1所示,随着氧化浓度的增加,羰基含量均明显增加。未氧化的WPI其羰基含量最低为2.44 nmol/mg,随着AAPH浓度增加,羰基含量显著增加至5.35 nmol/mg,表明过氧自由基诱使核桃蛋白发生了氧化。推测是具有NH-或NH2结构的蛋白质侧链极易受到氧化,导致羰基含量增加[12],也可能是由于氨基酸残基受到AAPH热降解形成的过氧自由基的攻击[13]或氧化导致蛋白质骨架的解体[14],致使羰基含量增加。Ye等[15]的研究结果表明,AAPH可诱使花生蛋白质羰基显著增加。Wu等[16]发现经丙二醛氧化的大豆蛋白,其羰基含量会显著增加。
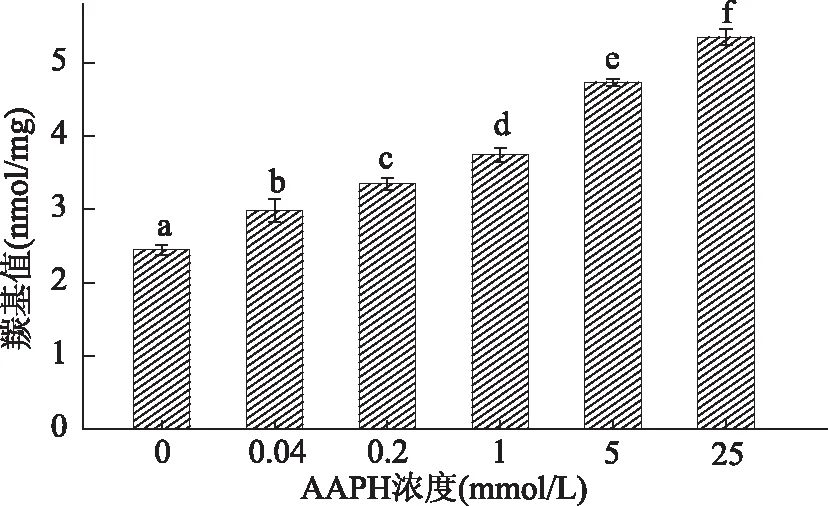
图1 AAPH浓度对核桃氧化蛋白羰基含量的影响Fig.1 Effect of AAPH concentration on the carbonyl contents of walnut oxidized protein注:字母不同表示不同氧化程度的 核桃蛋白样品之间差异显著(p<0.05)。
2.2 核桃氧化蛋白巯基和总巯基含量分析
半胱氨酸残基和含硫化合物对蛋白质结构影响起着重要的作用,通常用巯基和总巯基含量变化反映其二者的氧化状态[17]。蛋白质氧化通常伴随着自由硫醇基的减少,其在不同的氧化环境下,可以被氧化成可逆(蛋白二硫化物或次磺酸)或不可逆(亚磺酸或磺酸)形式[18]。AAPH浓度对核桃氧化蛋白游离巯基和总巯基含量的影响如表1所示,AAPH浓度增加,导致核桃氧化蛋白游离巯基和总巯基含量下降,产生这样的结果可能是蛋白质氧化改变了半胱氨酸的氧化还原状态,巯基和二硫键交互反应的平衡常数,而使蛋白质中巯基和二硫键的数量和分布被改变[19]。ROO·能够迅速与蛋白质游离巯基反应形成亚磺酰自由基,随后与分子氧接合形成硫醇自由基,硫醇自由基可进一步诱导蛋白质氧化,致使巯基含量下降。Wu等[20]在研究AAPH氧化大豆蛋白时发现巯基和总巯基的变化在也存在类似的变化规律。由于半胱氨酸和二硫键对蛋白质的结构有重要影响[21],氧化可以诱发WPI自由的硫酰基团的减少,从而引起蛋白结构变化。
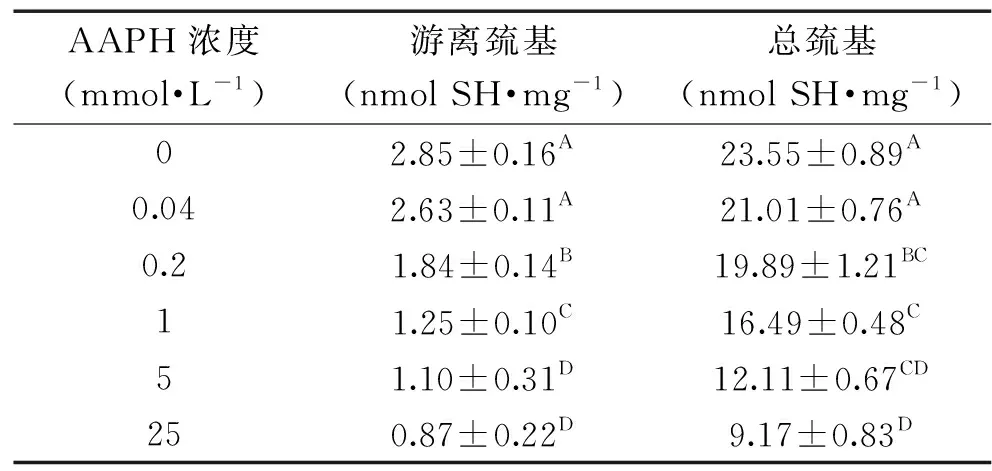
表1 AAPH浓度对核桃氧化蛋白 游离巯基和总巯基含量的影响Table 1 Effect of AAPH concentration on free sulfhydryl/total sulfhydryl groups contents of walnut oxidized protein
2.3 核桃氧化蛋白表面疏水性分析
蛋白质的表面疏水性在评价蛋白质物理化学性质和构象变化的过程中起着至关重要的作用,可以表达蛋白质分子间相互作用的能力[22],是反映蛋白质表面疏水氨基酸的一个重要指标,它与蛋白质的功能性质密切相关[23]。氨基酸的相对含量可以用表面疏水性来反映,进而可用来衡量蛋白质变性程度。核桃氧化蛋白后表面疏水性的变化如图2所示,随着AAPH浓度的增加,其表面疏水性逐渐下降(p<0.05)。这可能是由氧化改变蛋白质的构象,内部的脂肪族与芳香族氨基酸侧链氧化,蛋白质结构展开,内部的疏水基团暴露,暴露的疏水基团相互作用,使核桃蛋白形成聚集体而造成的[24]或者是由于氧化使蛋白结构打开又重新组合,使疏水基团嵌入,新的亲水基团形成(如羰基),导致疏水基团下降[25]。黄友如[26]在研究亚油酸对大豆蛋白氧化时结果显示,随反应时间增加,大豆蛋白氧化程度增加,表面疏水性逐渐下降。实际的表面疏水性主要是由蛋白质中分散的或聚集的颗粒决定的[27],蛋白质共价聚集,促进疏水基团掩埋而减少,由此说明其结构得到改变。

图2 AAPH浓度对核桃氧化蛋白表面疏水性的影响Fig.2 Effect of AAPH concentration on surface hydrophobicity of walnut oxidized protein注:字母不同表示不同氧化程度的 核桃蛋白样品之间差异显著(p<0.05)。
2.4 核桃氧化蛋白二级结构分析
远紫外CD的变化,可以反映具有光学活性基团的肽链骨架中的肽键的变化,进而可用来表征过氧自由基氧化对核桃蛋白质二级结构的影响[28]。核桃蛋白样品的远紫外CD图谱见图3所示,天然核桃蛋白在208 nm和222 nm,具有两个明显的负峰,说明在核桃蛋白质中,α-螺旋是最主要的结构。194 nm处正峰和218 nm处负峰,表示核桃氧化蛋白中存在β-折叠。随着AAPH含量的增加,194 nm处正峰强度以及218 nm处负肩峰强度都呈现下降趋势,这说明过氧自由基氧化使得核桃蛋白α-螺旋结构和β-折叠结构的含量下降。而在天然核桃蛋白中,在200 nm处为正峰。当AAPH含量增加后,200 nm处显示为负峰,说明无规卷曲结构有所增加。与未氧化的WPI相比,样品显示在氧化处理后α-螺旋结构和β-折叠结构减少,无规卷曲结构增加。由于蛋白质的二级结构依赖于氨基酸的局部序列和分子不同部位之间的相互作用[29],上述结果表明氧化会破坏这些相互作用,从而导致二级结构的变化。

图3 AAPH浓度对核桃氧化蛋白二级结构的影响 Fig.3 Effect of AAPH concentration on Ultraviolet CD spectrum of walnut oxidized protein
2.5 核桃氧化蛋白内源荧光分析
色氨酸最大内源荧光发射波谱可以指示色氨酸残基在蛋白质内的相对位置,因此被用来作为蛋白质三级结构改变的指示器[30]。同时可以指示蛋白质色氨酸残基的氧化程度及其微环境的变化,进而能够表征蛋白质氧化对其三级结构的影响。核桃蛋白氧化后内源荧光的变化如图4所示。从谱图可以看出,天然核桃蛋白最大荧光峰位在335 nm处。当AAPH为25 mmol/L时,核桃蛋白λmax强度降低到天然蛋白的55.7%,最大荧光峰位发生蓝移。其荧光蓝移,说明随着氧化程度的增加,色氨酸被转移到更加疏水的非极性环境中[31]。Wu研究氧化大豆蛋白时,结果显示最大内源荧光蓝移,表明先前暴露的色氨酸残基经氧化修饰后被隐藏,导致蛋白质聚集[16]。Chen等[32]研究氧化大豆蛋白时,结果显示随着氧化浓度的增加,疏水基团暴露,也导致蛋白聚集形成。内源荧光强度下降,可能是由于烷过氧自由基氧化导致分子聚集,使得色氨酸残基包埋,也可能是由于烷过氧自由基氧化修饰对295 nm激发下的蛋白色氨酸残基有荧光猝灭作用[33]。邱天福[34]在氧化大豆蛋白研究产生了与本研究结果相一致的结论。

图4 AAPH浓度对核桃氧化蛋白内源荧光的影响Fig.4 Effect of AAPH concentration on intrinsic fluorescence of walnut oxidized protein
2.6 核桃氧化蛋白粒径分布分析
动态光散射(DLS)用于监测聚集物的形成,作为一种定量的灵敏而有效的方法已被得到认可[32]。天然WPI和烷过氧自由基修饰WPI的体积-粒径分布如5所示。如图得出,其粒径分布大多集中在0~1000 nm之间,峰值出现在300 nm左右。当核桃蛋白浓度提高到0.2 mmol/L时,其峰值范围变宽,粒径颗粒较为分散。随着浓度升高至25 mmol/L时,于500~1000 nm之间出现一个小峰,此时AAPH高浓度氧化,导致蛋白粒径逐渐增大,表明过氧自由基氧化诱使核桃蛋白形成了氧化聚集体。图中当AAPH浓度从0.2~1 mmol/L时,粒径颗粒变小,这可能是由于小的可溶性聚集体断裂成更小的小分子多肽,而氧化浓度进一步增加,粒径颗粒变大,可溶性部分通过共价交联和非共价聚集转变成不可溶性部分。这与表1得到结果相一致,AAPH浓度增加,游离巯基减少,说明S-S形成,形成的S-S有助于蛋白聚集,由此可以增加蛋白粒径。由此表明,较高的AAPH浓度,可以促进不可溶性组分形成,导致蛋白分子聚集[35]。

图5 AAPH浓度对核桃氧化蛋白粒径分布的影响Fig.5 Effect of AAPH concentration on particle size distribution of walnut oxidized protein
2.7 核桃氧化蛋白相对分子量分布分析
通过分子排阻色谱可以得到WPI的分子量分布,分析AAPH氧化WPI聚集后分子的大小,反映蛋白质氧化对WPI聚集形态的影响。体积排阻分析结果如图6和表2所示。在相同测定条件下,测定的10种标准蛋白校正曲线如图6A所示。未氧化的WPI呈现一个主峰,其相对分子量为0.18 kDa,峰面积为90.27%(图6B)。此结果表明WPI相对分子量分布较为均匀,这一较低分子量的峰(0.18 kDa)可能为低分子多肽。随着AAPH浓度增加到0.04 mmol/L,出现分子量为6.87 kDa(峰面积71.83%)和分子量为4.45 kDa(21.23)两个新峰(图6C),表明大分子量形成,蛋白质发生聚集。随着AAPH浓度的增加,6.87 kDa的大分子量所占比例,先增加后减小。由高效液相凝胶色谱谱图可以看出,AAPH在低浓度时,诱导WPI形成小的聚集体,这一聚集体进一步聚集,形成较大的颗粒聚集体。此结果与粒径分布结果相一致,说明高浓度氧化引起WPI可溶性聚集体含量下降,较大不可溶性聚集体形成。
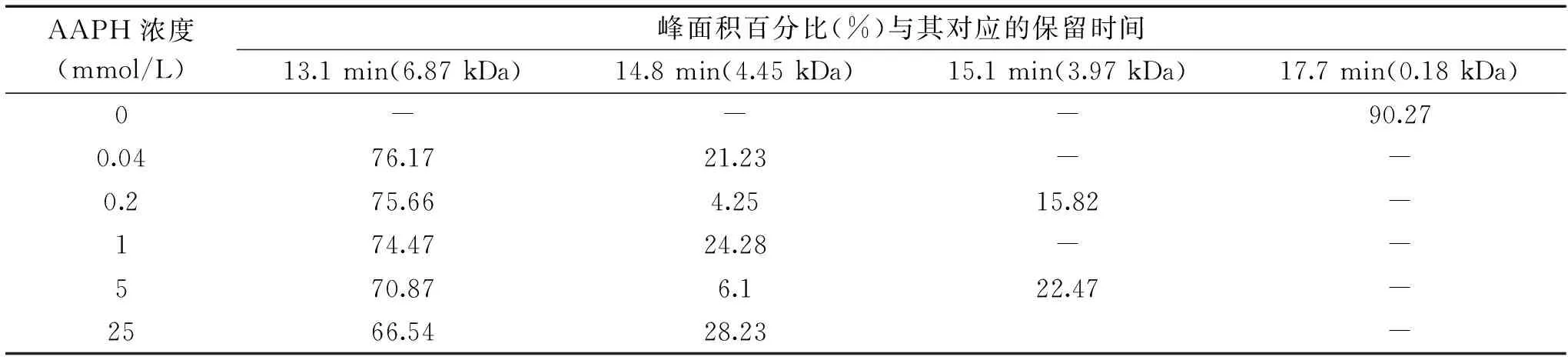
表2 AAPH浓度对核桃氧化蛋白分子量分布的影响(%)Table 2 Effect of AAPH concentration on molecular weight distribution of walnut oxidized protein(%)

图6 AAPH浓度对核桃氧化蛋白分子量分布的影响Fig.6 Effect of AAPH concentration on molecular weight distribution of walnut oxidized protein注:A. Shodex KW-804蛋白柱的标准曲线;B~G. AAPH浓度分别为0、0.04、0.2、1、5、25 mmol/L。
3 结论
蛋白自由基可以和过氧自由基反应,引起核桃蛋白结构和构象发生改变。具体表现在,AAPH氧化浓度的增加导致羰基含量累积,巯基和总巯基含量逐渐减少,非共价二硫键形成。伴随着其α-螺旋和β-折叠有序结构减少,无规卷曲结构增加。粒径增加,高分子量聚集体含量逐渐增大,表明蛋白通过疏水作用、氢键结合或离子键相互作用,致使蛋白形成更大的聚集体。蛋白质氧化对核桃蛋白的理化特性及结构均产生一定的影响。过氧自由基氧化修饰对核桃分离蛋白结构产生了显著的影响。
