泰克地那林对四氯化碳诱导小鼠急性肾损伤的治疗作用*
2018-07-11程树林胡春燕朱平宇周文浩龚志勇
程树林,胡春燕,朱平宇,周文浩,龚志勇
(川北医学院附属医院 泌尿外科,四川 南充 637000)
急性肾损伤(acute kidney injury, AKI)是临床常见的危急重症[1-2],其发病率逐年上升,是导致患者死亡的重要原因。组蛋白去乙酰化酶(Histone deacetylases, HDACs)是一类调控染色质结构的蛋白酶,既往研究主要集中在神经退行性疾病、衰老相关疾病、糖尿病、心血管疾病以及肿瘤,证实HDACs抑制剂具有抗炎、抗纤维化和抗肿瘤作用[3]。而最近研究表明,HDACs调控在肾损伤应答过程中起重要作用[4-5]。广谱性HDAC抑制剂辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid, SAHA)、丙戊酸(valproic acid, VPA)已被证实具有一定的急性肾损伤修复作用,但也存在药效不稳定、副作用较强等局限性[6-7]。泰克地那林(Tacedinaline, CI994)是一种I类HDAC特异性抑制剂,主要作用于HDAC1、2、3[8],其对急性肾损伤是否具有治疗作用目前尚未可知。本研究采用特异性HDAC抑制剂CI994代替广谱性抑制剂,通过构建四氯化碳(carbon tetrachloride, CCl4)诱导小鼠急性肾损伤模型,观察CI994对小鼠肾损伤的影响,探究其潜在的治疗性价值。
1 材料与方法
1.1 主要试剂材料
无特定病原体(SPF)级雄性小鼠40只,体重25~30 g,购自川北医学院实验动物中心(本研究符合川北医学院实验动物伦理委员会所制定的伦理学标准);CCl4(川东化工),食用橄榄油(RONGS,西班牙),CI994(Selleck),尿素氮(blood urea nitrogen, BUN)、肌酐(serum creatinine, Scr)、丙二醛(malondialdehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(南京建成),胱抑素C(cystatin C,Cys C)ELISA试剂盒(美国),小鼠肾损伤分子1(kidney injury molecular 1, KIM-1)ELISA试剂盒(上海瓦兰)。CCl4与橄榄油按照1∶9的体积比例配置成10% CCl4溶液。CI994溶于DMSO,配置成200 mmol/L浓度,并用生理盐水配制成最终浓度4 mmol/L(约1.08 mg/ml)。
1.2 CCl4诱导小鼠急性肾损伤模型的复制
参照KOICHIRO SUZUKI等的实验方法建立CCl4诱导小鼠急性肾损伤模型[9]。将小鼠随机分为4组,对照组:一次性腹腔注射300 μl生理盐水;药物对照组:在腹腔注射等体积生理盐水6 h后腹腔注射CI994,注射剂量为10 mg/kg,24 h后再次注射等剂量CI994;CCl4造模组:按20 ml/kg体重的剂量一次性腹腔注射10% CCl4溶液;CI994治疗组:在CCl4给药后6和24 h分别腹腔注射CI994,注射剂量为10 mg/kg[10]。于给药CCl4后48 h通过提尾法收集尿液,然后腹腔注射麻醉后处死小鼠,心脏采集全血,不加抗凝剂静置2 h,离心并收集血清。开腹收集肾组织标本进行包埋固定或者液氮冷冻保存。
1.3 肾功能指标检测
用7600全自动生化分析仪测定血清BUN、Scr,采用ELISA法测血清Cys C、尿液KIM-1水平。具体方法参照试剂盒说明书。
1.4 组织匀浆及MDA、SOD含量检测
取肾组织0.75 g,用剪刀剪碎后加20倍干重体积的0.05 mol/L预冷PBS缓冲液在匀浆机内匀浆,制成5%肾匀浆。参照试剂盒说明书,采用7600全自动生化分析仪测定MDA水平和SOD活性。
1.5 肾脏组织HE染色
取小鼠完整左肾组织固定于10%中性甲醛溶液48 h,经脱水、透明和包埋,制成肾组织石蜡块。石蜡包埋切片,行HE染色镜下观察肾组织病理改变。
1.6 组织mRNA提取以及细胞色素2E1(CYP2E1)表达水平检测
取适量-80℃保存的肾脏组织,采用Trizol法提取总RNA,经逆转录后合成cDNA,采用SYBR法行实时荧光定量PCR(qRT-PCR)检测细胞色素2E1(cytochrome P450 2E1, CYP2E1)mRNA水平。检测所用的小鼠CYP2E1引物序列:正向AGAGACCACCA GCACAACTC,反向TTCATCCTGTCTCGGACTGC。
1.7 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,进一步两两比较采用SNK检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠血清的BUN、Scr和Cys C水平比较
各组小鼠血清的BUN、Scr和Cys C水平比较,经单因素方差分析,差异有统计学意义(BUN:F=66.594,P=0.000;Scr:F=181.818,P=0.000;Cys C:F=82.059,P=0.000)。药物对照组与对照组BUN、Cys C等指标比较,差异无统计学意义(P>0.05)。与对照组比较,CCl4造模组小鼠注射CCl448h后BUN、Scr和Cys C均升高(P<0.05)。通过CI994治疗各组指标均有一定程度回落,与CCl4造模组和对照组比较,差异有统计学意义(P<0.05),见表1。
表1 各组小鼠肾功能指标的比较(n=10,±s)
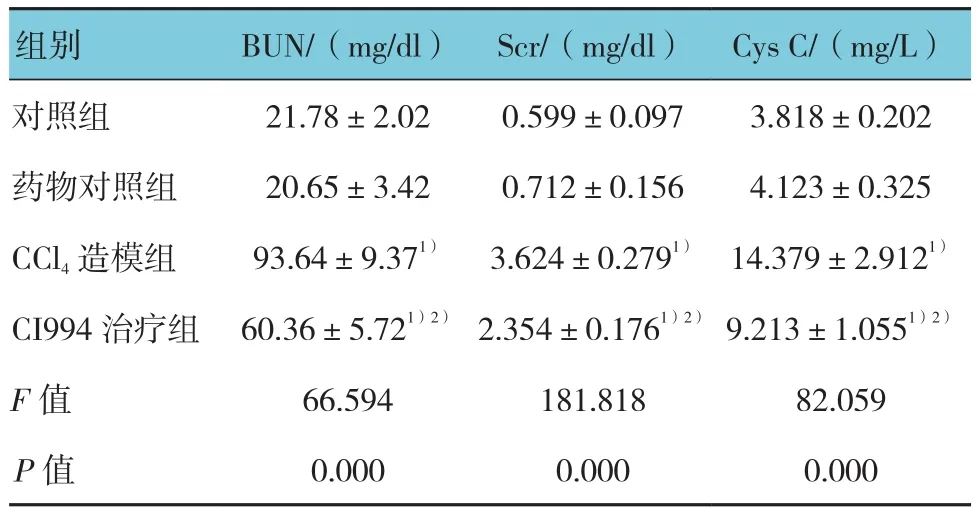
表1 各组小鼠肾功能指标的比较(n=10,±s)
注:1)与对照组比较,P<0.05;2)与CCl4造模组比较,P<0.05
组别 BUN/(mg/dl) Scr/(mg/dl) Cys C/(mg/L)对照组 21.78±2.02 0.599±0.097 3.818±0.202药物对照组 20.65±3.42 0.712±0.156 4.123±0.325 CCl4造模组 93.64±9.371)3.624±0.2791)14.379±2.9121)CI994 治疗组 60.36±5.721)2)2.354±0.1761)2)9.213±1.0551)2)F值 66.594 181.818 82.059P值 0.000 0.000 0.000
2.2 各组小鼠尿液KIM-1含量比较
各组小鼠尿液KIM-1含量比较,经单因素方差分析,差异有统计学意义(F=152.279,P=0.000)。与对照组比较,药物对照组尿液KIM-1含量差异无统计学意义(P>0.05),CCl4造模组小鼠注射CCl448 h后KIM-1升高(P<0.05),经CI994治疗小鼠KIM-1有一定程度降低,但仍然高于对照组(P<0.05)。见图1。
2.3 肾组织形态学变化
对照组和药物对照组肾小球、肾小管结构正常。CCl4造模组可见肾小管上皮细胞变性,肾小管囊腔紧缩,空泡样变化明显,细胞肿胀、坏死和脱落;肾小球和微血管中大量淤血,甚至肾小管中亦有渗血情况;肾小球萎缩退化,肾间质炎症细胞浸润;CI994治疗组肾脏仍然存在空泡样变、肾小球和微血管中淤血、肾小管细胞肿胀等情况,但损伤程度均较造模组轻,见图2。
2.4 肾组织MDA含量和SOD活性比较
4组MDA和SOD变化差异有统计学意义(MDA:F=65.735,P=0.000;SOD :F=13.272,P=0.000)。药物对照组相与对照组MDA和SOD比较,差异无统计学意义(P>0.05)。CCl4造模组MDA和SOD与对照组比较升高(P<0.05),经过CI994治疗后,MDA和SOD降低(与CCl4造模组和对照组比较,P<0.05),见表2。
2.5 各组小鼠CYP2E1 mRNA表达水平比较
各组小鼠肾组织CYP2E1的mRNA表达水平比较,经单因素方差分析,差异有统计学意义(F=45.642,P=0.000)。CCl4造模组CYP2E1 mRNA表达水平在肾脏中相对于对照组升高(P<0.05),而CI994治疗组CYP2E1 mRNA表达水平降低(与对照组和CCl4造模组比较,P<0.05)。见图3。

图1 4组小鼠尿液Kim-1含量的变化

图2 4组小鼠肾组织病理改变 (×200)

表2 CI994对各组小鼠肾组织MDA含量和SOD活性的影响

图3 4组小鼠肾组织CYP2E1 mRNA表达水平的变化
3 讨论
肾脏作为机体主要的排泄器官,是多种药物的代谢场所,亦是最容易受到毒性损伤的器官。其功能受损会导致体内代谢终产物堆积,典型标志为尿素氮和肌酐水平上升50%以上[11]。本研究分析CI994对于CCl4介导的小鼠急性肾损伤的治疗作用,结果显示CCl4诱导的小鼠肾损伤进程受到CI994的阻断,提示CI994是一种理想的急性肾损伤治疗药物。
四氯化碳作为一种典型的亲肝毒物,对肾脏亦具有强烈的毒性损伤效应[12]。CCl4作用于肝脏中产生的自由基(如CCl3-和CCl3O2-),通过血液进入肾脏,并攻击肾小管、肾小球细胞膜上的磷脂分子,引起脂质过氧化反应,进而发生急性肾损伤[13]。因此,CCl4模型常用于探索药物性肾损伤发病机制和评估抗肾损伤药物的药效等实验研究。大鼠实验中证实CCl4诱导急性肾损伤后导致肾脏活性氧反应出现紊乱,磷脂氢过氧化物、血清和肾组织MDA均升高[14]。本研究中,造模小鼠经腹腔注射CCl4后出现精神萎靡、动作迟缓等症状;同时血清中尿素氮和肌酐增高,CYP2E1在肾组织中出现表达上调;光学显微镜下肾小球萎缩退化,近端小管上皮细胞变性坏死;尿液中KIM-1含量升高,提示CCl4对小鼠同样造成严重的肾损伤,表明造模组小鼠表出现典型的急性肾功能衰竭症状。
组蛋白去乙酰化酶抑制剂具有抗纤维化、抗炎、抗氧化的作用并参与调控多种疾病的发生、发展。ADVANI等研究小鼠糖尿病模型时发现SAHA可通过减少体内活性氧产物的方式改善肾脏的损伤[6]。李瑞芳和Katrienvan Beneden分别通过复制肾性高血压大鼠肾脏纤维化模型和小鼠阿霉素肾病模型并使用组蛋白去乙酰化酶抑制剂处理时发现丙戊酸钠(VPA)可有效降低大鼠和小鼠的肾损伤程度[7,15]。汪丽等证实SAHA可通过下调OPN、CD44表达,降低氧化应激水平等机制预防肾结石形成和减弱肾损伤程度[16]。SAHA和VPA均为广谱性HDAC抑制剂,但其也存在较大局限性,如药效不稳定、副作用较强等[17]。本研究基于国内外研究,采用CI994这种Ⅰ类HDAC特异性抑制剂对肾损伤的作用做进一步的探讨。CI994是一种组蛋白去乙酰化酶抑制剂,可同时抑制HDAC1、2和3的去乙酰化功能[6],并通过上调生长抑素受体亚型2(somatostatin receptor subtype 2, SSTR2)抑制肿瘤细胞增殖[18]。本研究中,在CCl4诱导小鼠肾损伤并给予CI994腹腔注射后,其血清BUN、Scr以及尿液KIM-1下降,说明CI994对肾损伤有着抑制作用。并且实验进一步发现肾脏中MDA含量随着CI994的使用而呈下降趋势,SOD活性成上升趋势,提示CI994可能通过调控组蛋白乙酰化水平促进细胞氧化损伤修复从而促进细胞对CCl4毒性的代谢。
细胞色素CYP2E1是肝肾等组织中特异性表达的氧化损伤应答关键因子之一,其在药物损伤过程中表达水平急剧上升,并导致细胞内氧化应激反应异常升高[19]。WANG等通过实验证实抑制CYP2E1表达可通过抑制催化铁的释放、降低活性氧簇(ROS)的生成,从而有效减轻急性肾损伤程度[20-21]。本研究中,CCl4介导小鼠急性肾损伤期间,CYP2E1 mRNA表达水平急剧上升、SOD活性下降均提示胞内活性氧成分积累过度,细胞损伤严重。通过给药CI994后,CYP2E1 mRNA表达水平下降,同时肾功能相关指标如BUN、Scr等均出现回降趋势,提示CI994对CCl4介导的小鼠急性肾损伤的治疗性作用机制可能是通过降低CYP2E1表达而实现。
综上所述,CI994对肾损伤具有治疗性作用,相关机制可能与Ⅰ相毒物代谢蛋白CYP2E1的表达下调有关。这对防治急性肾损伤或许有良好的应用前景,但关于HDAC抑制剂减轻损伤的具体机制仍有待进一步阐明。
