六价铬对大鼠学习记忆的影响
2018-07-11黄国兴高琳赵丹婷杨文强柳晓琳杨菁
黄国兴,高琳,赵丹婷,杨文强,柳晓琳,杨菁
(锦州医科大学 1.公共卫生学院,2.辽宁省心脑血管药物基础研究重点实验室,辽宁 锦州 121001)
铬是一种重金属元素,主要以三价和六价的形式存在[1],其毒性与价态有关。在所有铬化合物中,六价铬[hexavalent chromium, Cr(VI)]具有较大毒性(免疫毒性、神经毒性、生殖毒性、遗传毒性及致癌性[2])。环境铬污染和职业性接触铬化物中毒等事件使铬的危害受到人们广泛关注。流行病学和临床研究表明,长期接触铬化合物的工人会出现头晕、头痛、失眠及记忆力减退等症状[3-5]。重金属污染地区高铬暴露会对儿童的神经行为发育产生不良影响[6],铬中毒使婴儿出现惊厥、昏迷及瞳孔散大等中枢神经系统症状[7],说明铬具有神经毒性。
对Cr(VI)所诱导神经毒性研究中发现,Cr(VI)可引起活性氧(reactive oxygen species, ROS)升高和线粒体膜电位(mitochondrial membrane potential, MMP)发生改变等一系列现象,揭示Cr(VI)神经毒性可能与其氧化应激有关[8]。铬所致神经系统损伤的研究较为少见,机制尚不清楚。本研究通过灌服重铬酸钾对新生雄性大鼠进行染毒,用水迷宫观察染毒对大鼠空间学习记忆的影响。通过观察大鼠海马神经细胞、胶质细胞的形态学变化及谷胱甘肽(glutathione, GSH)含量的变化,探讨铬对大鼠学习记忆损伤机制。
1 材料与方法
1.1 仪器与试剂
AAnalyst 800原子吸收光谱仪(北京普立泰科仪器有限公司),ST-600全自动消解仪(北京普立泰科仪器有限公司),AY120电子分析天平(日本岛津公司),ZH Morris水迷宫程序自动控制仪(中国科学院药物研究所研制),LC10Atvp高效液相色谱仪(日本岛津公司),重铬酸钾(K2Cr2O7,优级纯,上海亭新化工试剂厂),硝酸(HNO3,优级纯,北京现代东方精细化学品有限公司),高氯酸(HClO4,优级纯,上海金鹿化工有限公司),GFAP(GA-5):SC-58766(美国盛克鲁斯生物技术有限公司),SP-9000检测试剂盒(北京中杉金桥生物技术有限公司),ZLI-9018二氨基联苯胺法(diaminobenzidine, DAB)显色试剂盒(×20)(北京中杉金桥生物技术有限公司)等。
1.2 动物分组与给药
实验动物选择体重、健康状况相近无特定病原体级同一批次的SD怀孕大鼠[锦州医科大学动物实验中心提供,合格证号SCXK(辽)2014-0004]12只进行实验。将12只孕鼠随机分为4组,每组3只,分别为对照组(双蒸水)、重铬酸钾低(0.8 mg/kg)、中(4.0 mg/kg)、高(20 mg/kg)剂量组。待仔鼠出生后第1天起,开始对孕鼠进行灌胃给药。灌胃剂量相同的孕鼠所生仔鼠为同一组,哺乳期:自出生第1天起通过母乳染毒;断乳(出生后21 d)后,给予其与母鼠相同剂量的重铬酸钾灌胃给药,1次/d,合计6个月。各组仔鼠中选择雄性大鼠进行实验,对照组11只,低、中、高剂量重铬酸钾组分别为10、10、9只。
1.3 实验方法
1.3.1 Morris水迷宫行为学测试 K2Cr2O7染毒结束前1周,参照文献[9]用Morris水迷宫实验来测试大鼠学习记忆能力:①定位航行实验:测试大鼠的学习能力,每天将大鼠分别从4个入水点放入水中,历时6 d,记录逃避潜伏期(s);②空间探索实验:测定大鼠对原象限平台位置的记忆能力,第7天撤去水下平台,将大鼠从4个入水点面向池壁放入水中,记录120 s内穿越原平台位置的次数以及在原平台象限停留时间和第1次穿越原平台位置的潜伏期。
1.3.2 脑组织铬含量测定 采用全自动湿法消解:用电子天平称取大鼠脑组织0.5 g置于消解管内,放置在消解架上。加入混酸12 ml(硝酸∶高氯酸为5∶1),震荡加热,待消解程序结束用超纯水定容至50 ml,同时做试剂空白。用石墨炉原子吸收光谱仪进行测定[10]。
1.3.3 尼氏染色 水迷宫实验结束后,麻醉处死动物,迅速取出大鼠海马组织放入10%中性甲醛溶液中固定,梯度乙醇脱水,二甲苯透明,浸蜡,进口石蜡包埋,切片,烤片,脱蜡至水,1%甲苯胺蓝染色56℃,30 min,分色脱水,二甲苯浸泡,中性树胶封片,置于光学显微镜下观察其形态学变化。
1.3.4 GFAP免疫组织化学染色 切片常规脱蜡至水,A液(柠檬酸)18 ml+B液(柠檬酸钠)82 ml+双蒸水900 ml于高压锅内进行抗原高压修复2 min,3%过氧化氢孵育15 min,滴加一抗,4℃过夜,生物素化二抗工作液(IgG/Bio),置于恒温水浴箱中37℃,30 min,辣根酶标记链霉卵白素工作液(S-A/HRP)37℃,30 min,DAB显色,苏木素复染,酒精脱水,二甲苯透明,封片。阳性表达为棕黄色。
1.3.5 海马组织中GSH测定 称取海马组织,加入0.3 ml衍生试剂5,5'-二硫硝基苯甲酸[5,5'-Dithiobis-(2-nitrobenzoic acid), DTNB]冰浴下超声粉碎,1 200 r/min,4℃,离心10 min,取上清液,加入2倍体积乙醇,静置过滤后上样,吸取加入DTNB衍生试剂后的标准液和样品上清液,混匀静置后进样。色谱条件:C18色谱柱(150 mm×50 mm×5 μm),流动相A:1%甲酸,流动相B:10%四氢呋喃的乙腈溶液;B相梯度洗脱条件为0 min,0%~10%,12 min,10%~14%,22 min,14%~28%,35 min,28%~80%,40 min,10%,平衡5 min,25 min,结束洗脱,流速0.8 ml/min,荧光检测波长,激发波长λex=254 nm,发射波长λem=327 nm,柱温38℃,进样量50 μl。通过峰面积,采用外标法定量[11],含量以每克海马组织中GSH的含量mg/g表示。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用完全随机设计的方差分析或重复测量设计的方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠脑铬含量比较
各组大鼠脑组织铬含量比较,差异有统计学意义(P<0.05),且随铬染毒剂量增加而升高。见表1。
2.2 大鼠学习记忆行为比较
2.2.1 定位航行实验结果 各组大鼠在第1、2、3、4、5及6天的平均逃避潜伏期比较,采用重复测量设计的方差分析,结果:①不同时间的平均逃避潜伏期有差异(F=1546.992,P=0.000);②各组间的平均逃避潜伏期有差异(F=20.834,P=0.000),且随染毒剂量的增加而延长;③各组的平均逃避潜伏期与时间的变化趋势有差异(F=6.318,P=0.000)。见表2。
表1 大鼠脑铬含量比较 (mg/g,±s)

表1 大鼠脑铬含量比较 (mg/g,±s)
注:†与前一组比较,P<0.05
组别 脑铬含量对照组(n=11) 5.5±0.6低剂量重铬酸钾组(n=10) 7.4±0.6†中剂量重铬酸钾组(n=10) 8.5±0.6†高剂量重铬酸钾组(n=9) 9.4±0.7†F值 73.387P值 0.000
2.2.2 空间搜索实验结果 各组大鼠第1次寻找原平台潜伏期、穿越原平台次数及在原平台所在象限的停留时间比较,差异有统计学意义(F=93.510、28.513和32.397,均P=0.000)。各组第1次寻找原平台潜伏期比较,差异有统计学意义(P<0.05),且随染毒剂量的增加有所延长;各组大鼠穿越原平台的次数以及在原平台所在象限的停留时间差异经两两比较有统计学意义(P<0.05),且随着给药剂量的增加而减少。见表3。
2.3 铬暴露对大鼠海马神经元的影响
对照组海马组织神经元排列有序、细胞数量丰富、细胞周围间隙不明显及神经细胞形态规则(大多数呈锥形和球形,结构清楚、胞浆透明、细胞核明显、呈圆形或椭圆形、核浆比值大及核仁清晰),淡染呈浅蓝紫色、深染呈蓝紫色。重铬酸钾组神经元排列出现不同程度紊乱(细胞数量减少、细胞间隙增宽、细胞形态不规则、部分细胞着色浅、胞体缩小、胞浆浓染、细胞核深染、固缩及形态不一)。见图1。
2.4 铬暴露对大鼠海马组织GFAP蛋白表达的影响
在光镜下观察,对照组大鼠海马区可见少量淡染的星形胶质细胞,胞体较小且突起较短。重铬酸钾组大鼠海马区可见大量棕黄色星形胶质细胞,且星形胶质细胞密度和染色深度均较对照组偏高,胞体较大且突起较粗,阳性表达细胞较多。见图2。
表2 大鼠Morris水迷宫平均逃避潜伏期比较 (s,±s)

表2 大鼠Morris水迷宫平均逃避潜伏期比较 (s,±s)
组别 第1天 第2天 第3天 第4天 第5天 第6天对照组(n=11) 35.3±5.3 21.2±2.5 18.0±3.6 12.6±2.7 11.4±2.9 9.2±1.9低剂量重铬酸钾组(n=10) 41.4±6.1 26.3±4.8 23.4±3.9 17.3±3.6 14.8±3.5 12.2±2.3中剂量重铬酸钾组(n=10) 47.1±6.4 31.7±4.7 28.5±5.3 22.1±4.4 18.0±3.2 15.1±3.5高剂量重铬酸钾组(n=9) 53.0±6.8 36.5±6.0 33.5±5.5 26.6±5.1 22.9±4.3 17.9±3.9
2.5 大鼠海马组织GSH含量比较
各组大鼠海马组织GSH含量比较,差异有统计学意义(P<0.05)。随着染毒剂量增高,GSH含量降低。见表4。
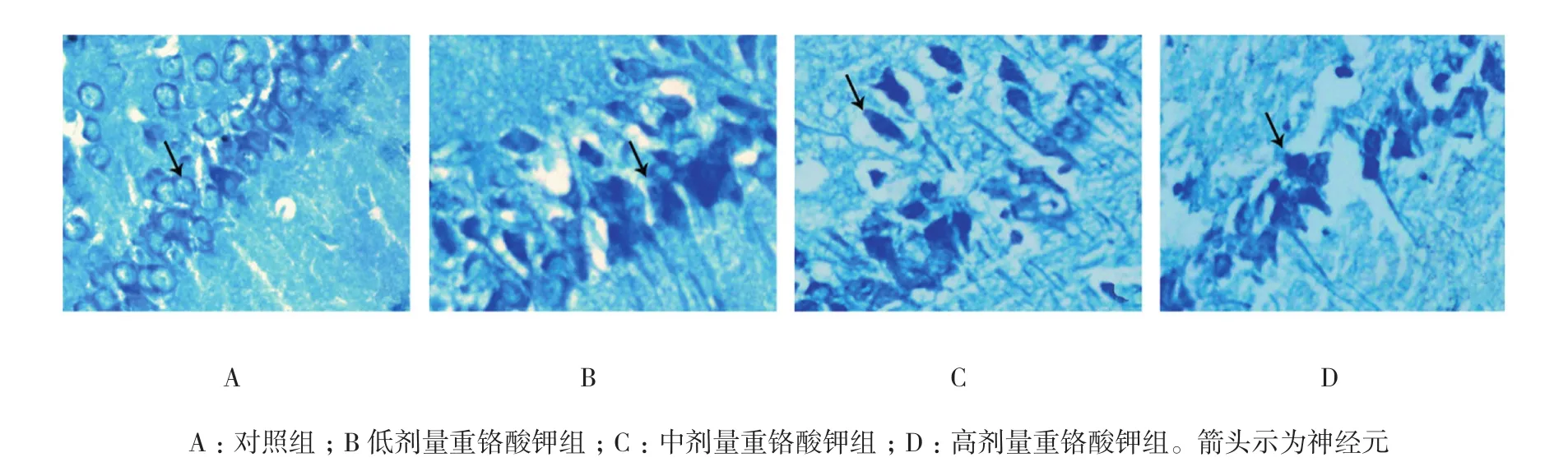
图1 不同剂量的铬暴露对大鼠海马神经元的影响 (尼氏染色×400)

图2 不同剂量的铬暴露对大鼠海马组织GFAP蛋白表达影响 (免疫组织化学×400)
表3 大鼠Morris水迷宫空间搜索实验结果比较 (±s)

表3 大鼠Morris水迷宫空间搜索实验结果比较 (±s)
在原平台象限停留时间/s对照组(n=11) 5.6±0.8 11.1±2.1 46.0±7.9组别 第1次寻找原平台潜伏期/s穿越原平台次数/次低剂量重铬酸钾组(n=10) 8.5±1.3 8.3±1.9 33.7±7.2中剂量重铬酸钾组(n=10) 12.1±1.6 6.3±1.7 24.5±6.5高剂量重铬酸钾组(n=9) 16.0±1.9 4.2±1.1 17.8±5.3F值 93.510 28.513 32.397P值 0.000 0.000 0.000

表4 大鼠海马组织GSH含量比较 (μmol/mg,x±s)
3 讨论
铬存在多种价态,其中Cr(VI)具有生物氧化毒性。在自然界主要以铬酸盐或重铬酸盐的形式存在,毒性最强[12]。神经系统由于其特殊性,是重金属毒性的靶点,更容易受到重金属离子的影响而引起损伤。目前关于铬的研究大多都集中对肝脏、肾脏及肺脏等多种器官的毒性作用,对Cr(VI)神经毒性的认识甚少。本研究经K2Cr2O7的6个月染毒,发现大鼠有活动量和食量逐渐减少、躁动不安及反应迟钝等一系列改变,提示铬对大鼠神经系统有一定的毒性作用,与文献报道基本一致[13]。
Morris水迷宫由英国心理学家MORRIS于20世纪80年代初设计,其应用与海马功能直接相关的空间学习记忆脑机制研究,能准确地反映动物空间学习和记忆能力,广泛应用于学习记忆的神经生物学和神经药理研究。Morris水迷宫实验结果表明,随着铬剂量增加,重铬酸钾组大鼠的学习记忆能力也逐渐降低,表明铬对大鼠的学习记忆能力影响存在一定剂量的效应关系,提示铬染毒影响大鼠的空间学习记忆能力。原子吸收脑铬含量的测定进一步表明,随着重铬酸钾剂量增加,脑铬含量也随之升高。
尼氏染色结果显示,重铬酸钾给药组神经元排列出现不同程度的紊乱,说明Cr(VI)暴露对大鼠的海马神经细胞造成损害。免疫组织化学法实验选择星形胶质细胞标志性蛋白GFAP[14-15],探讨Cr(VI)所致SD大鼠神经系统影响。结果发现,对照组大鼠的海马区仅可观察到少量淡染的星形胶质细胞,胞体较小并且突起较短;重铬酸钾组则可见大量棕黄色的星形胶质细胞,胞体较大且突起较粗,阳性细胞数比正常组多,且剂量越大,阳性表达现象越明显,提示Cr(VI)暴露会对大鼠海马星形胶质细胞有活化作用,剂量越大,活化越明显。
GSH是人体内一种主要生物活性成分,由谷氨酸、半胱氨酸及甘氨酸残基组成。在体内起活化代谢还原系统、激活SH酶及解毒等作用[14],并参与体内的多种代谢反应。Cr(VI)进入细胞后,诱导机体产生自由基,中间产物和自由基均可对DNA、蛋白及脂质等产生损伤,主要在细胞内GSH和抗坏血酸等还原剂的作用下被清除[16-17]。随着重铬酸钾剂量增大,大鼠海马组织中GSH含量有不同程度的降低,提示Cr(VI)会对海马组织造成损伤,其原因可能是随着Cr(VI)染毒剂量增加产生的ROS也随之增加[18],从而导致细胞内抗氧化系统GSH消耗增加[19-20],而使GSH含量降低。
综上所述,长期Cr(VI)暴露,将对大鼠海马组织造成损伤,导致其学习记忆能力的改变,最后引起大鼠空间学习记忆能力下降。笔者将对Cr(VI)的神经毒性进行更深入研究。
