核糖核酸酶抑制因子与整合素连接激酶对膀胱癌上皮-间质转化与转移的影响*
2018-07-11舒静姜源庄翔陈俊霞
舒静,姜源,庄翔,陈俊霞
(1.西南医科大学附属医院 检验部,四川 泸州 646000;2.重庆医科大学细胞生物学与遗传学教研室,重庆 400016)
膀胱癌是常见的泌尿系统恶性肿瘤,目前膀胱癌的治疗尚无有效靶点,膀胱癌发生发展的关键环节与分子机制有待阐明[1]。核糖核酸酶抑制因子(ribonuclease inhibitor, RI)是胞浆内1个由460个氨基酸组成的酸性蛋白[2]。笔者前期运用GST pull down与Co-IP等证明RI与整合素连接激酶(intergrin-linked kinase, ILK)在体内外的直接结合[3]。ILK是1个丝氨酸/苏氨酸激酶家族的成员,它可以靶向多条信号通路促进细胞恶性转化及上皮-间质转化(epithelialmesenchymal transition, EMT)[4]。本研究通过探讨RI与ILK相互作用对膀胱癌EMT与转移的作用,为RI作为膀胱癌诊断与治疗新的靶点提供理论依据。
1 材料与方法
1.1 主要材料与试剂
人膀胱癌EJ细胞系(中国科学院上海细胞库),无特定病原体(SPF)级BALB/c裸鼠(本校实验动物中心),胎牛血清、RPMI 1640(Gibco公司 ),LipofectamineTM2000(Invitrogen公司),过表达载体 pCMV-3×flag-ILK 与 pCMV-3×flag、 慢病毒LV5-RI homo与LV5-NC(本实验室保存),兔抗人RI多克隆抗体(本实验室保存),兔抗人E-钙黏蛋白(E-cadherin)、基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)、基质金属蛋白酶9(matrix metalloproteinase 9, MMP-9)、N钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、扭转蛋白(Twist)、核转录因子(Snail)、重组人S100钙离子结合蛋白A4(S100A4)、信号转导蛋白Smad2(Smad2)与βactin、鼠抗人ILK(Bioworld公司),荧光二抗(中杉金桥公司)。
1.2 方法
1.2.1 细胞培养、转染与慢病毒感染 含10%胎牛血清的RPMI 1640培养基于37℃、5%二氧化碳CO2孵箱中培养EJ细胞。按照说明书,用LipofectamineTM2000分别转染pCMV-3×flag-ILK或pCMV-3×flag至EJ细胞,48 h后,以0.4 g/L的G418筛选14 d,细胞收获后分别命名为EJ-ILK或EJ-FLAG。另以感染复数(MOI)=20的慢病毒LV5-RI homo或LV5-NC感染EJ细胞,48 h后,以0.2 g/L的嘌呤霉素筛选细胞收获后分别命名为EJ-RI或EJ-LV5。
1.2.2 免疫荧光检测细胞 细胞爬片后,或冷冻组织切片后,80%冷丙酮固定10 min,37℃下3% BSA封闭30 min,随后4℃下1∶100稀释的一抗孵育过夜,37℃下荧光二抗孵育2 h,除ILK使用488标记的羊抗鼠二抗,其余均用Cy3标记的羊抗兔二抗。于Leica激光共聚焦显微镜下进行图片获取。
1.2.3 细胞形态观察 稳转细胞系于倒置相差显微镜下观察形态。
1.2.4 Western blot分析蛋白表达 总细胞蛋白裂解后以30 μg每孔上样,经10%SDS-PAGE电泳后转移至PVDF膜,封闭2 h后,4 ℃下1∶500稀释的一抗孵育过夜,再以1∶2 000稀释的HRP标记的二抗37℃下孵育2 h,ECL发光显色,并用Quantity One软件进行定量分析。
1.2.5 裸鼠移植瘤模型复制 收集对数期细胞制备悬浊液,以2×106个/只接种于4周龄雄性BALB/c裸鼠背上,每组10只,30 d后处死裸鼠,获取移植瘤及肺组织,移植瘤组织液氮冷冻后,切片,免疫荧光标记,并于激光共聚焦显微镜下观察,肺组织固定,包埋,切片,HE染色后进行病理学检查。
1.3 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 RI与ILK在EJ稳转细胞系中的表达
构建稳定过表达RI的EJ细胞(EJ-RI)、稳定过表达ILK的EJ细胞(EJ-ILK)、稳定感染空载LV5的EJ细胞(EJ-LV5)、与稳定转染空载FLAG的EJ细胞(EJ-FLAG)。EJ-RI细胞RI蛋白荧光强于各对照组,而EJ-ILK细胞ILK蛋白荧光强于各对照组(见图1)。
2.2 RI与ILK共定位
运用免疫荧光技术,Alexa 594标记RI蛋白(红色),Alexa 488标记ILK蛋白(绿色),Dapi染核(蓝色),激光共聚焦扫描观察EJ细胞中RI与ILK的表达,RI与ILK胞质胞核均有表达,两者融合之后可呈黄色,存在共定位的现象,两者存在相互作用。见图2。
2.3 稳转细胞系细胞形态
倒置相差显微镜下观察各稳转细胞形态,EJ-RI细胞、EJ-LV5细胞、EJ-FLAG细胞与EJ细胞均呈现上皮型细胞形态,而EJ-ILK细胞呈明显梭形、纺锤形,具有间质型细胞特点。见图3。
2.4 EMT标志物在各稳转细胞系中的表达
Western blot结果显示,EJ-RI组与EJ组比较,E-adherin表达水平升高(P<0.05),而EJ-ILK组与EJ组比较,间质标志物MMP-2、MMP-9、N-cadherin、Vimentin、Twist、Snail与S100A4表达水平升高(P<0.05)。见图4和附表。
2.5 裸鼠移植瘤中RI、ILK与EMT标志物表达
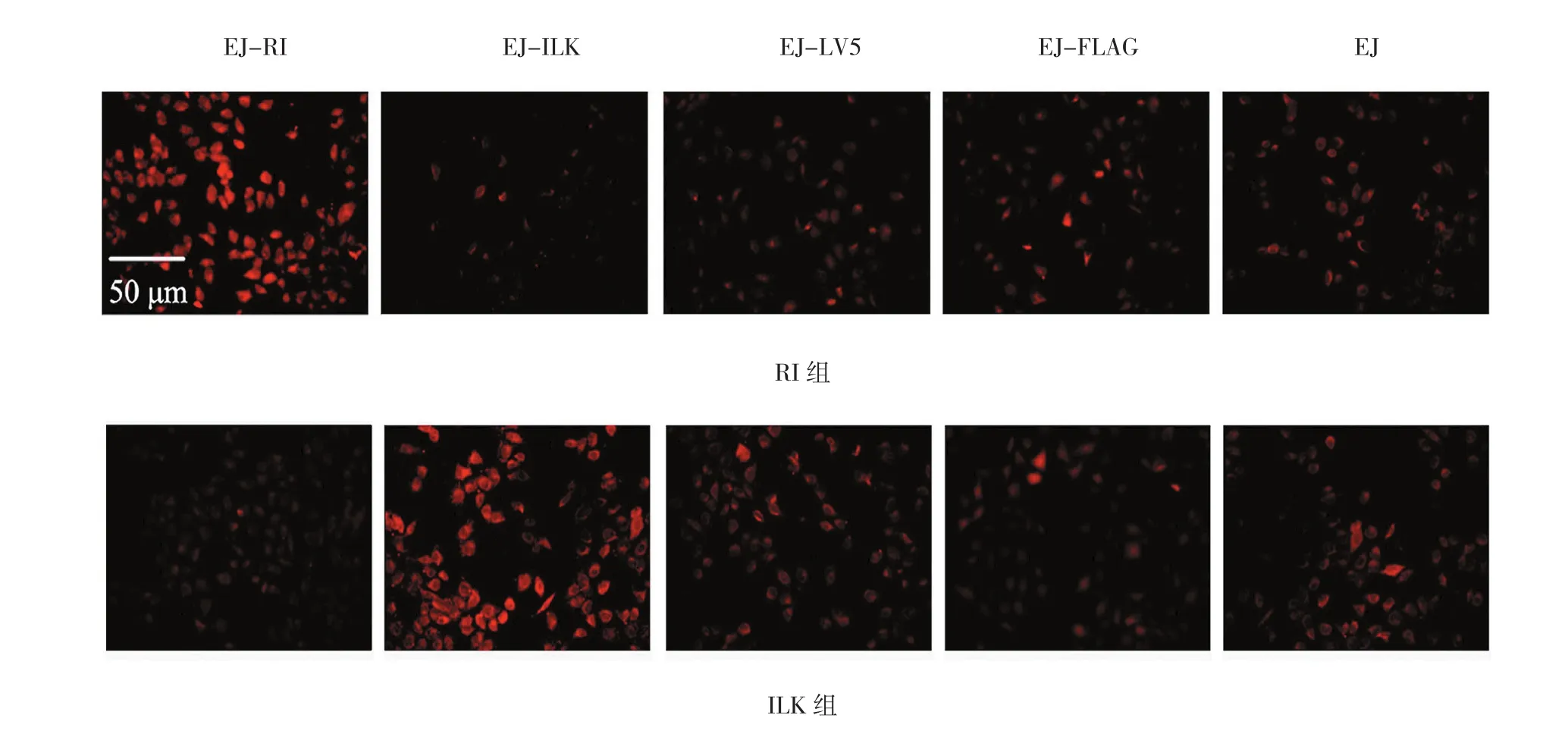
图1 RI与ILK在EJ细胞中表达 (免疫荧光)

图2 RI与ILK在EJ细胞中的共定位 (免疫荧光)
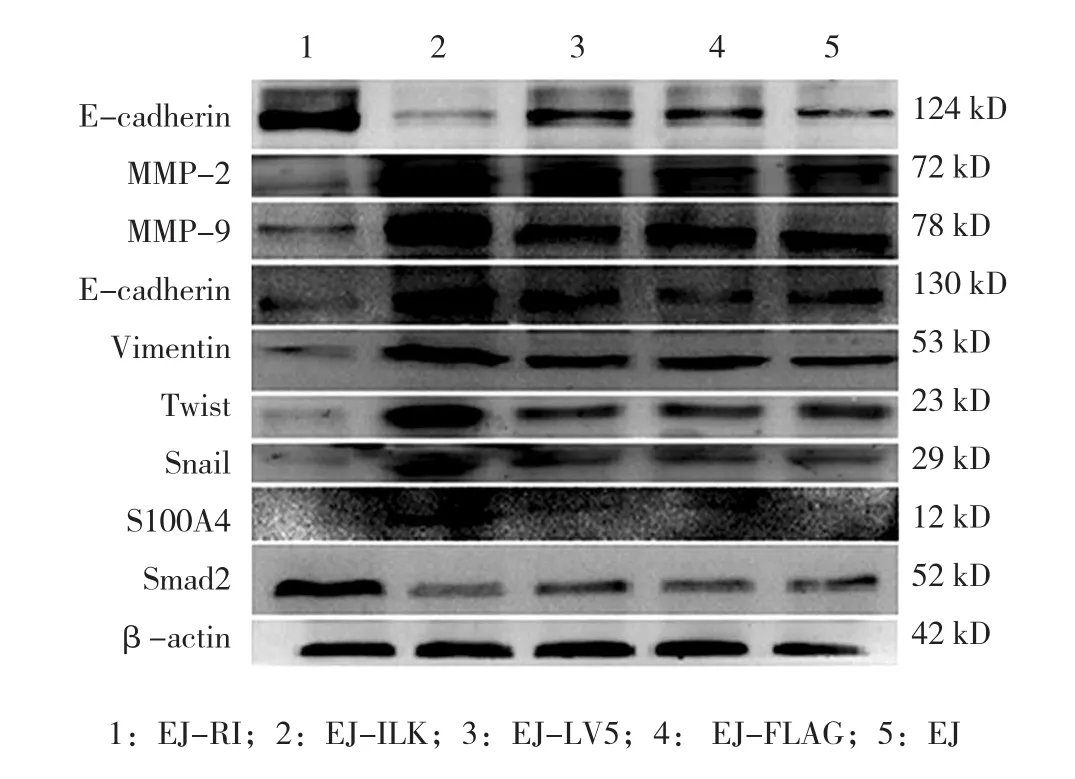
图4 EMT标志物检测结果 (Western blot)
复制裸鼠移植瘤模型,移植瘤切片免疫荧光检测相关蛋白表达。EJ-RI组高度表达RI与上皮标志物E-cadherin,EJ-ILK组高度表达ILK与间质标志物MMP-2、MMP-9和Vimentin。见图5。
2.6 裸鼠自发性肺转移
HE染色裸鼠肺切片,EJ-RI组与对照相比观察到自发性肺转移减少,EJ-ILK组与对照比较肺转移结节增多。见图6。

图5 移植瘤RI、ILK与EMT标志物的表达 (免疫荧光)

附表 各组蛋白EMT标志物比较

续附表

图6 裸鼠肺病理切片图(HE)
3 讨论
RI具有抑制核糖核酸酶A(RNaseA)的活性,可以调节mRNA、rRNA等的含量[5]。既往研究表明,RI能与具有低RNaseA活性的血管生成素(angiogenin,ANG)发生直接结合,通过相互作用抑制ANG的活性,负性调节ANG介导的rRNA的转录和核糖体的生成,并抑制肿瘤血管生成[6-8]。此外,研究还发现RI二级结构中具有LRR模体,LRR模体包含2段平行排列的α-螺旋,其中存在每隔7个规律性排列的亮氨酸残基,LRR模体为RI与其他蛋白质发生相互作用提供了有效的平台[2]。
ILK是1个丝氨酸/苏氨酸激酶家族的成员,其位于细胞黏着斑上,可以靶向催化蛋白激酶B(protein kinase B,PKB/AKT)并活化下游的哺乳动物雷帕霉素靶 蛋 白(mammalian target of rapamycin,mTOR)[9-10]。ILK作为协调细胞外基质和生长因子的信号转导多功能效应器,在调控细胞的生长、分化、黏附、迁移、侵袭、血管生成及EMT等基本过程中起核心的作用[11]。EMT是肿瘤发生转移过程中的重要启动步骤,EMT过程中上皮细胞获得间质细胞的特点,减弱细胞间黏附,破坏细胞极性,获得侵袭、迁移与浸润能力的细胞,有利于肿瘤细胞转移到其他组织和器官,并在远处形成转移灶[12]。近年来研究发现,ILK能通过直接或间接作用促进EMT的发生;ILK的表达与EMT标志物E-cadherin、N-cadherin、Snail及Β-Catenin等的表达密切相关[4]。ILK在多种肿瘤侵袭转移中高表达,其有望成为肿瘤治疗中1个重要的干预靶点。
人类RI与ILK基因具有高度同源性,两者均定位于11号染色体短臂1区5带。前期研究发现RI与ILK蛋白在体内体外均能直接结合[3]。本研究亦发现,RI与ILK蛋白在膀胱癌EJ细胞中存在共定位现象,也提示两者存在直接结合与相互作用。本研究运用免疫荧光分析构建的稳转细胞系中RI与ILK的表达,上调RI抑制ILK的表达,而上调ILK显示出相反的结果。此外,本研究还发现,过表达ILK后膀胱癌细胞呈间质型形态,体内体外实验均显示上调ILK后膀胱癌的上皮标志物的表达降低,而间质标志物的表达增高,且过表达ILK的移植瘤呈现更强的自发性肺转移能力。而过表达RI抑制体内外EMT的发生,降低膀胱癌肺转移的能力。本结果均提示RI与ILK的相互作用表现为互相拮抗。本研究通过探讨RI与ILK相互作用发现其对膀胱癌EMT与转移的作用,并揭示潜在的分子机制,为RI作为膀胱癌诊断与治疗新的靶点提供理论依据。
