Knuckle技术辅助反向控制性正向和逆向内膜下寻径技术治疗钙化迂曲的冠状动脉慢性完全闭塞病变
2018-07-11林敬业钟志安张斌黄泽涵吴开泽廖洪涛
林敬业 钟志安 张斌 黄泽涵 吴开泽 廖洪涛
冠状动脉慢性完全闭塞(coronary chronic total occlusion,CTO)病变指闭塞时间大于3个月且远端前向血流心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)分级0级的冠状动脉病变。CTO病变的治疗一直被认为是经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的最后壁垒[1]。但是,随着近年来CTO病变介入技术的不断创新进步,特别是逆向介入技术的开展,CTO病变行PCI的成功率已达90%以上。目前,常用的逆向介入技术中反向控制性正向和逆向内膜下寻径技术(controlled antegrade and retrograde subintimal tracking,CART)是主要的CTO病变通过技术,但该技术存在一定的难度,且耗时较长,有时需要在血管内超声(intravascular ultrasound ,IVUS)指导下完成[2-4]。为了进一步减少手术时间,提高手术效率,我们根据经验进一步改良了反向CART技术开通CTO病变。
1 对象与方法
1. 1 研究对象
回顾性分析2014年1月至2017年8月在广东省心血管病研究所心内二区行冠状动脉造影明确冠状动脉完全闭塞,并运用Knuckle技术辅助反向CART技术开通CTO病变的13例患者。冠状动脉闭塞时间由上次造影时间或患者的临床表现、心电图等信息推算。CTO开通的指征为最优化药物治疗后患者仍存在心绞痛症状。所有入选患者开通CTO病变均先尝试正向PCI,正向尝试发现病变钙化严重后,根据术者决策启动逆向PCI策略。逆向导丝进入内膜下则开始行改良反向CART技术。所有患者术中对病变进行常规J-CTO评分,对侧支进行Werner分级。
1. 2 技术流程(图1)
第一步,尝试正向PCI导丝无法通过CTO病变时,于CTO病变前留置正向导丝,完成正向准备。第二步(逆向PCI的重要步骤),使逆向导丝进入提供侧支循环的对侧或同侧冠状动脉血管,或经过外科冠状动脉旁路移植术后的桥血管,再通过侧支循环达到CTO病变远端。当逆向导丝顺利进入病变远端内膜下间隙,可立即实行反向CART技术。第三步,采用Knuckle技术帮助正向导丝进入内膜下间隙。在微导管支撑下,推送正向导丝自然成袢,继续推送(勿旋转)导丝,多体位投射确保导丝与血管走行保持一致,在导丝抵达CTO闭塞段内则停止推送。同时操作逆向导丝,使正、逆向导丝在空间位置上尽可能靠近。第四步,经正向导丝直接送入直径为2.0 mm的球囊进行扩张。球囊扩张后,扩大正向内膜下间隙,使位于内膜下的逆向导丝从内膜下穿透进入正向血管真腔。用于通过闭塞段的逆向导丝推荐使用Gaia 3th(朝日)、UB3(朝日)等操控性及穿透性好的导丝。整个改良的反向CART技术过程一般不需要IVUS来确定导丝的位置。使用改良的反向CART技术顺利通过CTO病变后,采用导丝体外化技术完成正向导丝通过CTO病变并行球囊预扩张、置入支架完成逆向PCI。手术成功定义为血管闭塞段TIMI血流分级恢复到Ⅲ级并且通过应用PCI技术后残余血管狭窄小于30%。
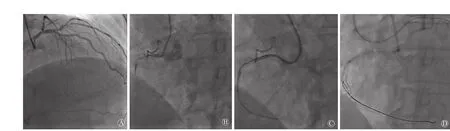
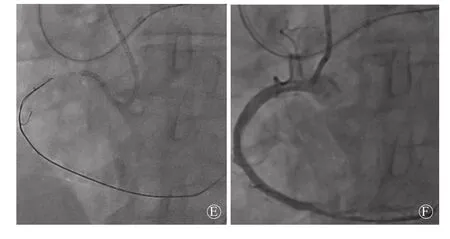
图1 改良反向CART技术造影及手术流程示意图 (病例6) A.左冠状动脉造影见侧支供应右冠状动脉远端;B.右冠状动脉造影见右冠状动脉近端完全闭塞,前向血流TIMI 0级;C.尝试正向PCI,使正向导丝进入假腔,无法通过闭塞病变,启动逆向PCI;D.逆向导丝通过侧支到达闭塞病变远端,正向Gaia3导丝在微导管支撑下,向前推送形成Knuckle环,继续推送(勿旋转)导丝,多体位投射确保导丝与血管走行保持一致,在导丝抵达CTO闭塞段内则停止推送,以正向Guidezilla 延长导管加强支撑力;E.反向CART,经正向导丝送入2.0 mm×20.0 mm小球囊扩张;F.置入支架,完成PCI
1. 3 统计学分析
所有数据采用SPSS 22.0统计软件进行分析。计量资料用表示,计数资料以例(百分比)表示。
2 结果
2. 1 患者基线资料情况(表1)
2014年1月至2017年8月共13例患者使用本项改良的反向CART技术开通CTO病变,平均年龄(62.4±11.7)岁,左心室射血分数(54.3±11.9)%,其中男12例(12/13)。13例患者中合并高血压病5例(5/13)、糖尿病3例(3/13),吸烟4例(4/13)。
2. 2 患者手术过程及特征(表2)
13例使用改良的反向CART技术开通CTO病变均取得技术成功,术后远端前向血流均为TIMIⅢ级。13例患者中CTO病变位于右冠状动脉(right coronary artery, RCA)10例(10/13),左前降支(left anterior descending branch, LAD ) 3 例(3/13)。J-CTO 评 分 1分 2例(2/13),2分 4例(4/13),3分6例(6/13)及4分1例(1/13)。侧支Werner 分级1级9例(9/13),2级4例(4/13)。其中6例患者使用LAD供应RCA的室间隔支(septals,SEP),2例使用左回旋支( left circumflex artery,LCX)供 应RCA的 房 室 支(atrioventricular circumflex, AVCx),1例使用LAD供应LAD的SEP,2例使用RCA供应LAD的SEP,2例使用LAD经LAD远端(distal LAD, Dis-LAD)供应RCA的侧支。正向导丝7例患者使用Gaia3(朝日),4例使用Pilot200(雅培),1例使用UB3(朝日),1例使用Pilot150(雅培)。逆向导丝8例患者应用UB3,5例使用Pilot200。所有应用于反向CART的球囊均为直径2.0 mm的球囊。10例患者前向导丝使用Knuckle技术,1例逆向导丝使用Knuckle技术以及2例正、逆向导丝均使用Knuckle技术。平均逆向PCI术时间为(89.15±46.58) min,最短逆向PCI时间为43 min,而最长的逆向时间为215 min。平均对比剂使用剂量为(203.00±61.02)ml,最少对比剂剂量为100 ml,而最大对比剂剂量为350 ml。所有患者均顺利置入支架,1例因SEP穿孔行心包穿刺,术中未见患者发生冠状动脉夹层、壁内血肿及分支丢失等不良事件,无患者死亡。

表 1 13例患者临床基线资料
3 讨论
近年来,专家术者经验的积累、新技术及新设备的使用大大提高了CTO行PCI的成功率。2017年亚太地区CTO俱乐部(Asia-Pacific CTO club,APCTO)提出应将当代反向CART技术作为逆向PCI的首选策略,以减少闭塞段远端血管因导丝操作而发生壁内血肿的可能;并且推荐扭转操控性能好且穿透力较弱的Gaia2(朝日)作为首选逆向导丝,在血管行径清晰时可谨慎选用穿透能力较强的Gaia3导丝;将IVUS引导下反向CART技术作为常规技术手段写入治疗流程规范[5]。
本中心术者自2014年1月至2017年8月共完成352例CTO逆向行PCI,其中276例获得技术成功。在此基础上,为高效、安全地完成逆向CTO-PCI,术者总结经验提出改良反向CART技术的要点:(1)逆向导丝通过侧支循环,保证登陆区不受损或破坏很少;在正向准备中积极鼓励常规行正向Knuckle技术,在闭塞段快速进入内膜下间隙并扩大内膜下间隙,促使正、逆向导丝在空间位置上尽可能接近。在本研究13例患者中10例使用了正向Knuckle技术,到位后随即保持该位置,并迅速开始逆向操作。(2)在逆向导丝的选择上,不推荐穿透力较弱的Gaia2导丝,而将Gaia3、UB3等穿透力强且操控性好的导丝作为首选,配合直径为2.0 mm的小球囊扩张,能快速通过内膜下间隙并进入病变近端血管真腔。在CTO闭塞段行球囊扩张,不会累及分支血管,不会出现置入支架后分支丢失的情况。在本研究纳入的13例患者中,术中未见分支丢失相关的严重心绞痛发生和心电图改变。(3)在通过CTO病变段一般并不需要IVUS引导穿刺,而遇到长病变,球囊、支架难以通过的病变,推荐常规运用Guidezilla(波士顿科学)延长导管加强支撑力并保护近端逆向导丝的登陆区,有助于高效、安全地完成导丝的体外化过程并顺利完成PCI[6]。本研究运用此改良反向CART技术完成逆向PCI过程的平均时间为(89.15±46.58)min,最短手术时间为42 min。同期2017年1月至8月本中心同一术者完成的41例CTO逆向PCI,逆向PCI过程平均时间为(109.07 ±47.87)min。而本研究采用改良反向CART技术的13例患者平均J-CTO评分为(2.31±0.95)分,整体手术难度偏大,但仍较一般的逆向PCI缩短了手术时间。

表2 13例患者手术过程及特征
本项研究仅作技术要点总结及初步均值比较,进一步的统计学分析需要纳入更多的改良反向CART技术患者。运用此改良反向CART技术平均对比剂剂量为(203.00±61.02)ml,使用最少对比剂剂量为100 ml,与欧洲多中心逆向PCI注册研究平均对比剂剂量(379.3±185.9) ml相比,减少了对比剂的使用[7]。根据此项改良方法流程化地运用反向CART技术的13例患者均获得技术成功,在最大化手术成功率的同时,避免了血管壁间血肿形成及分支丢失,并可减少手术时间和对比剂剂量。因此,使用改良反向CART技术流程化处理CTO病变可高效、安全地完成逆向PCI。
