导引延长导管的临床应用
2018-07-11谢洋赵继义
谢洋 赵继义
随着经皮冠状动脉介入治疗(PCI)患者数目的增多,尤其是患者老龄化,心脏介入医师面对的复杂病变也不断增多。在伴有严重迂曲和(或)钙化的冠状动脉病变中,尽管有充分的病变预扩张和对支架设计的改进,包括对支架追踪性、推进性和整体输送性的提升,但支架到达靶病变仍面临挑战。足够的支撑力是PCI成功的基础。常用的解决方法包括使用EBU、XB、Amplatz等强支撑导引导管、大管径的导引导管、导引导管深插技术、球囊锚定技术、“伙伴”导丝技术、选用硬导丝等[1]。但仍存在应用强支撑导引导管及导管深插技术时发生冠状动脉夹层甚至急性闭塞,球囊锚定时造成锚定血管损伤,“伙伴”导丝技术在复杂病变出现分支血管需要保护时导丝容易混淆和缠绕等风险。使用这些常规技术很难取得预期效果,因而应用子母导管作为器械输送系统来增强后坐支撑力不失为一种安全可行的办法。“子母导管”的设想最初是由介入技术熟练的日本同行提出,其通过标准的“母”导引导管在冠状动脉内插入一个柔软末端“子”导管提供额外后坐支撑力以辅助器械通过,并提供同轴校准方式,简化了复杂情况下的PCI过程。常用的导引延长导管包括Heartrail™(泰尔茂,日本)、GuideLiner™(血管程序解决方案公司,美国)、Guidezilla™(波士顿,美国)。本文重点回顾导引延长导管整体结构、临床应用、可能的并发症及实用技巧。
1 Heartrail™、Guidezilla™、 GuideLiner™导引延长导管的结构
Heartrail™系统常用的子导管为5 F直头导引导管,内径0.059 in(1 in=2.53 cm),适用于绝大多数PCI(直径<4 mm球囊及支架)的需要,总长度为120 cm,其中含13 cm的柔软头端,总长度比母导引导管长20 cm。使用时先拧下“Y”阀,连接止血阀,沿导引导丝送入母导引导管内,再将“Y”阀连接至子导管尾端。必要时,子导管可沿球囊从母导引导管进入冠状动脉内,避免损伤血管内皮,最后根据需要提供的支撑力决定子导管伸出母导引导管的长度。另外,该系列还提供外径更小的4 F子导管。
Guidezilla™导引延长导管(图1)于2013年7月获得美国食品药品监督管理局(FAD)批准。Guidezilla™是一种能与6 F导引导管相兼容的单腔快速交换导管,由近端海波管(A)和导引导管段组成,总长度145 cm。其中近端海波管长120 cm,使用的不锈钢海波管技术增加了推进性、输送性和抗折性;导引导管段长25 cm,有两个在X线透视下清晰可见的铂-铱标记带[不透X线,近端标记带(D)位于导引导管开口端以远3 mm处,远端标记带(G)位于导管末端2 mm处],以帮助在冠状动脉口精确定位。1×1编织层(E)设计在为复杂或迂曲冠状动脉提供额外导引支撑支持的同时不会过度矫直冠状动脉。无创头端(H)无弯曲度且拥有良好的柔顺性,旨在深插的同时最大程度地减少血管损伤和其他并发症风险。内嵌式聚合物包裹的不锈钢圆领结构(C)嵌于近端海波管,能提供更多的支撑支持。外表面的亲水涂层(F)赋予其光滑的表面从而减少摩擦力,改善通过复杂、迂曲病变的输送性。
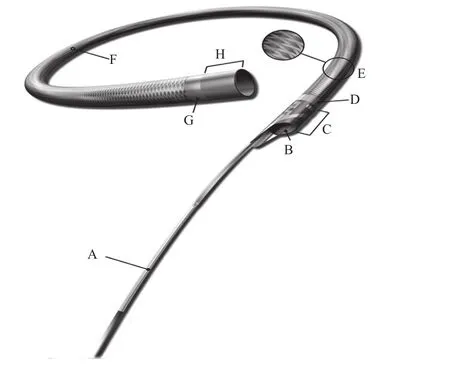
图1 Guidezilla™导引延长导管的结构[2] A.120 cm近端海波管;B.内径0.057 in(1 in=2.53cm);C.内嵌式聚合物包裹的不锈钢圆领结构;D.近端标记带;E.1×1编织层;F.亲水涂层;G.远端标记带;H.无创头端
第一代GuideLiner™于2009年获得FAD批准和欧洲合格认证(CE)。GuideLiner™是一种同轴的“子母”导引延长导管系统,既可以实现血管深插和器械输送,又可通过一个长的柔软管状远端提供主动支撑。与传统深插指引导管不同,GuideLiner™没有导引导管的管头弯曲并且柔软的远端也大大降低了血管损伤的风险,是一种单腔快速交换导管,由金属圆领结构连接20 cm的远端和115 cm不锈钢管组成。第二代V2系统远端导管较上一代的延长5 cm,用于更深程度地深插及增强与内乳动脉、外周血管开口的稳定性,同时对第一代的不锈钢领也进行了重新设计,取而代之的是柔顺性更佳的全聚合物圆领结构。最新的V3系统(图2)[3],保留了25 cm的快速交换部分,在圆领结构过渡时新加入的“半管”式设计大大增强了器械通过时的同轴性,从而降低了支架和圆领结构之间相互影响的发生率。
GuideLiner™ 当前有 5.5 F、6 F、7 F、8 F四种型号满足PCI中的不同需求,而Guidezilla™ 仅有6 F一种型号。相比于GuideLiner™ 降低约1 F的导引内径,Guidezilla™ 拥有更大的内径(0.057 in)及更小的外径(0.066 in),较大的内径允许更多的空间以通过介入器械、治疗物品等,更小的外径减少与导引导管间相互影响。两者同为单轨快速交换导引延长导管,在保留原有导丝的基础上可以快速完成单轨交换,避免了重新进入导丝时误入夹层的风险,操作时不需要断开和重新连接止血阀,并且由于不是全长的导管,因此不存在两层导管间隙的问题(相比于Heartrail™),极大地便利了操作的同时减少了空气栓塞的可能,但非全长的导管结构产生了过渡的圆领结构,不可避免地带来了相关的支架变形甚至在释放前脱载的并发症。Heartrail™ 提供4 F的Kiwami子导管,由于内外表面均有亲水涂层和较小的外径(0.056 in),其通过性更佳且更易于深插,同时几乎不会影响冠状动脉血流,有效地解决常规使用5 F子导管时深插冠状动脉困难或危及冠状动脉血流失败的介入病例[4]。
2 器械使用的主要适应证
导引延长导管主要适应证是辅助器械的输送及提升导引导管的同轴性,其次是血栓抽吸、收回丢失的器械、辅助反向控制性正向和逆向内膜下寻径技术(CART)和选择性(靶血管)造影。
2. 1 辅助器械输送及改善同轴性
使用导引延长导管的最常见的适应证是辅助器械输送。Duong等[5]和de Man等[6]给出了基本一致的结果,前者报道导引延长导管主要用于辅助器械的输送及提升导引导管的同轴性(84.7%),后者报告了导引延长导管主要用于辅助输送(59%)改善同轴性(29%)。但如近端成角和迂曲、伴严重钙化、慢性完全闭塞(chronic total occlusion,CTO)病变、远端病变、冠状动脉异常起源、桥血管甚至组合式的复杂情况仍是影响器械输送的最大障碍。尤其是使用桡动脉入径,因为桡动脉入径提供比股动脉更少的支撑支持,并限制使用大口径的导引导管,而无名动脉和升主动脉之间的夹角,进一步减少支撑力,因而选择右侧桡动脉入径时更为突出。但使用桡动脉入径因患者依从性好、出血并发症少、创伤小、缩短住院时间等优点,现已成为国内外行PCI的首选入径,因而辅助器械成功输送显得尤为重要[7]。
2. 1. 1血管成角和迂曲尽管对支架设计进行了改进,包括对支架追踪性、推进性和整体输送性的提升,但严重的血管成角、迂曲仍然是手术失败最常见的原因[8]。导引延长导管提供了一个有效的方法来克服这一挑战,同时血管成角和迂回也是导引延长导管一个最常见的使用适应证。Eddin等[9]经过多元分析得出,血管近端成角是导引延长导管使用的决定性因素,此时介入医师预先在经桡动脉入径的冠状动脉病变中使用导引延长导管,可以有效减少术中对比剂的用量和透视时间等。以血管近端成角45°预测需要使用导引延长导管的敏感度为73%,特异度为74%。Chan等[10]也报道了当靶血管处成角和迂曲时,导引延长导管的使用率分别为31%和7%。
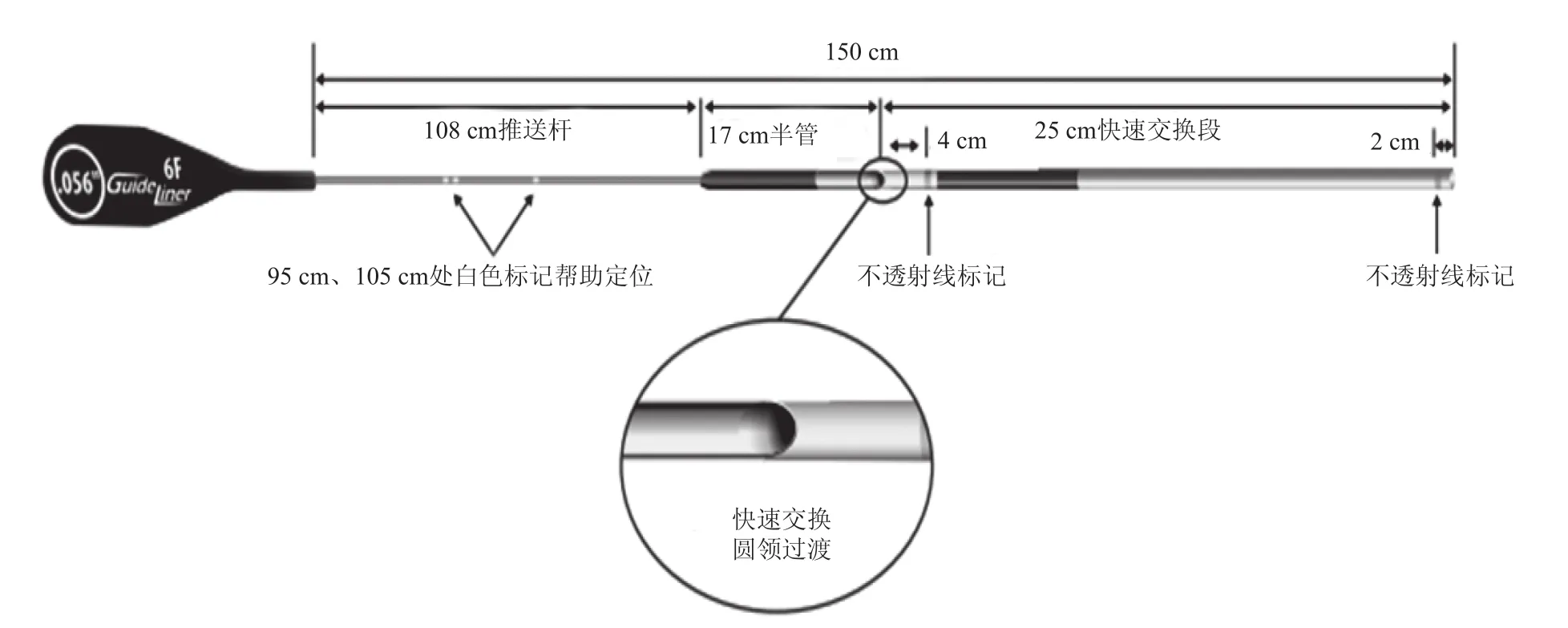
图 2 GuideLiner V3 延长导管[3]
当冠状动脉血管迂曲时(定义:当弯曲数≥3个且弯曲度≥45°,或弯曲数≥1个且弯曲度≥90°)有43%的PCI需要导引延长导管辅助[10]。Dursun 等[11]发现血管近段扭曲有21.9%需要使用导引延长导管;而在一项样本量更大的研究中,严重迂曲需要使用导引延长导管的概率高达35%[12]。
2. 1. 2存在严重钙化及远端病变近端血管存在严重钙化时,由于支架和钙化血管壁间存在严重摩擦,致使前送支架至远端靶病变处仍是一个挑战。在这样的情况下使用导引延长导管会获得双重收益:一方面,提供了强大的后坐支撑力,从而提高了支架前送至靶病变近端的追踪性;另一方面,避免了支架与钙化血管壁间的摩擦。在完成存在重度钙化的PCI术中,有1/3~2/3患者需要使用导引延长导管[11-15]。在需要使用旋磨术的严重钙化病变中,钻头输送到远端病变困难重重,尤其是在血管迂曲时钻头相关的血管穿孔风险明显增加。一些病例报道中介绍了利用导引延长导管建立通道跨越近端迂曲部分辅助钻头输送到远端钙化病变[16-17]。7 F的GuideLiner™可以容纳通过1.25~1.5 mm的钻头。然而钻头通过圆领结构时仍是一个挑战[16]。克服这个问题的方法是体外在导引延长导管远端内手动装载钻头,两者一同推进到入口,然后滑动导引延长导管。导引延长导管主要适用保留近端部分而处理远端病变,可以安全地容纳导管深插部分[18-19]。
2. 1. 3异常开口、异常起源的冠状动脉和冠状动脉旁路移植术后的PCI当冠状动脉开口及近段存在较大解剖异常[如右冠状动脉(RCA)近端呈牧羊钩型]、RCA或左主干呈垂直或更大角度,尤其是左主干及其延续部分呈现这种较大成角的患者(可见于年轻偏瘦或患有肺气肿的患者)会增加导引导管造成夹层的风险,而导引延长导管轻柔地深插(极少造成冠状动脉夹层),增加后坐支撑力的同时提供同轴校准方式有效地解决这一问题[6]。de Man[6]等报道了1例患者左主干及前降支近段呈现这类成角时,使用导引延长导管小心前送深插并跨过成角,成功处理前降支病变,造影结果良好且无冠状动脉夹层,随访良好。
导引延长导管用于异常起源的冠状动脉十分少见,却十分重要,建议尤其是对RCA异常起源优先使用导引延长导管,改善导引导管同轴增强与冠状动脉开口稳定性,并减少透视时间和对比剂剂量[20-21]。
冠状动脉旁路移植术后行PCI同样少见,但十分实用[22]。导引延长导管可以在桥血管中深插以提高支撑支持并提供同轴校准方式,在避免损伤桥血管的同时增强稳定性。Boukhris等[3]报道了1例大隐静脉移植到左前降支,支架内局限性再狭窄的患者,使用导引延长导管成功完成PCI,造影结果良好。
2. 1. 4新介入方法及器械新的介入治疗方法及器械的出现也为输送带来不小的困难,如药物涂层球囊(DCB)、生物可吸收支架(BVS)、光学相干断层成像(OCT)导管、覆膜支架等,它们往往具有较大的外形及较差的柔顺性从而大大降低了输送性,尤其是在复杂冠状动脉解剖基础上需要面临更大的技术挑战。导引延长导管的应用极大地解决了这一难题,同时还可以缩短手术时间、减少对比剂用量及并发症的发生率[23-27]。使用DCB是处理年轻人CTO病变的新型治疗方案,并且血运重建后没有刚性束缚[28],然而拥有大直径和较长长度的DCB具有更大的外形,从而将其送达到靶病变处更为困难。Yew等[23]报道了第1例导引延长导管成功处理这类难题的病例,造影显示RCA远端CTO病变,成功开通闭塞段后,RCA远端弥漫性病变。采用Guidezilla™导引延长导管辅助DCB到达RCA远端,然后回撤导引延长导管,将DCB回拉至RCA中远段,并扩张30 s。最终血管造影显示未见夹层且治疗效果满意。事实证明导引延长导管可以深插并且防止血管损伤,同时为大外形的DCB达到远端血管创建一条光滑通路。操作时需要注意,将DCB送至靶病变以远,撤出导引延长导管后回拉DCB,而不是冒险地前送以调整其位置。DCB治疗CTO不会导致明显的冠状动脉夹层(这可能需要补救性置入支架),血管愈合后不会遗留任何东西[29]。同样地,一些研究报道了导引延长导管克服各类复杂冠状动脉病变成功辅助BVS、OCT导管、覆膜支架到位的成功病例[24,26-27]。
2. 2 血栓抽吸
导引延长导管的另一个重要应用是血栓抽吸。当血栓抽吸导管抽吸失败后,使用各类导引延长导管完成血栓抽吸是安全、有效的[30-31]。血栓抽吸导管常常由于较小内部横截面积而不足以抽吸全部的栓塞物质[32]。另外,大的血栓或细菌栓子可能会卡在抽吸装置的末端,并且在回撤时脱落可引起另一血管栓塞或闭塞[33]。而导引延长导管有较大的管腔尺寸,能产生更强的吸力从而抽吸出更大体积的血栓。值得注意的是,只有导引导管充分插入冠状动脉开口后,导引延长导管才能撤出,以防止任何可能的血栓脱落栓塞其他血管[34]。撤出延长导管后再从导引导管中回吸足够的血液,以确保导管内没有血栓残留,防止血栓无意中重新注射到靶血管中,造成再次栓塞。
2. 3 收回丢失的器械
可以利用导引延长导管收回丢失的器械,如导丝、旋磨钻头等。卡住旋磨钻头是一种罕见的并发症却危及生命,必须及时取出。紧急手术取出是可靠的,但其创伤性很大,因此微创技术是十分必要的,包括再穿过一根导引导丝、使用圈套器取出、导引延长导管辅助取出[35]。但有时导丝难以通过严重狭窄的病变并且鹅颈圈套器不能到达旋转器尖端,而Kiwami (4 F Heartrail™Ⅱ,泰尔茂)由于其外径小于其他类型的子母导管,并且病变通过性极佳,非常适合旋磨钻头尖端。Kanazawa等[36]在尝试导丝及圈套器失败后,使用Kiwami导管并最终成功取出旋磨钻头,避免了外科手术取出。
2. 4 CTO病变
PCI成功治疗CTO病变是非常有意义的。 CTO再通恢复闭塞远端心肌供血,进而改善心功能,有良好远期效果[37-38]。CTO病变是PCI中最具挑战的类型,其成功率不稳定,手术失败的原因是多方面的,主要包括能否成功通过闭塞段、球囊或微导管能否通过病变段等。由于多重PCI策略的应用,如平行导丝技术、逆向导丝技术、CART以及开发新的器械等,导致总体成功率有所增加。Kovacic等[39]报道了28例CTO患者使用导引延长导管辅助球囊和(或)微导管输送时的良好表现,其中85.7%患者中导引延长导管辅助小球囊成功通过CTO病变,整体手术成功率为89.3%。Chan等[10]也报道33例在导引延长导管辅助下开通CTO病变有相似的手术成功率(97%)。
此外,导引延长导管反向CART技术有效地改进了反向CART技术,大大提高了导丝通过闭塞段的成功率,为手术提供了新的方法,具有以下优势:(1)缩短逆向导丝/微导管与正向导引导管之间的连接距离;(2)作为支撑架支撑起局限性假腔;(3)可扩张近端真腔到CTO内膜下空间的通道;(4)为逆向导丝和微导管通过闭塞段进入正向导管提供帮助;(5)为器械的输送提供额外的支持和改善同轴校准[40]。Vo等[41]报道 GuideLiner™反向CART 技术和 Huang等[40]报道Guidezliia™反向CART技术均具有很高的成功率,证明了导引延长导管反向CART技术开通CTO病变是安全、可行的。其成功率高而并发症发生率低,在临床实践中简便、实用,值得推广。
2. 5 选择性(靶节段)造影
采用导引延长导管进行选择性造影,可以避免一些解剖结构带来的显影不佳,可增强血管显影,还可以最大程度减少与其他血管重叠,简化图像的复杂程度[6]。Serajian等[42]研究显示,存在竞争血流的内乳动脉用导引延长导管进行选择性左前降支造影,提供了准确的病变信息,使病变得到正确的评估。近端血管存在动脉瘤时,对比剂通过会形成涡流致使远端血管显影不佳。Pershad等[43]使用导引延长导管越过动脉瘤,将对比剂选择性注射远端血管,成功完成造影。
对比剂通过导引延长导管的近端部分从远端流出(选择性地在靶节段注射)可以减少对比剂用量。由于对比剂未进入近侧分支,全部在靶血管处显影,因此所需的对比剂用量通常比常规直接通过导引导管注射要低得多[44]。众所周知,对比剂肾病(contrast-induced nephropathy,CIN)是一个增加发病率和死亡率的严重并发症,尤其对患有慢性肾病(chronic kidney disease,CKD)而又必须接受PCI的患者。而减少CIN风险的手段是有限的,主要包括:水化方案(含或不含碳酸氢钠),辅助剂(如N-乙酰半胱氨酸),使用非离子型、等渗性对比剂,以及减少术中对比剂剂量。有研究表明,在有CIN风险的患者中,大量对比剂(>100 ml)会增加CIN的发生率,而对比剂剂量是可控的,故在CIN的预防中显得尤为重要,导引延长导管的应用有利于减少对比剂剂量,降低CIN 发生率[44-45]。Tunuguntla等[44]报道了一位 60岁女性因非ST段抬高型心肌梗死入院,既往有高血压病、糖尿病病史,并发糖尿病视网膜病变和肾病Ⅳ期CKD[肾小球滤过率17 ml/(min· 1.73m2)]及贫血。造影显示钝缘支病变,使用导引延长导管选择回旋支近端,最终顺利完成PCI,造影结果良好,而对比剂的用量仅为40 ml,并在之后随访中证实患者未发生CIN。导引延长导管深插冠状动脉靶病变近端,选择性造影大大降低了PCI术中对比剂的用量,对CIN的预防有效且安全。
3 可能的并发症
导引延长导管在极大程度上辅助PCI完成的同时,也不可避免地带来了一些该器械特有的并发症。常见并发症包括支架变形或脱载、压力衰减、心律失常以及器械相关的血管夹层等,若是能意识到并充分了解到该系统的这些局限性,可以更加安全和高效地在PCI中使用。
3. 1 支架毁形或脱载
以往报道导引延长导管造成的支架变形几乎均发生于辅助较大直径的支架时(≥4 mm),所以推测此并发症的发生与支架直径密切相关[14,46]。而 Waterbury 等[47]报道 8 例支架变形中有4例发生在直径≤3.0 mm的支架中,这表明与器械相关支架的毁形可以发生在各种大小的支架中。
支架变形甚至在释放前脱载发生率极低,可发生于海波管和单轨间的圆领结构,尤其是当其恰好位于导引导管的弯曲部分时[2,6,48]。GuideLiner™、Guidezilla ™均报道过这一罕见并发症(Heartrail™尚未见报道)。GuideLiner™导引延长导管上短而有角度的金属圆领结构是造成支架骨架变形及脱载的原因,随后两代产品通过新的设计来解决这一问题。GuideLiner™ V2除了额外增加了5 cm的快速交换端,还使用了柔顺性极佳的全聚合物圆领结构来增加同轴性,GuideLiner™ V3在保留上一代设计的基础上,独特的半管式设计更进一步增加器械通过时的同轴性,将与圆领结构相关的支架毁形发生率再次降低。Guidezliia™中不锈钢海波管构成的近端轴延伸进入不锈钢圆领结构,这个接合处成为了术中支架脱载的区域,尤其是当存在极大角度的扩张主动脉弓时。Guidezliia™不锈钢的圆领结构可能不如GuideLiner™全聚合物圆领结构一样柔软,当绕过较大角度的主动脉弓时,导致支架抓住了近端过渡的不锈钢圆领结构,阻碍支架输送并造成支架前进时支架脱载。Guidezliia™内嵌式的不锈钢圆领结构设计实现增加支撑支持和器械输送的目的,然而当主要血管存在较大成角时,这似乎反而成为了支架前送的阻碍。
导引延长导管导致支架梁断裂,但有时即刻造影很难发现。Balleby等[49]报道了1例Guidezilla™ 因辅助高压球囊后扩张而进入支架近端,最终造影结果良好。3个月后复查造影时发现支架再狭窄,应用OCT检查显示与延长导管接触的支架部分出现大量支架回缩及多层支架梁断裂。推测其发生机制类似于支架纵向变形,是由于斜行侵入的延长导管对支架内产生作用力而造成的。
3. 2 血管夹层、缺血相关的压力衰减和心律失常
一系列研究均显示与导引延长导管相关的冠状动脉夹层都是罕见的,多出现于血管近端[18,47]。可以置入支架处理夹层,必要时紧急行外科冠状动脉旁路移植术。
值得注意的是,当不计后果地向前推送导引延长导管时确实在极少一部分患者中观察到与缺血相关的明显压力衰减和心律失常。似乎一定程度的压力下降几乎是不可避免的,其中绝大部分的压力只是轻度下降,未出现明显症状及心律失常[47],但当使用较大直径的GuideLiner™时,这一发生率显著升高。Luna等[50]报道显示,使用6 F GuideLiner™导引延长导管时出现高比例的压力下降(57%),应引起术者注意。
3. 3 其他
其他并发症包括空气栓塞、导引延长导管相关的器械丢失及导引延长导管自身部分丢失。de Man等[6]发现在导引延长导管插入时,由于导引导管的排气不足引起空气栓塞。Duong等[5]报道了一个患者术中采用导引延长导管切断导丝,导致导丝掉落至左肾动脉引起栓塞,使用4~8 mm环状圈套器取回。Bhat等[51]报道了GuideLiner™远端延长部分从推送杆脱离落入主动脉,最终送入小球囊膨胀后成功取出。
4 实用技巧
(1)导引导管内开始置入导引延长导管时,推送杆应该处于水平位置,并且前送时不旋转,以避免导引导丝缠绕[52]。(2)导引延长导管使用时减少了工作管腔的空间使得空气栓塞的风险增加,可通过缓慢地前送和回撤器械给予时间充分排出系统内的空气,从而降低其发生率[6]。(3)为了避免支架移位及脱载,可以把支架放在Guidezliia™、GuideLiner™的延长部分,使其仍然在导引导管的直线段(弯曲前),再将两者同时推进(支架仍然在延长部分)送入动脉,将支架前送置于病变处[18]。(4)主要血管迂曲时,在向前推送支架时稍稍后撤Guidezliia™、GuideLiner™,此时应避免端轴终末的圆领结构处于成角较大的主要血管或主动脉内[2]。(5)在冠状动脉内推进遇到阻力时,回撤导引延长导管至导引导管内,然后重新前送一个球囊导管(以改善同轴性)再重新进入靶血管[15]。(6)当导引延长导管进入冠状动脉时,术者应始终观察冠状动脉压力波形从而验证存在足够的正向血流,防止相关的低压力及心律失常[47,53]。(7)当近端血管存在严重病变时,可以首先在近端置入支架,然后轻柔地将导引延长导管通过近端支架送至远端辅助支架置入(即近端到远端支架)[6],此时应注意避免变形或纵向压缩近端置入的支架[54-55]。(8)面对复杂病变尤其是迂曲及钙化时,有时导引延长导管难以深插到位,此时可以将球囊送至靶病变处膨胀作为锚定,从而提高导引导管的支撑力,辅助远端输送导引延长导管,称为球囊远端锚定技术[52]。(9)球囊远端锚定失败或不宜使用时,可以使用球囊辅助追踪技术[56-57]。(10)尽量缩短导引延长导管深插后在冠状动脉内停留的时间。
5 结论
导引延长导管显著地提升了复杂病变时PCI术的成功率,同时拓展了PCI的范围。介入医师需要注意可能的并发症,同时能够熟练掌握在不同复杂情况下操作,可以有效减少甚至避免一些并发症的发生。介入医师应充分了解各类导引延长导管的结构、特性及适应证,结合所处介入中心应用导引延长导管经验,合理选择及应用,并勇于创新,不断拓展新的使用范围。
