冠状动脉支架置入术后壁内血肿的相关分析
2018-07-11常书福马剑英李晨光戴宇翔陆浩张峰姚康颜彦樊冰王齐兵钱菊英葛均波
常书福 马剑英 李晨光 戴宇翔 陆浩 张峰 姚康 颜彦 樊冰王齐兵 钱菊英 葛均波
冠状动脉壁内血肿(intramural hematomas,IMH)是由于血液在冠状动脉血管壁中层、中层与外弹力膜之间集聚膨大形成。大部分是由于自发性或医源性内膜破裂,血液进入中膜腔,因无出口或出口较小,内膜向内移位,外膜向外移位形成IMH;还有极少部分由于冠状动脉滋养血管破裂,内膜没有破口,血液聚集形成IMH[1]。经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)特别是支架置入术后IMH并不少见,很容易漏诊和误诊,处理不当可造成灾难性后果。本文拟统计分析本院冠状动脉支架置入术后IMH的发生情况、相关因素、表现及处理方法,为以后的PCI提供经验借鉴。
1 对象与方法
1. 1 研究对象
回顾性分析2011年1月1日至2016年12月31日在复旦大学附属中山医院行PCI的非冠状动脉完全闭塞病变患者,支架置入术后发现IMH 26例。
1. 2 研究方法
统计患者临床基线资料、术前检查化验及术中发现IMH的表现及处理方法,包括有无行血管内超声检查、是否行PCI。统计术前术后心肌损伤标志物的变化。
1. 3 术后随访及观察指标
对所有患者进行住院期间及出院后随访。出院后随访采用电话随访和冠状动脉造影复查。观察患者主要不良心血管事件(包括心肌梗死、恶性心律失常、心力衰竭、心源性死亡及靶病变再次血运重建)的发生情况。
1. 4 统计学分析
所有数据应用SPSS 15.0统计软件进行处理。正态分布计量资料以均数±标准差表示;计数资料以率或构成比表示。手术前后的化验数值比较采用配对样本t检验,以P<0.05为差异有统计学意义。
2 结果
2. 1 26例患者临床资料情况(表1)
26例患者中男15例(57.7%),平均年龄(67.40±8.44)岁。其中高血压病17例(65.4%),吸烟2例(7.7%),脂代谢紊乱5例(19.2%),糖尿病5例(19.2%),冠心病家族史1例(3.8%),陈旧性心肌梗死病史4例(15.4%),既往PCI史5例(19.2%),既往冠状动脉旁路移植术史1例(3.8%)。4例(15.4%)患者因急性冠状动脉综合征入院,因此26例患者术前平均心肌肌钙蛋白T(cTnT)、肌酸激酶同工酶(CK-MB)高于正常值,且术后较术前明显升高[cTnT:(0.46±0.77)ng/ml比(0.16±0.50)ng/ml,P=0.039;CK-MB:(43.10±65.30)U/L比(18.36±25.10)U/L,P=0.035]。
2. 2 26例患者冠状动脉造影及PCI情况(表2)
26例患者中单支冠状动脉病变10例(38.5%),双支冠状动脉病变9例(34.6%),三支冠状动脉病变7 例(26.9%),平均冠状动脉病变(1.88±0.82)支。无支架内再狭窄或桥血管病变。出现IMH的靶病变为右冠状动脉10例(38.5%)、前降支9例(34.6%)、回旋支6例(23.1%)、左主干2例(7.7%),其中1例患者前降支、回旋支均发生。11例(42.3%)患者冠状动脉无夹层或钙化,1例(3.8%)患者冠状动脉存在明显钙化,9例(34.6%)患者冠状动脉存在夹层,5例(19.2%)患者冠状动脉同时存在夹层和明显钙化。16例(61.5%)患者IMH累及支架外远端,3例(11.5%)累及支架外近端,2例(7.7%)累及支架外近端及支架内,3例(11.5%)累及支架内,1例(3.8%)累及支架内及支架外远端,1例(3.8%)累及支架外两侧。有12例(46.2%)患者行血管内超声检查,发现血管壁中层内或中层与外膜之间新月形或环形的强回声区压迫管腔,其中5例患者合并夹层征象。发现患者IMH后,13例(50.0%)患者直接置入支架,6例(23.1%)患者未予处理,2例(7.7%)患者行单纯球囊扩张,5例(19.2%)患者球囊扩张后行支架置入术。术后即刻2例(7.7%)患者因IMH致远端血管重度狭窄、闭塞。
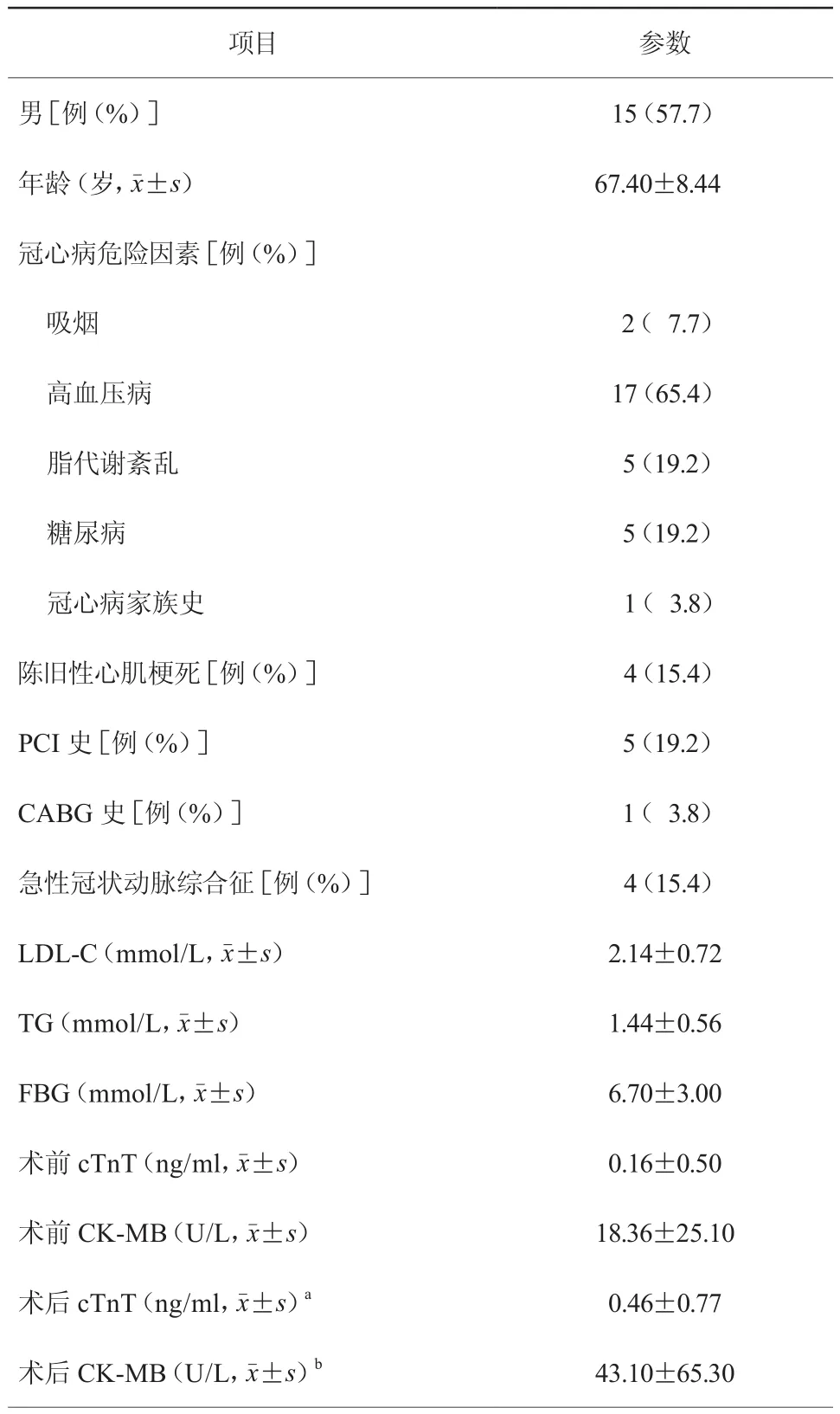
表1 26例患者临床资料
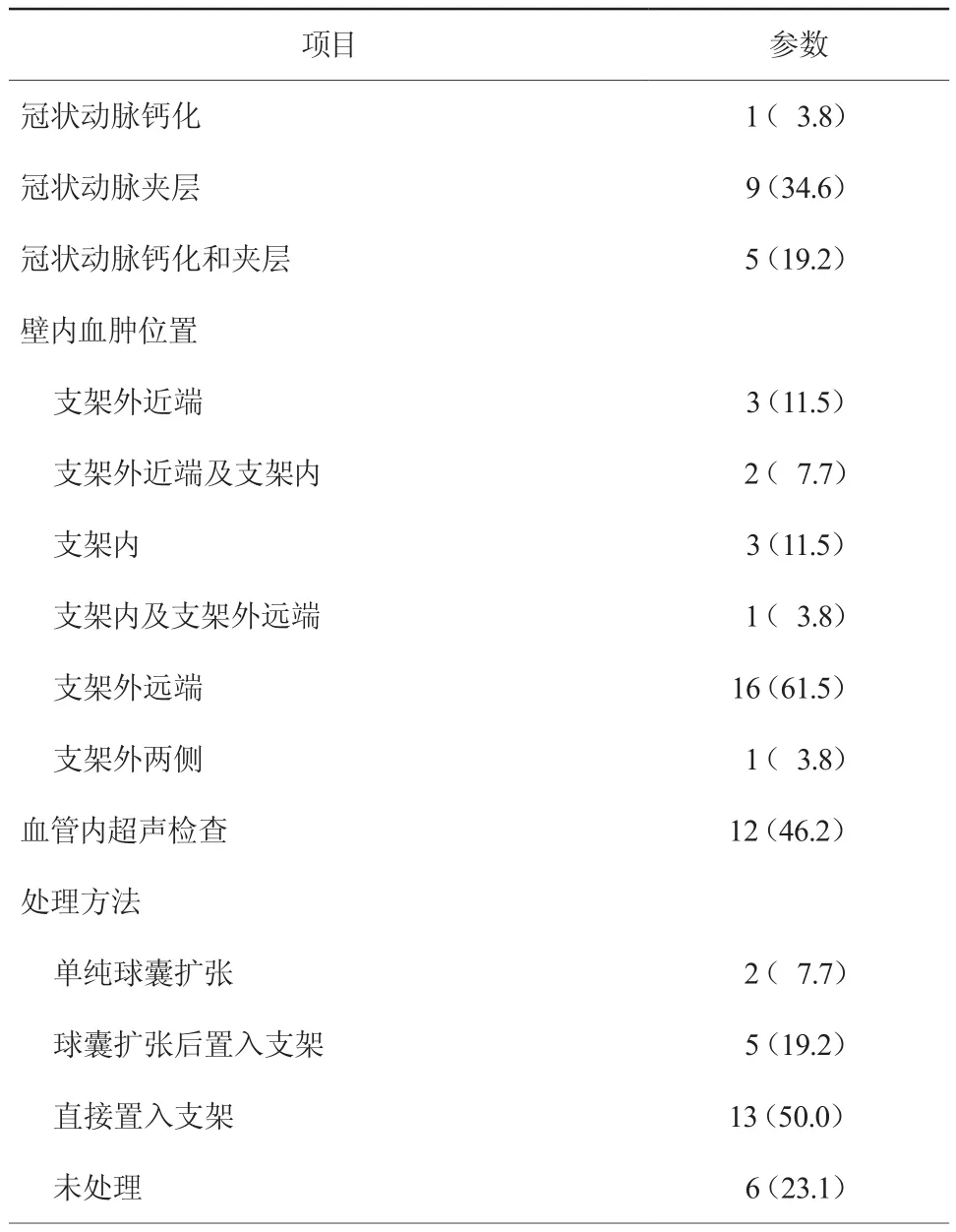
表2 26例患者冠状动脉造影及PCI资料[例(%)]
2. 3 术后及长期随访结果
术后4例患者复查心电图示ST-T动态变化,并逐渐恢复。这4例患者中有2例患者因术中IMH致远端血管重度狭窄、闭塞导致,胸闷、胸痛症状明显,再入导管室行支架置入术;其中1例患者再次行支架置入术后因IMH延伸致远端血管闭塞再行第3次支架置入术;另外2例患者因分支闭塞导致,无胸闷、胸痛不适,未行PCI术。出院后平均随访(2.39±1.68)年,所有患者未见主要不良心血管事件发生。有5例患者复查冠状动脉造影,其中2例患者术后3个月IMH完全吸收,1例患者1年后IMH完全吸收,另2例患者1年后冠状动脉造影仍可见IMH征象。
3 讨论
PCI过程中的IMH发生率并不明确,2002年Maehara等[2]通过血管内超声检查发现PCI过程中IMH发生率约为6.7%。但国内外并无其他相关文献数据。通过检索本院PCI数据库,估计本院冠状动脉非完全闭塞病变PCI过程中IMH发生率在0.1%左右。随着对IMH认识的不断加深,实际发生率肯定远高于此。
本研究26例患者中男性比例稍高,高血压病患者较多,除高血压病以外的其他冠心病危险因素并不多。高血压病患者血管重塑、弹性下降,冠状动脉扩张后内膜容易撕裂损伤、夹层,而高血压可加重夹层IMH。本研究中1例患者术中严重高血压,并发累及冠状动脉支架两侧的IMH。值得注意的是,2例女性患者患有结缔组织病,而结缔组织病引起冠状动脉内膜损伤、无菌性炎症,可能是冠状动脉夹层和IMH产生的基础。对此类患者进一步筛查结缔组织病可能有助于IMH的预防。既往研究发现IMH好发于糖尿病、非严重冠状动脉病变患者[2],可能与糖尿病患者弥漫性冠状动脉粥样硬化有关。但目前的研究样本量小,并不能准确描述此类患者的临床特征和危险因素。
冠状动脉钙化增加了PCI的难度和风险,球囊扩张通常需要较高的压力,而由于钙化分布不均匀,球囊扩张高压力分布不均,产生很大的剪切力,容易发生血管夹层、穿孔[3]。本文中6例重度钙化患者均出现冠状动脉夹层和IMH,其中1例旋磨后出现严重IMH,导致远端分支闭塞。除了钙化病变外,球囊扩张的压力越大,冠状动脉内膜越容易撕裂出现夹层。本研究发现壁内IMH最常累及支架外远端,单纯累及支架外远端患者比例高达61.5%,这可能与远端相对于近端小、受力局部压力更大有关。本研究中20例未合并钙化的患者也出现了IMH(同时合并或不合并冠状动脉夹层),这些患者仅使用命名压扩张球囊及支架,没有高压力扩张。因此,除了球囊、支架扩张的压力以外,PCI后IMH的出现也和斑块的类型、偏向分布、长度,以及选择支架的尺寸、置入位置有关。
PCI过程中,球囊扩张斑块,斑块撕裂后血液进入内膜腔后无出口则形成IMH。因此IMH常合并冠状动脉夹层,冠状动脉造影时易于识别。美国国立心肺血液病研究所将冠状动脉夹层按照严重程度及急性闭塞的风险分成六种不同类型[4]: A型,管腔内少许内膜撕裂透亮影,少量或无对比剂滞留,急性闭塞发生率为0;B型,2个平行管腔或由透X线区分开的双重管腔,少量或无对比剂滞留,急性闭塞发生率3%;C型,冠状动脉管腔外有对比剂滞留,急性闭塞发生率10%;D型,冠状动脉管腔呈螺旋形对比剂充盈缺损,急性闭塞发生率30%;E型,持续对比剂充盈缺损,急性闭塞发生率9%;F型,冠状动脉完全闭塞,急性闭塞发生率69%。A型至D型造影可发现明显内膜撕裂征象,而E型和F型夹层并无明确内膜撕裂破口征象,故是否属于夹层尚存在争议。本研究中14例(53.8%)患者冠状动脉夹层和IMH同时存在,从A型至E型夹层均存在,冠状动脉造影易于发现;12例(46.2%)患者支架置入后仅发现IMH,而冠状动脉造影无夹层征象,因此不易识别。这些患者支架置入后支架外出现新的冠状动脉狭窄病变,需排除冠状动脉痉挛或冠状动脉血栓,行血管内超声[5]或光学相干断层成像[6]检查可以明确。本研究中12例患者支架置入后支架边缘出现新的冠状动脉狭窄节段,无明显冠状动脉夹层表现,反复于冠状动脉内注射硝酸甘油或维拉帕米后狭窄未能恢复,考虑IMH,其中9例患者行血管内超声检查得到证实。与既往研究结果类似,血管内超声检查发现,造影未发现冠状动脉夹层的IMH无明显内膜撕裂破口,IMH多发于无斑块侧的偏心性斑块病变血管壁,多表现为均匀强回声,少数为低回声或无回声[2,7]。
IMH是否需要进一步处理,目前尚无共识进行规范,需根据是否合并夹层、存在支架内或外、累及近段还是远段、狭窄缺血的程度等综合考虑。而至关重要的是考虑IMH是否会进展至冠状动脉急性闭塞,但目前尚无明确的因素来预测。对于单纯支架内IMH,支架已经覆盖,无需处理。而对于合并夹层的支架外IMH,考虑到夹层IMH延伸及血管闭塞的风险,本研究中所有术者对这些患者均行支架置入术,尽管A、B型夹层导致冠状动脉急性闭塞的概率很低。对于无冠状动脉夹层的支架外IMH,本研究中2例患者行血管内超声检查后未予干预,10例患者再行支架置入术覆盖IMH部位,其中5例患者球囊扩张后(1例患者予切割球囊扩张)置入支架,5例患者直接行支架置入术。如果单纯局限性IMH、管腔狭窄不严重可考虑不予干预,待其自行吸收。处理IMH时,与普通冠状动脉粥样斑块所致狭窄不同,单纯普通球囊扩张IMH并不推荐,因为反而可能会导致IMH延展。切割球囊可能是一种好方法,理论上可以切开内膜、引流壁内血液、缩小IMH体积,但IMH并非坚硬的斑块,切割球囊刀片可能并不能切开较柔软的内膜,因此目前效果尚不肯定。再次置入支架封闭IMH的远端、切断IMH延展的路径是常规方法。参照既往研究处理自发性冠状动脉夹层及IMH的经验建议[8],在血管内超声检查或光学相干断层成像指导下,定位支架于IMH远端5~10 mm处,与原支架重叠封闭IMH远端,选择可降解支架可能优于裸金属支架[1]。
IMH的预后与管腔狭窄的程度以及IMH是否进展密切相关。而局限性IMH、管腔狭窄不严重,并无心血管不良事件发生,IMH能自行吸收,但吸收的时间可能和IMH的范围有关[1]。本研究中2例患者1年后复查IMH未吸收,均为支架置入后IMH范围广、导致远端血管闭塞的患者。部分IMH会逐渐扩大、延展至冠状动脉急性闭塞,引起心肌梗死等不良事件[1]。本研究中2例患者术后IMH从右冠状动脉中端逐渐延展至远端,导致冠状动脉急性闭塞而行再次PCI。对于支架置入术处理IMH,本研究中并未见主要不良心血管事件发生,但IMH完全吸收后,原先贴壁良好的支架可能会出现贴壁不良导致冠状动脉血栓事件。因此这类患者需要复查冠状动脉造影及腔内影像学检查,观察支架扩张、贴壁情况,并指导抗血小板药物应用的时程。
PCI过程中IMH并不罕见,高血压病患者易于发生。根据病变长度选择合适的支架长度及直径,谨慎高压释放及扩张支架对于预防PCI术后IMH尤为重要。IMH常合并冠状动脉夹层、易于发现,而无冠状动脉夹层的IMH常表现为新发的非痉挛、非血栓的狭窄病变。对于症状轻微、无缺血表现、急性血管闭塞风险低的患者可选择保守治疗,IMH可自行吸收。IMH范围较广则不易吸收,且可逐渐进展致冠状动脉急性闭塞,需行支架置入术。目前对于PCI术后IMH了解太少,仍需进一步大规模研究。
