超声造影引导下肺活检对周围型肺癌的诊断价值▲
2018-07-10鹏张肖海燕唐楠吴彤刘国辉盛明洪况守凤
吴 鹏张 璇*肖海燕唐 楠吴 彤刘国辉盛明洪况守凤
(重庆市涪陵中心医院,1 超声科,2 呼吸科,3 病理科,重庆市 408010)
周围型肺癌主要分布于肺段周围部分或其远端支气管内,临床上常规采用纤维支气管镜或CT引导下活检进行定性诊断。由于瘤体大多位于肺段的边缘部分,因此纤维支气管镜往往不能到达病灶位置,故检出率较低;而CT引导下活检有射线辐射等不利因素,且重复性不佳。超声造影(CEUS)作为一种可以实时动态评价脏器及肿瘤组织微血管灌注的影像技术,近年来被广泛应用于肺部肿瘤的诊断。我院自2013年8月至2017年2月开展实时CEUS引导下对肺周围型占位病变进行穿刺活检,并对其超声造影特点与肿瘤组织的微血管分布关系进行分析总结。现报告如下。
1 资料与方法
1.1 一般资料 本组病例均为我院呼吸内科收治且经胸部CT检查发现肺段边缘贴近胸膜的周围型占位病变患者42例,其中男28例,女14例,年龄36~70岁,平均53.4岁。所有病例均经CT或超声测量肿块大小,直径2.0~6.2 cm,其中病灶位于右肺26例,左肺16例;胸壁或胸膜侵犯并转移灶9例;纵隔淋巴结肿大15例;7例伴有少量胸水。所有病例术前均常规查凝血并排除穿刺禁忌证。
1.2 仪器及器械 采用东芝Aplio500型彩色多普勒超声仪,随机内置程序编码谐波造影及时间-强度曲线(time intensity curve,TIC)分析软件,造影剂为Bracco公司声诺维(SonoVue)。美国巴德Bard公司生产的活检枪搭配18G穿刺活检针。肿瘤病理切片微血管染色采用小鼠抗人CD34单克隆抗体。
1.3 检查及穿刺方法 常规二维超声观察占位病变的形态、大小、内部回声,然后做彩色多普勒超声了解病灶内部及周边血供情况。注射造影剂前切换至CHI成像模式,机械指数设定为0.06,造影剂为声诺维(SonoVue),25 mg干粉溶解于5 mL生理盐水,充分振荡静置待用。首次诊断造影剂使用剂量:经肘部浅静脉快速注入2.4 mL,随后推注5 mL生理盐水冲管。选择病灶受肋骨干扰最小切面,注射造影剂后连续观察病灶持续5 min并存储RAW格式图像。根据以往文献资料界定注射造影剂后<6 s增强为“肺动脉期”,≥6 s为“支气管动脉期”[1]。造影剂进入瘤体后根据增强模式分布情况分为均匀型、不均匀型;根据肺组织进入造影剂后增强程度分为高增强、低增强和无增强。造影结束后绘制TIC曲线,根据TIC曲线记录峰值强度,计算增强指数=(峰值强度-始增强度)/始增强度。穿刺部位与TIC曲线取样部位一致。参照造影表现,设计合适的穿刺靶点及路径(图1~2):①造影高增强区域;②造影低增强区域;③造影显示滋养血管的区域;④涵盖正常肺组织与造影增强改变交界的区域。不适于穿刺的区域:肿瘤组织内无增强区域,肿瘤深面靠近肺门的位置。穿刺引导造影剂量1.9 mL,造影操作同前。开启超声造影模式后引导活检针穿刺肿瘤内预设靶点,留用0.5 mL造影剂作为穿刺过程中维持病灶显影,一般取材2~3条,送病理进行相关化学染色检查。7例合并少量胸水者同时抽胸水查找脱落肿瘤细胞检查。术后嘱患者平卧休息24 h,并监测血压、心率等生命体征;若有胸部不适,应摄胸片检查。


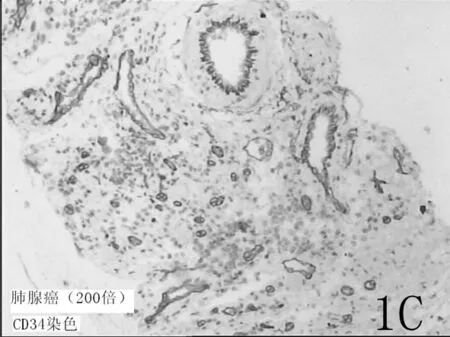
图1 肺腺癌超声造影及穿刺(1A:肺腺癌超声造影,显示为高增强改变,其内可见无增强坏死区域;1B:肺腺癌超声造影引导下穿刺增强区域,箭头标记为穿刺针;1C:穿刺标本CD34染色显示丰富的微血管。)
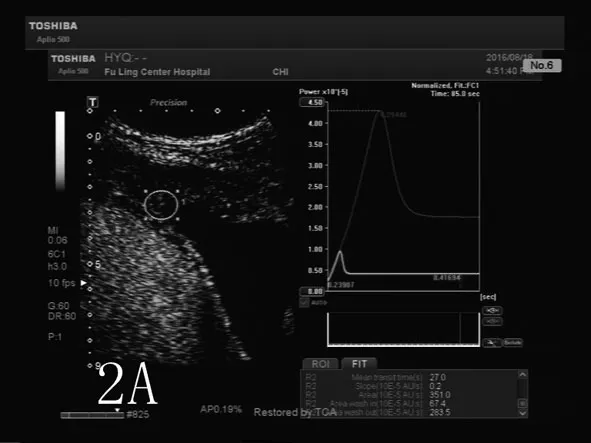
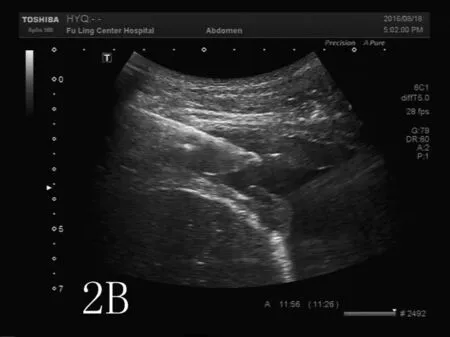
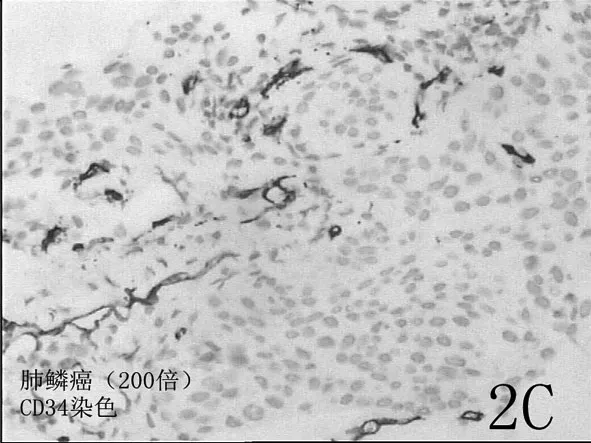
图2 肺腺癌超声造影及穿刺(2A:肺鳞癌胸壁转移灶超声造影,显示为低增强改变;2B:肺鳞癌胸壁转移灶造影引导下穿刺;2C:穿刺标本CD34染色显示稀疏分布的微血管。)
1.4 染色及分析 标本用10%甲醛固定,送病理科做蜡包埋切片,然后做相关染色封片。微血管密度(MVD)计数方法:先在低倍镜下(×100)观察整个切片,选择组织血管内皮细胞染色最多的区域,再在高倍镜(×200)下分别统计这些区域内5个视野被染成棕色的血管数,然后再将5个视野内微血管数的平均值作为MVD值。凡管腔大于8个红细胞及炎症、肉芽、坏死区和带有较厚肌层的血管均不计入总数。
1.5 统计学方法 采用SPSS 17.0统计学软件处理数据,计量资料以均数±标准差(x±s)表示,两样本均数比较采用t检验。MVD与超声造影动态参数的相关性采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 病理结果 42例患者全部一次性取材成功,其中腺癌22例(2例为黏液腺癌),中高分化鳞癌8例,低分化鳞癌6例(3例伴少量胸水,胸水中找到的肿瘤细胞形态与病理切片的肿瘤细胞相似),小细胞癌6例。24例活检确诊病例行手术治疗,术后标本病理检查与穿刺活检标本诊断相符,另18例周围型肺癌不宜手术改行放疗或加化疗。穿刺活检术后3例超声发现局部有少许气体溢出进入胸膜腔,后经胸片确诊,因患者无胸闷、气紧等不适感,嘱平卧休息后自行好转,并发症发生率7.14%(3/42)。腺癌中12例(54.55%)出现瘤体内坏死区,鳞癌中9例出现瘤体内坏死区(64.29%),小细胞癌4例(66.67%)出现瘤体坏死区。
2.2 CEUS参数分析 超声造影结果显示,腺癌峰值强度、增强指数及MVD均高于鳞癌,差异有统计学意义(P<0.05)。见表1。

表1 腺癌、鳞癌的CEUS峰值强度、增强指数及MVD比较 (x±s)
2.3 相关性分析及增强模式比较 腺癌、鳞癌的CEUS峰值强度及强度指数与其对应的MVD均呈正相关,腺癌:r峰值强度=0.754、r强度指数=0.736,鳞癌:r峰值强度=0.769、r强度指数=0.832(P均<0.05)。腺癌、鳞癌的增强分布模式均以不均匀增强为主,鳞癌占64.2%(9/14),腺癌占63.6%(12/22),小细胞癌占66.7%(4/6)。造影增强强度肺鳞癌及腺癌均以高增强为主要表现,鳞癌占64.2%(9/14),腺癌占72.7%(16/22),小细胞癌以低增强为主66.7%(4/6)。见表2。
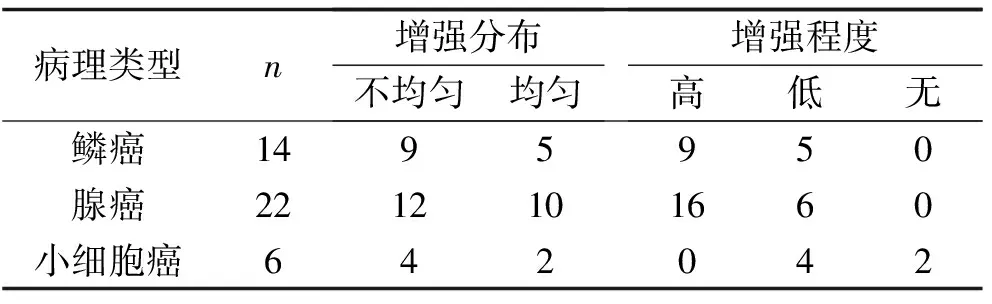
表2 增强分布模式及增强程度情况 (n)
3 讨 论
周围型肺癌约占肺癌总数的25%,因病灶处于肺段的边缘位置,纤维支气管镜受管径的影响难以达到周围的小支气管内,因此很难作出准确诊断。肺肿瘤病灶主要由源于支气管动脉的分支供血,个别有肺动脉的分支参与,肿瘤在生长过程中常因供血不足引起较高的坏死率。本研究中周围型肺肿瘤瘤体内出现坏死区域的比例较高,其中腺癌12例(54.55%)、鳞癌9例(64.29%)、小细胞癌4例(66.67%),而且瘤体越大出现坏死的几率越大。
第二代超声造影剂声诺维(SonoVue)可实时显示造影剂微泡在不张的肺和肿瘤微血管内的动态分布情况[2],在鉴别血管内和组织内造影剂能力方面优于CT,能够对二维及彩色多普勒超声无法判断的瘤体内局部出血、坏死改变提供鉴别诊断依据。根据实时超声造影在瘤体内部的分布情况指导临床进行准确穿刺活检,能够减少坏死组织的影响,达到较高的取材合格率,从而满足病理切片的需要。本组42例全部采用CEUS引导下穿刺活检,取材合格率100%。国内有学者研究发现,肺良、恶性病变增强模式均类似于“快升慢降型”,即动脉期快速进入并达峰值强度,静脉期缓慢退出[3],说明这两种增强模式无明显差异性,且该研究发现肺恶性肿瘤CEUS后主要呈不均匀高增强或低增强改变的增强模式,多数病变同时存在局灶性未增强即坏死区域。本组研究病例的CEUS造影模式与增强后造影剂分布特征与国内其他学者的研究类似,以不均匀增强及高增强为主,流入相肺动脉期造影剂迅速进入瘤体内,并迅速达峰,流出相造影剂缓慢廓清,伴有局灶性的低增强及无增强区域,考虑与恶性肿瘤内部存在迂曲新生血管、动静脉瘘、血管内血栓阻塞、组织缺血坏死有关。有文献比较肺良、恶性病变之间达峰时间(TTP)、净增强强度(NE)之间未发现有统计学差异[4-6],可能是疾病不同阶段以及肿瘤分化高低差异导致血供变化,从而影响肺良、恶性病变的增强模式改变,最终导致上述造影曲线参数无统计学差异。考虑到不同患者疾病背景的差异,如是否合并肺间质性疾病、肺动脉高压、左心功能不全以及是否长期服用外周扩血管药物等因素,单纯分析病灶与周围组织的TTP、NE等鉴别肺肿瘤的性质意义不大,尤其是当周边肺组织不张伴有实变的情况下更如此。本组研究中我们引入了分析肿瘤微血管密度的方法,结合肺腺癌、鳞癌的增强模式、达峰强度及增强指数的差异,找出二者CEUS的鉴别特点。
Folkman于1971年提出了肿瘤生长依赖血管生成学说,并于1990年进一步完善了该学说[7],其研究阐述了肿瘤生长与新生血管形成之间的依赖关系,使抗肿瘤新生血管形成的治疗成为肿瘤综合治疗的重要手段之一。微血管密度(MVD)是公认的评价肿瘤血管生成状态的客观指标,是评价肿瘤血管生成的金标准,也是判断肺癌抗血管生成治疗效果的重要指标[8],但由于血管生成在肿瘤内部与周边分布的状态不同,穿刺点的选择差异可能导致MVD检测误差[9]。因此,为了减少误差,我们在选择MVD计数的穿刺部位时统一选择高增强病灶区域进行穿刺。根据时间-强度曲线(TIC)结合病理切片的肿瘤血管计数分析表明,在同样高增强区域取样,肺腺癌的CEUS峰值强度及强度指数均高于肺鳞癌,提示肺腺癌的血管密度高于肺鳞癌,因而肺腺癌出现坏死的几率(54.55%)低于肺腺癌(64.29%)。本组病例中周围型肺癌的CEUS峰值强度及强度指数与其MVD呈正相关,且强度指数的相关性优于峰值强度,这一结果与CEUS在其他器官如前列腺、肝脏、乳腺及胃肠肿瘤的研究结果一致[10-12]。伍建林等[13]报告周围型肺癌的CT征象和CT增强幅度与其MVD有较好的相关性,但由于增强CT受射线辐射对人体损害的限制,故不能作为临床长期随访监测肿瘤MVD的手段。本研究利用免疫组织化学染色分析肺恶性肿瘤的血管密度,结果显示肺腺癌的MVD高于鳞癌,且超声造影峰值强度及强度指数可以较准确地实时反映周围型肺癌的血管生成状况。但本组病例中,由于小细胞癌数量较少,故未做相关CEUS造影参数的统计分析。
传统彩超引导下肺周围型肿瘤穿刺活检的优势在于能够实时显示病变区的血管分布区域及血供多少,可确定标本活检部位,避免了盲穿,提高了穿刺的阳性率。而超声造影引导下的穿刺活检除具有以上优点外可以进一步提高取材的精确定位,减少穿刺次数,通过对取材标本进行MVD的对比,对照分析肺腺癌与鳞癌增强模式的差别,为后续开展肿瘤的抗血管治疗的疗效评估提供组织病理学的依据。
参 考 文 献
[2] Leen E,Angerson WJ,Yarmenitis S,et al.Multi-centre clinical study evaluating the efficacy of SonoVue(BRl),a new ultrasound contrast agent in Doppler investigation of focal hepatic lesions[J].Eur J Radiol,2002,41(3):200-206.
[3] 项东英,何 文,宁 彬,等.周围型肺肿瘤超声造影的初步应用研究[J].中华超声影像学杂志,2008,17(3):243-246.
[4] 罗志艳,刘学明,闻 卿,等.超声造影对肺癌增强类型的初步研究[J].中华超声影像学杂志,2008,17(8):690-693.
[6] Caremani M,Benci A,Lapini L,et al.Contrast enhanced uhrasonography(CEUS)in peripheral lung lesions:A study of 60 cases[J].J Ultrasound,2008,11(3):89-96.
[7] Folkman J. What is the evidence that tumors are angiogensis dependent?[J]. J Natl Cancer Inst,1990,82(1):4-6.
[8] 武翠玲,王熙才,伍治平,等.口服VEGFR2 DNA 疫苗抗小鼠Lewis 肺癌血管生成的实验研究[J].中国肺癌杂志,2007,10(5):366-369.
[9] Barrett T, Brechbiel M,Bernardo M, et al. MRI of tumor angiogenesis[J].J Magn Reson Imaging,2007,26(2):235-249.
[11] 白 敏,杜联芳,顾继英.肝细胞肝癌超声造影评估血管生成的初步研究[J].中国超声医学杂志,2012,28(3):251-254.
[12] Jiang J, Chen Y, Zhu Y, et al. Contrast-enhanced ultrasonography for the detection and characterization of prostate cancer:correlation with microvessel density and gleason score[J].Clin Radiol,2011,66(8):732-737.
[13] 伍建林,李 巍,王克礼,等.周围型肺癌CT征象和动态CT增强与微血管密度关系的研究[J].中国肺癌杂志,2003,6(1):30-34.
