健脾清热活血法对萎缩性胃炎大鼠炎症通路因子的影响
2018-07-10庄昆海李海文潘静琳刘凤斌
庄昆海 李海文 刘 洪 潘静琳 刘凤斌
慢性萎缩性胃炎 (chronic atrophic gastritis,CAG)伴有中、重度肠上皮化生和(或)异型增生与胃癌的发生有密切关系,CAG伴有肠上皮化生及异型增生是胃癌前病变,在胃黏膜癌前疾病中占有重要地位[1]。
长期慢性炎症刺激可影响正常细胞的代谢和增殖,从而导致胃黏膜炎症、异型增生和癌变过程。研究发现,NF-κB是肿瘤细胞内调节炎症反应、致癌作用以及抗放射的关键分子,也是趋化因子产生的核心转录因子[2-3]。NF-κB是多条信号通路的枢纽分子,调控一系列细胞因子的表达,炎性细胞因子又可进一步诱导NF-κB持续性活化。TNF-α是重要的炎性因子,TNF-α慢性刺激可促进肿瘤细胞的生长及转移。TNF-α活化NF-κB,促进细胞增殖,由炎症向癌症转化。p50为NF-κB1,以p65/p50的二聚体形式存在,可促使NF-κB入核,激活基因转录,从而导致炎症反应的发生。
CAG属于癌前疾病,研究炎症通路中的关键因子在萎缩性胃炎癌变过程中的作用,有利于更好地明确CAG发展和转归的机理,为临床用药和治疗提供依据。
材料与方法
一、动物
选用70~80 d SPF级SD雄性大鼠94只,体重在170~200 g,由广东省动物实验中心提供(动物许可证号:SCXK[粤]2013-0002)。动物饲养于广州中医药大学实验动物中心,在室温(22±2)℃,湿度55%±5%的环境中饲养,保持昼夜节律各12 h,自由饮食和喝水。
二、实验药物
1.胃萎清颗粒剂
药物由北芪、白术、半枝莲、莪术、五指毛桃、枳壳等组成。由广东省一方制药有限公司提供,并进行质量控制(批号:J1603001),提供质量合格证明。
2.叶酸片
由江苏亚邦爱普森药业有限公司提供(批准文号:国药准字 H32023288,产品批号:1507026),规格为5 mg×100片/瓶。
3.N-甲基-N′-硝基-N′-亚硝基胍(MNNG)
由日本东京株氏会社提供,MNNG饮用液浓度为180μg/mL,装入500 mL的避光饮水瓶中自由饮用,每2天更换一次。
三、动物分组及造模给药
本研究购入94只70~80 d SPF级SD健康雄性大鼠,适应性喂养1周后,随机分为空白对照组和CAG模型组。其中空白对照组14只,CAG模型组80只。空白对照组给予正常饮食、自由饮水,直至整个实验结束。CAG模型组则予浓度为180μg/mL的MNNG饮用液自由饮用,并在此基础上采用经典的饥饱失常法复制脾虚证(即喂食1 d,而后禁食1 d,如此循环),连续造模直至第14周,随机抽取模型组中的两只CAG大鼠,进行胃黏膜病理组织学检查,结果显示两只大鼠胃黏膜病理组织学为胃黏膜固有腺体萎缩伴肠上皮化生为造模成功。
确定造模成功后开始给药,将CAG模型组随机分为5组:模型组,胃萎清高剂量组,胃萎清中剂量组,胃萎清低剂量组及叶酸组。其中模型组14只,胃萎清高、中、低剂量组及叶酸组均分别为16只,正常对照组和模型对照组给予等量生理盐水。胃萎清高、中、低剂量组于第15周开始灌胃,按照人的80 g/60 kg,平均1 333 mg/kg,大鼠给药量为1 333 mg/kg×35/6=7 776 mg/kg,此为一倍剂量。因此,测算后胃萎清高、中、低剂量组给药浓度(生药量)分别为15.6 g/kg、7.8 g/kg、3.9 g/kg。 叶酸组第 15 周开始按1.46 mg·kg-1·d-1予叶酸灌胃。灌胃容积为10 mL/kg,每日1次,连续灌胃10周。实验过程中,每2周给各组大鼠测量一次体重,以观察体重变化情况。
实验结束后所有大鼠禁食不禁水24 h,用10%的水合氯酸(3 mL/kg)腹腔注射麻醉,处死大鼠后,取全血,4℃2 000 rpm离心10 min,分离血清,-80℃保存备用。取全胃,沿大弯剪开胃壁,4℃生理盐水清洗后,取胃窦部组织,10%中性福尔马林固定,常规石蜡切片,用于相关指标的检测,其余部分胃黏膜层(剔除肌肉层)组织立即置于-80℃低温冰箱中保存,用于TNF-α、IKK、p50蛋白表达水平检测。
四、指标检测方法
1.RT-PCR法检测胃黏膜组织p50的表达
Trizol试剂盒提取总RNA。取1μg总RNA进行逆转录反应,逆转录产物取20μL进行PCR反应,同时以GADPH作为内参,通过2-△△Ct法进行结果分析。
根据指标的条件在GenBank查询,选取合适的上下游引物,进行PCR反应。
p50引物设计见表1,内参Beta actin引物设计见表2。
2.采用Western blot方法检测TNF-α、IKK和p50蛋白表达水平
五、统计方法
选用SPSS 21.0统计学软件进行数据处理。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
结 果
一、胃黏膜TNF-α蛋白表达
实验各组胃黏膜TNF-α蛋白表达水平如表3所示。单因素方差分析结果表明,6组间TNF-α蛋白表达水平差异有统计学意义(P<0.05)。组间两两比较结果显示,模型组TNF-α蛋白表达水平明显高于胃萎清高、中、低剂量组及空白组,差异均有统计学意义(P<0.05)。胃萎清高、中、低剂量组与叶酸组比较差异有统计学意义(P均<0.05)。
二、胃黏膜IKK蛋白表达
实验各组IKK蛋白表达水平见表3。单因素方差分析结果表明,6组间IKK蛋白表达水平差异有统计学意义(P<0.05)。组间两两比较结果显示,模型组IKK蛋白表达水平显著高于胃萎清高、中、低剂量组及空白组(P<0.05);胃萎清高、中、低剂量组与叶酸组比较,差异有统计学意义(P<0.05)。
Western blot显示,在胃萎清高、中剂量组IKK蛋白表达明显减少,模型组的表达明显增多;在胃萎清高、中剂量组TNF-α蛋白表达明显减少,模型组的表达明显增多(图1)。

图1 Western blot显示p50、IKK、TNF-α蛋白在各组的表达
三、胃黏膜p50蛋白表达
胃萎清高剂量组的p50蛋白表达水平与模型组相比(P<0.05),见表3。提示胃萎清高剂量组可能对p50蛋白表达水平有下调趋势。
讨 论
炎症反应是机体的主动防御机制,但长期慢性炎症刺激却是肿瘤发生发展的诱发因素之一。慢性非可控性炎症参与了肿瘤发生、发展、侵袭、转移等病理过程[4],是癌症的重要发病机制之一。当机体发生炎症反应时,免疫应答细胞能够释放炎症因子。这些因子不仅直接诱导正常细胞中的原癌和抑癌基因突变,使正常细胞发生癌变;同时它们还促进肿瘤细胞的增殖、抗凋亡、迁移、血管发生等,使癌症进一步恶化。由炎症到癌症的发展过程中,有多条炎症通路的激活,“炎-癌”链上,最基本的变化便是各种炎症因子的激活与表达水平的改变。

表1 p50引物设计

表2 内参Betaactin引物设计
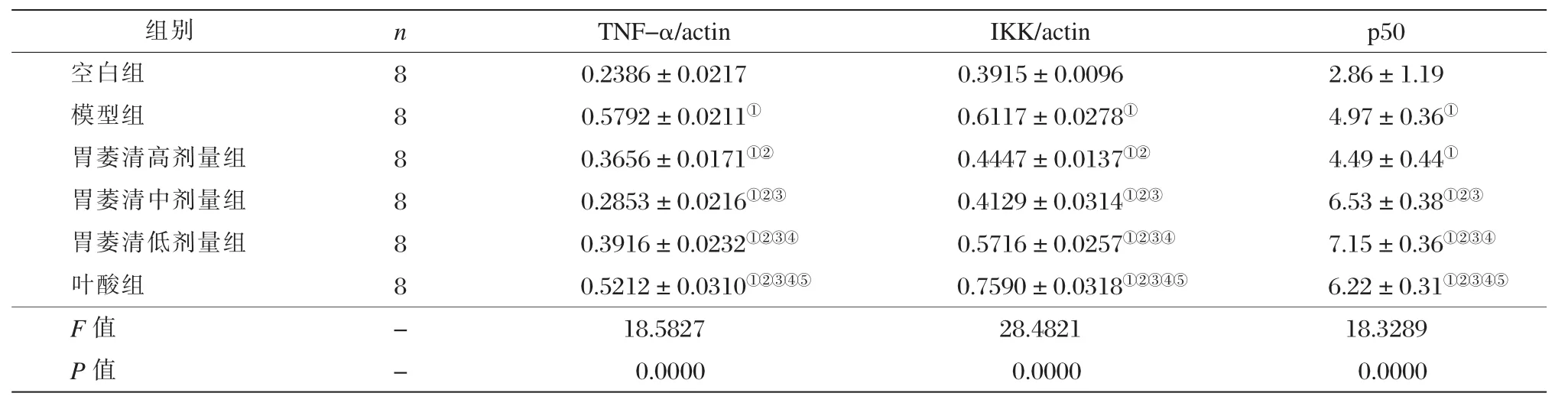
表3 各组TNF-α、IKK、p50蛋白表达水平比较 (x±s)
目前,CAG被一致认为是一种癌前疾病,研究发现TNF-α、IKK和p50在胃黏膜的萎缩、肠化生、异型增生甚至是癌变中起到关键作用,是CAG发展成胃癌的重要环节。我们的系列研究[5]结合病人所处岭南地域特点和临床特征,认为“湿、热、风、雨”为岭南主要气候特点,外邪侵袭,湿热内蕴,久之伤津耗气,人多体虚,易感外邪,复虚实夹杂,故本病病因主要与“外邪侵袭、饮食伤胃、情绪失调、体虚久病”有关,基本病机是“脾虚气滞,热郁络瘀”,并贯穿整个病程。课题组经过长期临床实践发现健脾清热活血法对CAG有一定的临床疗效,但其具体机制尚不明确。中药对CAG的干预具有一定特色与优势,既往国内相关临床研究证实中医药可在一定程度上改善腺体萎缩、抑制肠上皮化生,但仍需更多严格设计的随机双盲对照试验来验证。本研究通过观察CAG大鼠胃黏膜病理改变以及对 “炎-癌链”相关因子TNF-α、IKK及p50的变化,探讨并试求揭示健脾清热活血中药对CAG的作用机制。
本研究发现,胃萎清可在一定程度上抑制TNF-α的表达,对炎症的发生起到一定的抑制作用。这是因为,TNF-α主要由细胞、单核吞噬细胞分泌。TNF-α除了具有直接溶解肿瘤细胞活性外,亦是具有重要免疫调节功能的细胞因子,能诱导MHC抗原表达,刺激单核细胞、巨噬细胞前体细胞分化,活化多形核白细胞,具有抗体依赖性细胞介导的细胞毒效应,诱导IL-1、IL-6、IL-8等细胞因子的合成与分泌。众多的研究显示[6-7],TNF-α参与了部分胃癌的发生、发展过程。在动物实验中,肿瘤诱导剂TPA等可诱导多个器官出现TNF-α基因表达增加[8]。有研究表明[9],TNF-α可以增强胃黏膜血管的通透性与上皮细胞的反应性,促使血管出血、坏死,导致胃黏膜血供欠佳,不利于胃黏膜损伤的修复,从而加剧了胃黏膜的炎症发生和发展,造成胃黏膜损伤加重。而胃萎清通过抑制TNF-α的表达,从而间接抑制炎症的发生。
模型组IKK蛋白表达水平明显高于胃萎清高、中、低剂量组及空白组,且胃萎清高、中、低剂量组IKK的表达水平与空白组相当,提示胃萎清能在一定程度上能抑制炎症因子的表达,从而阻断炎症的发生发展过程。这主要是因为,IKK能参与由细胞因子引起的细胞内免疫反应。IKK的激活使IκB被磷酸化,IκB从NF-κB上脱落并被泛素化,使得NF-κB由抑制状态被激活,活化的NF-κB转移至细胞核中从而介导一系列的炎症反应。而胃萎清通过抑制TNF-α的表达,从而抑制炎症的发生。胃萎清高剂量组的p50蛋白表达水平与模型组相比,提示胃萎清高剂量组对p50蛋白表达水平有下调趋势。而p50为NF-κB1,可促使NF-κB入核,激活基因转录,从而导致炎症反应,据此推测较高剂量的胃萎清可能通过抑制炎症反应发挥其药理学作用。
此外,本研究还提示,胃萎清中、低剂量组较模型组无明显下降趋势,可能与药物浓度有关,或与通路因子的交叉对话有关,仍需要课题组下一步加大样本量后进行更多、更有益、更深入的研究及探讨。综上所述,可以初步认为在蛋白表达水平层面,胃萎清能使NF-κB炎症通路的致炎因子TNF-α、IKK、p50的表达水平下降从而控制CAG的发展,但其机制及量效关系有待进一步研究印证。
[1]罗红,黄贵华,林华胜,等.PTEN、Bcl-2与慢性萎缩性胃炎相关性研究进展[J].湖南中医杂志,2015,31(11):181-183.
[2]张祖凯,王阁.NF-κB在肿瘤放疗中的分子机制[J].重庆医学,2014,43(26):3533-3535.
[3]安康.TGEV感染PK-15细胞的蛋白质组学及诱导炎症反应的分子机制[D].华中农业大学,2015.
[4]张桂贤,刘洪斌,刘大卫.非可控性炎症与肿瘤相关性研究[J].中国中西医结合外科杂志,2015,21(2):197-201.
[5]侯政昆,刘凤斌,李培武,等.刘凤斌教授治疗慢性萎缩性胃炎的病例系列挖掘分析和经验总结[J].中国中药杂志,2015,40(11):2227-2234.
[6]张德忠,江伟春,刘泽洪,等.肿瘤坏死因子α-308基因多态性与胃癌患者血清胃蛋白酶原的关系[J].中华临床实验室管理电子杂志,2015,3(4):249-252.
[7]操珍,孙俊宁,王菀菀,等.液相芯片技术检测胃癌血清细胞因子的临床意义[J].肿瘤防治研究,2016,43(10):870-875.
[8]周娟,张梦军,郭嘉伟,等.TPA致小鼠耳肿胀模型的中性粒细胞聚集及 IL-1β、IL-6、TNF-α、IL-17A 的表达水平研究[J].免疫学杂志,2012,28(10):872-876.
[9]杨牧祥,苏凤哲,于文涛,等.胃炎饮对实验性胆汁反流性胃炎大鼠胃黏膜TNF-α、IL-8含量的影响[J].中国中医基础医学杂志,2009,15(10):738-740.
