富硒酵母的分离鉴定及富硒条件的优化
2018-07-09高飞飞史学伟
蔡 飞,高飞飞,王 斌,史学伟,肖 婧*
(1.武威职业学院,甘肃 武威 733000;2.石河子大学 食品学院,新疆 石河子 832000;3.石河子大学 信息科学与技术学院,新疆 石河子 832000)
硒作为人体必需的微量元素,具有抗癌、抗氧化、增强人体免疫力等重要的生理功能及广泛的药理作用[1]。1817年,硒元素被发现是人体生命不可缺少的微量元素之一[2]。在此之前,硒元素被认为是种有毒有害物质。1957年,SCHARTZ K等[3]应用硒元素成功治疗动物肝坏死疾病。1973年,世界卫生组织(world health organization,WHO)正式宣布:硒是人体生理必需的微量元素[4]。从此,硒元素逐渐的被认为是人和动物不可或缺的微量元素之一,成为了科学研究中的热门元素,被称之为“抗癌之王”、“心脏守护神”[5-6]。人体摄入硒的途径有食物、水、空气,而通过食物摄入是主要的途径。然而,将无机硒直接添加于食品对人体有毒副作用,天然食品中硒含量普遍较低,仅靠天然食物中的硒并不能满足人体的正常需要。研究表明,在富硒的环境中,硒元素能够与酵母菌体内的蛋白质或多糖有机结合,形成硒蛋白或硒多糖,大大降低无机硒的毒副作用[7]。研究表明[8-9],富硒酵母是最安全、最有效、最能维持营养平衡的补硒方式,目前,国外报道的富硒酵母中硒含量高达1 400 μg/g,国内报道的富硒酵母一般是将普通的酿酒酵母或稍做筛选的酵母在添加有适量亚硒酸钠的发酵培养基中,于一定的培养条件下获得,细胞含硒量在300~1 200 μg/g。本研究采用平板复筛法筛选高富硒量的酵母菌,对其进行形态学观察及分子生物学鉴定,并采用单因素及正交试验优化其富硒条件,对开发新富硒产品,解决人体硒元素缺乏问题具有重要的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
60株酵母菌:石河子大学食品学院发酵实验室保藏菌株。
1.1.2 试剂
葡萄糖、酵母浸粉、琼脂粉、蛋白胨、丙三醇、脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker、ddH2O:北京奥博星生物技术有限责任公司;亚硒酸钠、甲酸、硝酸、高氯酸、乙二胺四乙酸二钠(ethylenediaminetetraaceticacid-2Na,EDTA-2Na)、EasyTaqSuper Mix:天津市致远化学试剂有限公司;Gold view核酸染料:北京全式金生物技术有限公司。以上试剂均为分析纯或生化试剂。
1.1.3 培养基
酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YEPD):20 g葡萄糖,20 g蛋白胨,10 g酵母浸粉,1 L蒸馏水,自然pH,121℃高压灭菌20 min。
酵母浸出粉胨葡萄糖琼脂培养基:20 g葡萄糖,20 g蛋白胨,10 g酵母浸粉,20 g琼脂,1 L蒸馏水,自然pH,121 ℃高压灭菌20 min。
富硒培养基[10]:20g葡萄糖,20g蛋白胨,10 g酵母浸粉,10mg亚硒酸钠,1L蒸馏水,自然pH,121℃高压灭菌20min。
1.2 仪器与设备
5810R高速冷冻离心机:德国Eppendorf仪器公司;TC-512聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:英国Techne公司;Power Pac Universal电泳仪、Gel DOC XR凝胶成像系统:美国Bio Rad公司;CX21FS1光学显微镜:日本Olympus公司;LAC-5040S全自动高压灭菌锅:浙江新丰医疗器械有限公司;Bnp-9272智能生化培养箱、722紫外分光光度计:上海精宏试验设备有限公司;LGJ-10冷冻干燥机:北京松源华兴科技发展有限公司。
1.3 方法
1.3.1 菌种活化
将60株酵母菌分别接入100 mL YEPD培养基中,置于28℃恒温培养箱中,培养24~48 h。
1.3.2 菌株的分离纯化
将活化菌液稀释成10-1、10-2、10-3、10-4浓度梯度,分别吸取200 μL涂布于富硒培养基,每个浓度做3个平行涂布,置于28℃恒温培养箱中培养24~48 h。经3次划线纯化得到单菌落,置于-20℃冰箱中保藏备用。
1.3.3 酵母菌的形态特征分类
依据《酵母菌的特征与鉴定手册》[11]以及《微生物学》[12]对酵母菌株进行分类鉴定。
1.3.4 酵母菌株分子生物学鉴定
(1)DNA的提取[13]
向无菌EP管加入TE缓冲溶液50μL。吸取1mL液体培养物,加入EP管,混匀后,TE缓冲液洗涤3次,12000r/min离心5min。加入200μLTE缓冲液,稍振动后,加入15mL溶菌酶。混匀后,37℃水浴10min。加入30μL、体积分数为10%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液,37℃水浴30 min。加入100 μL 5 mol/L NaOH溶液,80 μL、体积分数为2%的十六烷基三甲基溴化铵(hexadyltrimethyl ammomum bromide,CATB)溶液。混匀后65℃水浴10 min。依次加入250 μL苯酚、750 μL氯仿-异戊醇(24∶1,V/V)混合液,离心,取上清液,继续依次加入250 μL苯酚及250 μL氯仿-异戊醇(24∶1,V/V)混合液进行抽提,离心10 min。重复2~3次。取上清液,加入20 μL 0.1倍体积的醋酸钠后,加入相同体积的无水乙醇,封口,然后将EP管放置于4℃冰箱4~6 h,备用。收集DNA:用体积分数为70%乙醇溶液洗涤,离心,抽干,加50 μL无菌水,溶解后于-20℃保藏备用。
(2)PCR扩增[14]
PCR扩增上游引物ITS1:5'-TCCGTAGGTGAACCTGCGG-3',下游引物ITS4:5'-TCCTCCGCTTATTGATATGC-3'。
PCR反应体系总体积为50 μL,每管中加入25 μL Easy TaqSuper Mix,引物各2mL,模板DNA 2μL,双蒸水19 μL,并做空白对照。
PCR反应条件:94℃预变性3 min;94℃变性45 s,55℃退火60 s,72℃延伸60 s,循环35次;最后72℃延伸10 min。取2μLPCR产物于1.0%琼脂糖凝胶(含0.5μg/mLGoldview核酸染料),110 V电压下电泳30 min,在凝胶成像仪中观察结果。
(3)系统发育树的构建
测序结果在美国国家生物技术信息中心(nationalcenter for biotechnology information,NCBI)BLAST中进行同源序列比对,根据比对的结果,选取相似性99%以上菌种的ITS区DNA序列,连同测序菌株的序列用Claustal X1.83软件进行多序列比对,采用MEGA 6.0软件中的邻近法(neighborjoining,NJ)进行系统发育树的构建,并用Bootstrap对进化树进行1 000次置信度分析。
1.3.5 酵母菌的富硒能力分析
(1)菌株的活化
将已经鉴定完成的菌株,接种于YEPD液体培养基,在28℃恒温培养箱中培养48 h。
(2)菌株的扩大培养
将新鲜菌液按10%的接种量再次接于YEPD液体培养基中,在28℃恒温培养箱中培养24 h,以保证菌体稳定在对数期,以便后续研究中保持菌株稳定的活性。
(3)不同硒浓度中菌株生长曲线绘制
将新鲜菌液按4%接种量接种于亚硒酸钠含量分别为140 μg/mL、160 μg/mL、180 μg/mL、200 μg/mL的5 mL的YEPD液体培养基中,每个浓度梯度3个平行,29℃摇床培养,每隔4 h取样1 μL,置于比色皿中,以空白培养基为对照,在波长600 nm的条件下测定OD600nm值。
(4)酵母菌生物量的测定[15]
酵母培养液于3 500 r/min离心10 min,弃上清液,用蒸馏水洗涤菌体3次,再次离心,65℃烘干即得酵母菌体,称质量,得到菌体生物量(g/L)。
(5)酵母菌总硒含量的测定[16]
取5 mL种子液接种于装有200 mL YEPD液体培养基中,30℃、180r/min振荡培养24h,然后4000r/min离心5min,无菌生理盐水洗涤3次,-80℃预冻12 h,冷冻干燥。
取0.10g冻干酵母样品于消化瓶中,加入少量纯水湿润样品,然后加入12 mL体积分数为65%的硝酸、3 mL体积分数为70%的高氯酸于电炉上冷凝回流消化至无色,将消化完的样品移入烧杯中,并用少量水洗消化瓶,冲洗液一并移入烧杯中,加5%EDTA-2Na 2 mL,用40%NaOH调至中性,然后定容至100mL,以无菌水代替酵母样品作为空白对照。
硒标准曲线的制作:分别量取0、2mL、4mL、6mL、8mL、10 mL,10 mg/L亚硒酸钠溶液于分液漏斗中,加入2~3 mL纯水和5%EDTA-2Na 1mL,用5%NaOH调pH至中性,然后加入2 mol/L甲醛1 mL,加纯水至35 mL,各加0.5%3,3-二氨基联苯按盐酸盐5 mL,摇均,暗处反应30 min,用5%NaOH调pH 6.5~7.0,加入甲苯10 mL,振荡萃取1 min,静置分层后,取甲苯层,在波长420 nm条件下比色,以甲苯为空白,以总硒含量(x)为横坐标,吸光度值(y)为纵坐标绘制硒标准曲线。
样品中总硒含量的测定:准确称取0.100 0酵母粉置于烧杯中,加入5 mL混合消化液(浓硝酸与高氯酸,体积比4∶1),盖上培养皿,消化至样液呈无色透明为止,用水定容至50 mL。取该溶液10 mL作为样液,测定方法同标样,总硒含量的计算公式如下:

式中:X为样品中总硒含量,μg/g;C为从标准曲线得到的硒含量,μg/L;V为样品消解时定容的体积,L;m为样品的质量,g。
1.3.6 富硒发酵条件单因素试验
接种量对菌体发酵产硒的影响:分别以4%、6%、8%、10%、12%接种量接种到富硒培养基,30℃、200 r/min摇床振荡培养8 h,考察不同接种量对菌株富硒能力的影响。
碳源浓度对菌体富硒能力的影响:按10%的接种量接种于发酵培养基,分别取葡萄糖添加量为1.6%、1.8%、2.0%、2.2%、2.4%,菌株在28℃、200 r/min摇床振荡培养8 h,考察不同葡萄糖添加量对菌株富硒能力的影响。
氮源浓度对菌体富硒的影响:按10%的接种量接种于发酵培养基,分别取蛋白胨添加量为1.6%、1.8%、2.0%、2.2%、2.4%。在28℃、200 r/min摇床振荡培养8 h,考察不同蛋白胨添加量对菌株富硒能力的影响。
1.3.7 富硒发酵条件优化正交试验
根据单因素试验结果,以发酵液中酵母菌生物量和总硒含量作为评价指标,选取接种量(A)、葡萄糖添加量(B)、蛋白胨添加量(C)为主要影响因素,优化富硒发酵条件,正交试验因素与水平见表1。
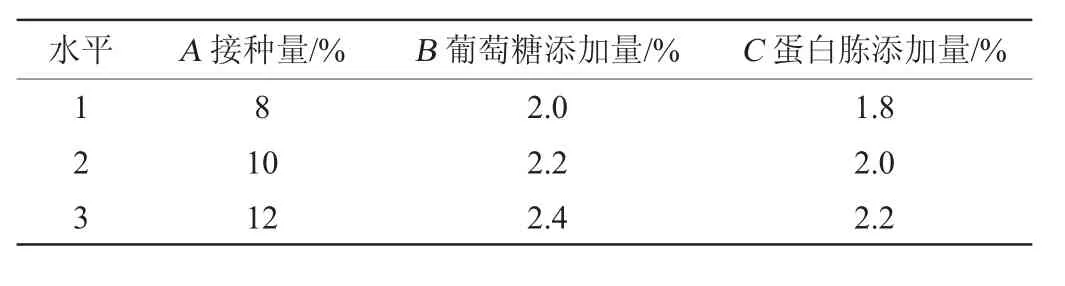
表1 富硒发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for seleniumenriched fermentation conditions optimization
1.3.8 数据处理与分析
采用Origin8.0数据分析软件进行单因素分析,用SPSS数据分析软件进行正交分析。
2 结果与分析
2.1 酵母菌的筛选
将实验室保藏的60株酵母菌经过富硒平板培养基的初步筛选,得到4株富硒酵母菌,命名为菌株Z4、Z5、Z7、Z9。
2.2 酵母菌的形态观察
菌落形态结果见图1。由图1可知,菌株Z4、Z5、Z9菌落形态较大,呈圆形,饱满,白色,表面粗糙,边缘整齐,易挑起;菌株Z7菌落形态较大,呈圆形,白色,中间凸起,表面粗糙,边缘整齐,易挑起。
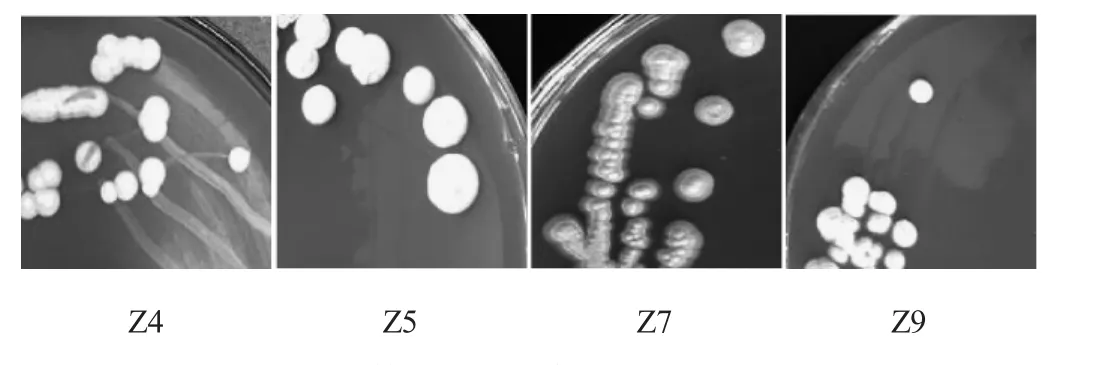
图1 菌株在富硒培养基上的菌落形态Fig.1 Colony morphology of strains on selenium-enriched medium
2.3 酵母菌的分子生物学鉴定
(1)富硒酵母菌ITS区rDNAPCR扩增产物的电泳检测结果
对4株富硒酵母(Z4、Z5、Z7、Z9)的DNA进行ITS区PCR扩增,扩增产物经1.0%琼脂糖凝胶电泳检测,结果见图2。由图2可知,其中每个菌株具有单一条带,且条带较亮,长度在500 bp左右,故符合测序要求,扩增产物在华大基因测序公司进行测序。
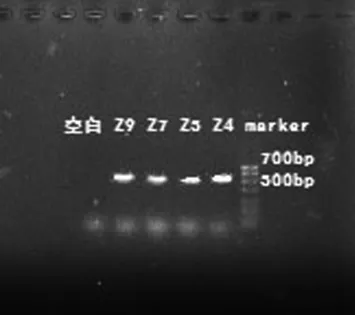
图2 ITS rDNA PCR扩增产物电泳图Fig.2 Electrophoresis of ITS rDNA PCR amplification products
(2)菌株的进化树分析
将4株富硒酵母菌(Z4、Z5、Z7、Z9)ITS区DNA测序结果置于NCBI库中进行序列比对,利用MEGA 6.0软件构建菌株的系统发育树,结果见图3。

图3 菌株的系统发育树Fig.3 Phylogenetic tree of strains
由图3可知,菌株Z4、Z5、Z7、Z9和库德毕赤酵母(Pichia kudriavzevii)亲缘关系最近,且分枝置信度是99%,故菌株Z4、Z5、Z7、Z9被初步鉴定为库德毕赤酵母(Pichia kudriavzevii)。
2.4 酵母菌的富硒能力分析
2.4.1 富硒菌株的生长曲线
取菌株Z4、Z5、Z7、Z9的活化菌液,按4%接种量接种于亚硒酸钠含量分别为140 μg/mL、160 μg/mL、180 μg/mL、200 μg/mL的YEPD液体培养基中,在600 nm的波长条件下测定OD600nm值,绘制菌株Z4、Z5、Z7、Z9的生长曲线,结果见图4。
由图4可知,菌株Z4、Z5、Z7、Z9在不同硒浓度中的生长情况基本一致,在0~8 h处于对数生长期,而在8 h时进入稳定期。菌株Z4、Z5、Z7、Z9最大耐硒质量浓度分别为180 μg/mL、200 μg/mL、140 μg/mL及160 μg/mL。结果表明,与其他菌株相比,菌株Z5具有最强的耐硒性,因此,选取菌株Z5作进一步富硒研究。

图4 菌株Z4(A),Z5(B),Z7(C)和Z9(D)的生长曲线Fig.4 Growth curves of strains Z4(A),Z5(B),Z7(C)and Z9(D)
2.4.2 硒标准曲线的绘制
以总硒含量(x)为横坐标,吸光度值(y)为纵坐标绘制硒标准曲线,结果见图5。
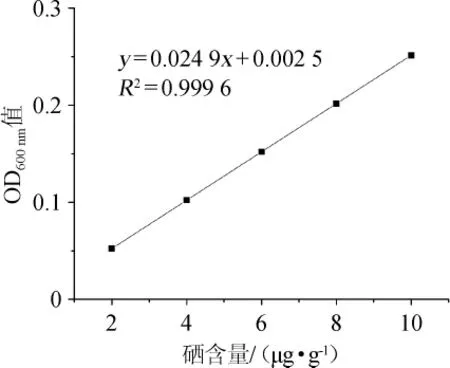
图5 硒标准曲线Fig.5 Standard curve of selenium
由图5可知,硒标准曲线回归方程为y=0.0249x+0.0025,相关系数R2为0.999 6,表明二者线性关系良好。
2.5 菌株Z5富硒发酵条件优化单因素试验
2.5.1 不同接种量对菌株Z5富硒能力的影响

图6 不同接种量对Z5菌株富硒能力的影响Fig.6 Effect of different inoculum on selenium-enriched capacity of strain Z5
由图6可知,随着接种量的增加,由于发酵液中有限的营养成分,酵母菌种内竞争加剧,使得菌株Z5的富硒量和生物量均呈现先增加后减少的变化趋势。当接种量在4%~10%时,硒含量及生物量随接种量增加而增大;当接种量为10%时,富硒能力达到最大值,此时生物量约为9.6g/L,总硒含量将近870 μg/g;当接种量>10%之后,总硒含量及生物量有所下降。因此,确定最佳接种量为10%。
2.5.2 不同葡萄糖添加量对菌株Z5富硒能力的影响
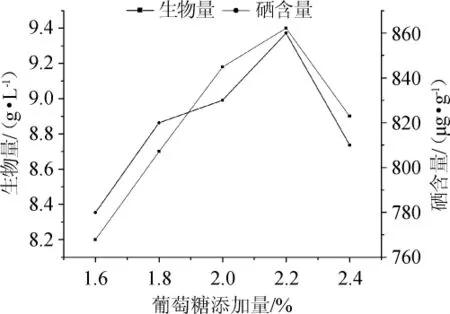
图7 不同葡萄糖添加量对菌株Z5富硒能力的影响Fig.7 Effect of different glucose addition on selenium-enriched capacity of strain Z5
由图7可知,随着葡萄糖添加量的增加发酵液中酵母菌快速繁殖,种内对养分和空间的竞争加剧,菌株Z5的硒含量和生物量同样呈现先增加后减少的变化趋势。当葡萄糖添加量为1.6%~2.2%时,硒含量及生物量随葡萄糖添加量增加而增大;当葡萄糖添加量为2.2%时,富硒能力达到最大值,此时硒含量达到860 μg/g,生物量达到9.4 g/L;当葡萄糖添加量>2.2%之后,硒含量及生物量有所下降。因此,确定最佳葡萄糖添加量为2.2%。
2.5.3 不同蛋白胨添加量对菌株Z5富硒能力的影响
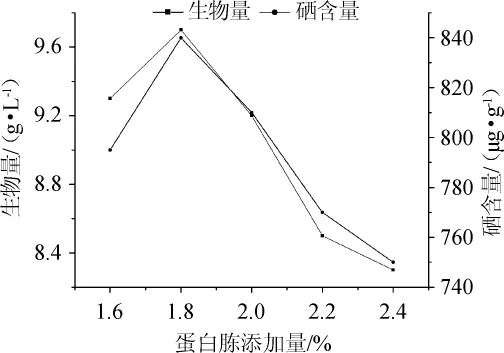
图8 不同蛋白胨添加量对Z5菌株富硒能力的影响Fig.8 Effects of different peptone addition on selenium-enriched capacity of strain Z5
由图8可知,随着蛋白胨添加量的增加,引起发酵液中酵母菌快速繁殖,种内对养分和空间的竞争加剧,Z5菌株的富硒量和生物量呈现先增加后减少的变化趋势。当蛋白胨添加量为1.6%~1.8%时,硒含量及生物量随蛋白胨添加量增加而增大;当蛋白胨添加量为1.8%时,富硒能力达到最大值,此时的硒含量达到840μg/g,生物量达到9.7 g/L;当蛋白胨添加量>1.8%之后,硒含量及生物量有所下降。因此,确定最佳蛋白胨添加量为1.8%。
2.6 菌株Z5富硒能力优化正交试验
根据单因素试验结果,以酵母总硒含量作为评价指标,选择3因素3水平对菌株Z5的富硒发酵条件进行优化,正交试验结果与分析见表2。

表2 富硒发酵条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for selenium-enriched fermentation conditions optimization
由表2可知,对菌株Z5富硒能力的影响主次顺序为C>B>A,即蛋白胨添加量>葡萄糖添加量>接种量,得到菌株Z5最佳富硒发酵条件为A2B3C1,即接种量10%,葡萄糖2.4%,蛋白胨1.8%,在此最佳条件下进行3次验证试验,总硒含量为862 μg/g,生物量为9.63 g/L。
3 结论
选取实验室保藏的酵母菌为研究对象,通过筛选、纯化,得到4株富硒酵母菌。采用形态观察、现代分子生物学鉴定方法,将菌株Z4、Z5、Z7、Z9初步鉴定为库德毕赤酵母(Pichia kudriavzevii)。对菌株Z4、Z5、Z7、Z9进行硒耐受性分析,发现菌株Z5具有最强耐硒性,耐硒质量浓度可达200 μg/mL。通过单因素及正交试验对最适富硒发酵条件进行优化,得出菌株Z5的最佳富硒条件为接种量10%,葡萄糖2.4%,蛋白胨1.8%。在此优化条件下,总硒含量可达到862 μg/g,生物量为9.63 g/L。本研究对富硒酵母菌种的开发提供了一定的理论依据。
[1]杨善岩,李海龙,狄志鸿.硒元素生理功能及微生物富硒发酵研究现状[J].食品工业,2013,34(6):167-170.
[2]YANG L S,WANG W Y,HOU S F,et al.Effects of selenium supplementation on arsenism:an intervention trial in Inner Mongolia[J].Environ Geochem Health,2004,24(4):359-374.
[3]SCHARTZ K,FOLTZ C M.Selenium as an intergral part of factor 3 againstdietarynecroticliverdegeneration[J].Am Chem Soc,2007,79(6):3292-3293.
[4]CASALONE E,DI ILIO C,FEDERICI G,et al.Glutathione and glutathione metabolizing enzymes in yeasts[J].Anton Leeuw,2004,54(4):367-375.
[5]史丽英.人体必需微量元素——硒[J].微量元素与健康研究,2005,22(4):61-63.
[6]迟淑艳,张伟力.微量元素硒与碘的生物学功能研究进展[J].饲料博览,2003,15(3):5-7.
[7]周 琼,赵 松.富硒酵母中有机硒含量测量方法的探究[J].广州化工,2017,45(21):121-123.
[8]肖方正,刘曲滨.富硒酵母的研究开发与应用[J].广东微量元素科学,2001,8(8):7-9.
[9]刘 杰,徐 林,吴根福.富硒酵母的研究进展[J].饲料工业,2009,30(22):44-47.
[10]苗 君.酿酒酵母在极端条件下耐受性的研究[D].大连:大连工业大学,2009.
[11]巴尼特.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:3-10.
[12]BAKER S,NICKLIA J,KHAN N,et al.Microbiology[M].Beijing:Science Press,2013.
[13]ANDORRA I,ESTEVE-ZARZOSO B,GUILLAMON J M.Determination of viable wine yeast using DNA binding dyes and quantitative PCR[J].Int J Food Microbiol,2010,144(2):257-262.
[14]DE JONG J V,MCLEOD J C,STEEL M,et al.Neighbourhoods of phylogenetic trees:exact and asymptotic counts[J].SIAM J Discrete Math,2016,30(4):2265-2287.
[15]贺 莹,赵建英,母焱楠.响应面法优化富硒酵母的营养条件优化[J].食品工业,2017,38(12):30-34.
[16]孙平平.富硒酵母的选育、发酵条件优化及其应用研究[D].芜湖:安徽工程大学,2011.
