丁酸梭菌优良菌株LXYB-2抑菌活性及抗逆性研究
2018-07-09谢丽静王伟华王海宽张仁文
谢丽静,王 丽,王伟华,王海宽,张仁文*
(1.湖北绿雪生物科技有限公司,湖北 咸宁 437000;2.塔里木大学 生命科学学院,新疆 阿拉尔 843300;3.天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室,天津 300457)
丁酸梭菌(Clostridium butyricum)属于厌氧革兰氏阳性菌,电子显微镜下观察其菌体形态呈直或略有弯曲的杆状,单个或成对,部分呈丝状,短链,白色略带灰感,细菌直径为(0.6~1.4)×(2.7~7.3)μm,菌体中间略饱满,两端呈钝圆形,周身有鞭毛,具运动性[1]。研究表明丁酸梭菌作为益生菌制剂中的一种,又称活菌制剂[2],不仅具有抑制肠道有害菌群的生长作用,同时能够促进有益菌群的增殖[3];其作用机理可归结为丁酸梭菌益生菌产生的非特异性短链脂肪酸和过氧化物以及其代谢产生的特异性的细菌素,能够抑制或杀死潜在的致病菌[4]。
丁酸梭菌是我国在2009年由农业部批准允许在饲料中添加的活菌制剂之一。微生态制剂是否能作为饲料添加剂应用于养殖业,不仅需要考察菌株的发酵水平、产益生物质的能力,同时还需要考察菌株抗逆性,如在动物胃肠道环境中生存能力,耐受饲料加工过程中的高温环境等。丁酸梭菌作为一种梭状芽孢杆菌,具有一定耐高温、耐动物胃肠道环境的能力,但是这些特性在不同菌株之间存在较大的差异。贾丽楠等[5]对丁酸梭菌85℃高温处理2.5 min、5.0min、7.5min后,其存活率分别为70.43%、52.69%、46.35%。刘磊等[6]将丁酸梭菌CBM01在人工胃液和人工肠液中作用3 h后,丁酸梭菌CBM01存活率分别为90.33%和92.09%,同时发现菌株CBM01可耐受的最高胆盐浓度为0.40%。王腾浩等[7]对一株丁酸梭菌ZJU-F1抗逆性和体外益生效果进行了研究,发现该菌株对人工胃液、肠液及胆碱都具有很好的耐受性,pH值为2的人工胃液处理对其几乎没有影响,然后再用人工肠液处理2 h,活菌数没有明显变化;该菌株能够在0.35%的胆盐条件下生长。体外抑菌活性比较也是考察菌株产抑菌活性物质能力的一种方法,一般认为在同样的环境条件下,对动物体内常见病原菌抑菌活性较强的菌株其产抑菌活性物质能力更强,因此需要比较不同菌株对肠道常见致病菌抑制效果,来进一步评价优良菌株的应用潜力。曹广添等[8]研究发现,将丁酸梭菌分别与大肠杆菌、沙门菌、产气荚膜梭菌、乳酸杆菌和双歧杆菌按不同的比例混合后进行培养,培养时间36~48 h,结果表明,丁酸梭菌对大肠杆菌、沙门菌和产气荚膜梭菌的增殖有明显抑制作用。
目前国内外对丁酸梭菌抗逆性的研究主要集中对自然选育得到的菌株抗逆性研究,而对突变菌株的抗逆性研究鲜有报道。本研究以一株通过常压室温等离子体(atmospheric and room temperature plasm,ARTP)诱变筛选到的优良菌株LXYB-2为研究对象,比较了优良菌株LXYB-2与起始菌株LXKJ-1的抑菌能力及高温、人工胃液、人工肠液、胆碱的耐受性,以确定优良菌株LXYB-2的应用潜力,为进一步的筛选和挖掘益生菌的应用潜力提供了参考。
1 材料与方法
1.1 材料和试剂
1.1.1 菌株来源
丁酸梭菌(Clostridium butyricum)LXKJ-1为出发菌株(菌株保藏号为CCTCCM201613):由湖北绿雪生物有限公司研发中心提供;丁酸梭菌优良菌株LXYB-2是本实验室以LXKJ-1作为出发菌株,通过ARTP诱变处理,经初筛、复筛、遗传稳定性试验,得到一株耐丁酸、遗传稳定性好、发酵水平高的突变优良菌株。
靶标菌:大肠埃希氏菌(Escherichiacol)iCMCC(B)44103,金黄色葡萄球菌(Staphylococcus aureus)MASA,表皮葡萄球菌(S.epidermidis)CMCC26069,宋内志贺氏菌(Shigella sonnei)CMCC(B)51592,单核细胞增生李斯特菌(Listeria monocytogenes)ATCC19114,伤寒沙门氏菌(Salmonella typhi)CMCC(B)50071,鼠伤寒沙门氏菌(S.typhimurium)ATCC14028,肠炎沙门氏菌(S.enteritidis)CMCC(B)50335,福氏志贺氏菌(S.flexneri)CMCC(B)51572:广东环凯微生物科技有限公司。
1.1.2 培养基
强化梭菌培养基(reinforced clostridial medium,RCM)、LB琼脂培养基、胰蛋白胨大豆琼脂(tryptic soy agar,TSA)培养基:海博生物技术有限公司。
斜面培养基:酵母浸膏0.5%,胰蛋白胨0.5%、葡萄糖0.1%、磷酸氢二钾0.1%,琼脂粉1.5%,pH值7.0。
种子培养基:RCM液体培养基。
液体发酵培养基:蛋白胨10.0 g,牛肉粉10.0 g,酵母粉3.0 g,葡萄糖5.0 g,可溶性淀粉1.0 g,L-半胱氨酸盐粉3.0 g,磷酸氢二钾 0.05 g,硫酸镁0.08 g,硫酸锰0.002 g,纯化水1 000 mL,pH 7.0。
活菌计数培养基:胰蛋白胨1.0 g,大豆蛋白胨0.5 g,酵母浸粉0.3 g,蛋白胨1 g,氯化钠0.3 g,硫代乙醇酸钠0.03 g,L-半胱氨酸盐酸盐0.03 g,磷酸氢二钾0.25 g,葡萄糖1.0 g,琼脂粉2.0 g,pH 6.5。
以上培养基制备完成后均需高压灭菌备用,灭菌温度121℃,灭菌时间20min。
1.1.3 化学试剂
胰蛋白胨、琼脂粉、酵母浸膏(均为生化试剂):北京奥博星生物技术有限责任公司;玉米粉:河南振兴生物技术有限公司;葡萄糖、硫酸铵、尿素、磷酸氢二钾(均为分析纯):天津市致远化学试剂有限公司;猪胆盐(纯度>98%):成都市科龙化工试剂厂。
1.2 仪器与设备
GL-16A高速冷冻离心机:湖南凯达科学仪器有限公司;XSP-24N生物显微镜:南京江南永新光学有限公司;MD-0.6型脉动真空灭菌柜:张家港市欧思瑞科技有限公司;M2204电子天平:梅特勒-托利多仪器(上海)有限公司;FS-CJ-2F垂直送风超净工作台:苏州冯氏实验动物设备有限公司;BMJ-250C培养箱:上海博迅实业有限公司。
1.3 试验方法
1.3.1 优良菌株LXYB-2与初始菌株LXKJ-1的抑菌活性比较
(1)丁酸梭菌发酵液的制备
将甘油管保藏的菌株LXYB-2与出发菌株LXKJ-1分别取0.1mL接种到10mL液体RCM培养基中,厌氧培养18h,备用。
将活化的突变优良菌株LXYB-2与出发菌株LXKJ-1分别接种于种子液培养基,厌氧培养24 h,再按5%接种量接种于发酵培养基,37℃厌氧培养48 h,14 000 r/min离心5 min,收集上清液,经0.2 μm滤膜过滤除菌后备用。
(2)靶标菌的制备
将大肠埃希氏菌CMCC(B)44103、肠炎沙门氏菌CMCC(B)50335、鼠伤寒沙门氏菌ATCC14028、伤寒沙门氏菌CMCC(B)50071划线接种于LB固体培养基上37℃培养24h,依次用无菌生理盐水洗脱菌体,制备菌悬液,并将菌悬液的菌浓度稀释为106CFU/mL,备用。
将金黄色葡萄球菌MASA、宋内志贺氏菌CMCC(B)51592,单核细胞增生李斯特菌ATCC19114、福氏志贺氏菌CMCC(B)51572和表皮葡萄球菌CMCC26069依次接种于TSA固体培养基上,于37℃条件下培养24 h,依次用生理盐水洗脱,制备菌浓度为106CFU/mL左右的菌悬液后,备用。
(3)靶标菌平板制备
采用双层平板法制备靶标菌平板。取15 mL培养基加入到培养皿,凝固后作为下层;取5 mL含2%不同靶标菌菌悬液的培养基加入凝固后的下层培养基上作为上层,待用。
(4)抑菌能力测定
采用牛津杯法测定抑菌活性。将牛津杯垂直放在制备好的不同靶标菌平板上,使其与培养基表面无空隙后,在牛津杯中加入240 μL丁酸梭菌发酵上清液,于37℃条件下培养16~18 h,观察并测量抑菌圈直径。每组测定两个重复。抑菌圈越大,表明抑菌活性越强[9-11]。
1.3.2 优良菌株LXYB-2与初始菌株LXKJ-1的抗逆性比较
(1)丁酸梭菌样品菌液的制备
将活化菌株LXKJ-1与LXYB-2分别接种至种子培养基中,37℃厌氧培养24 h后,按5%接种量接种至发酵培养基,37℃厌氧培养48 h,发酵培养结束后,3 000 r/min离心10 min,收集菌体,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤两次后重悬,使菌体浓度为5.0×108CFU/mL,备用。
(2)耐热性试验
取上述菌液样品1mL到含9mL甘油溶液(80%甘油)的试管中,漩涡振荡充分混匀后,分别置于60℃、70℃、80℃、90℃、100℃的水浴中处理5 min,置于0℃冰水混合物中冷却,3000r/min离心10min,收集菌体,PBS洗涤两次后重悬,采用梯度稀释平板法测定其活菌数[6-8]。每个样品重复3次,同时计算存活率,其计算公式如下:

(3)人工胃液耐受性试验
人工胃液参照2015版《中国药典》进行配制。
取上述样品菌液1 mL到9 mL人工胃液中,人工胃液最终pH值调为1.5左右,振荡混匀,37℃水浴孵育,每隔0.5 h取样,将经过人工胃液处理后的菌悬液,3 000 r/min离心10 min,PBS洗涤两次后重悬,梯度稀释法活菌计数,每个样品重复3次[9-11],同时计算存活率。
(4)人工肠液耐受性试验
人工肠液参照2015版《中国药典》进行配制。
取上述样品菌液1 mL到9 mL人工肠液中振荡混匀,37℃水浴孵育2 h,毎隔0.5 h取样,3 000 r/min离心10 min,PBS缓冲液洗涤两次后重悬,采用梯度稀释法进行活菌计数,每个样品重复3次[12],计算存活率。
(5)胆盐耐受性试验
在种子培养基中加入不同量的猪胆盐,使其质量分数分别为0.1%、0.2%、0.3%、0.4%、0.5%、0.6%,混匀,121℃、15 min灭菌后备用。按107CFU/mL接种量分别接种,厌氧培养24 h,观察菌体生长情况,并用紫外分光光度计测定菌液的OD600nm值,每个样品重复3次[11,13]。
1.3.3 数据统计与分析
通过Excel 2010对本研究得到的数据进行统计,并计算活菌数的存活率,后利用SPASS19.0软件进行方差分析,当存在显著差异时,用Duncan氏多重比较法检测组间差异性,0.01<P<0.05,表示差异显著;P<0.01,表示差异极显著。结果用平均值±标准差表示。并利用Origin Pro 8.0软件对本研究中部分数据进行绘图。
2 结果与分析
2.1 优良菌株LXYB-2与初始菌株LXKJ-1发酵液抑菌活性比较
益生菌作为活菌制剂,对常见致病菌都具有一定的抑菌活性,丁酸梭菌作为活菌制剂的一种,也不例外。优良菌株LXYB-2与出发菌株LXKJ-1发酵液抑菌活性结果见图1,抑菌圈测量结果见表1。
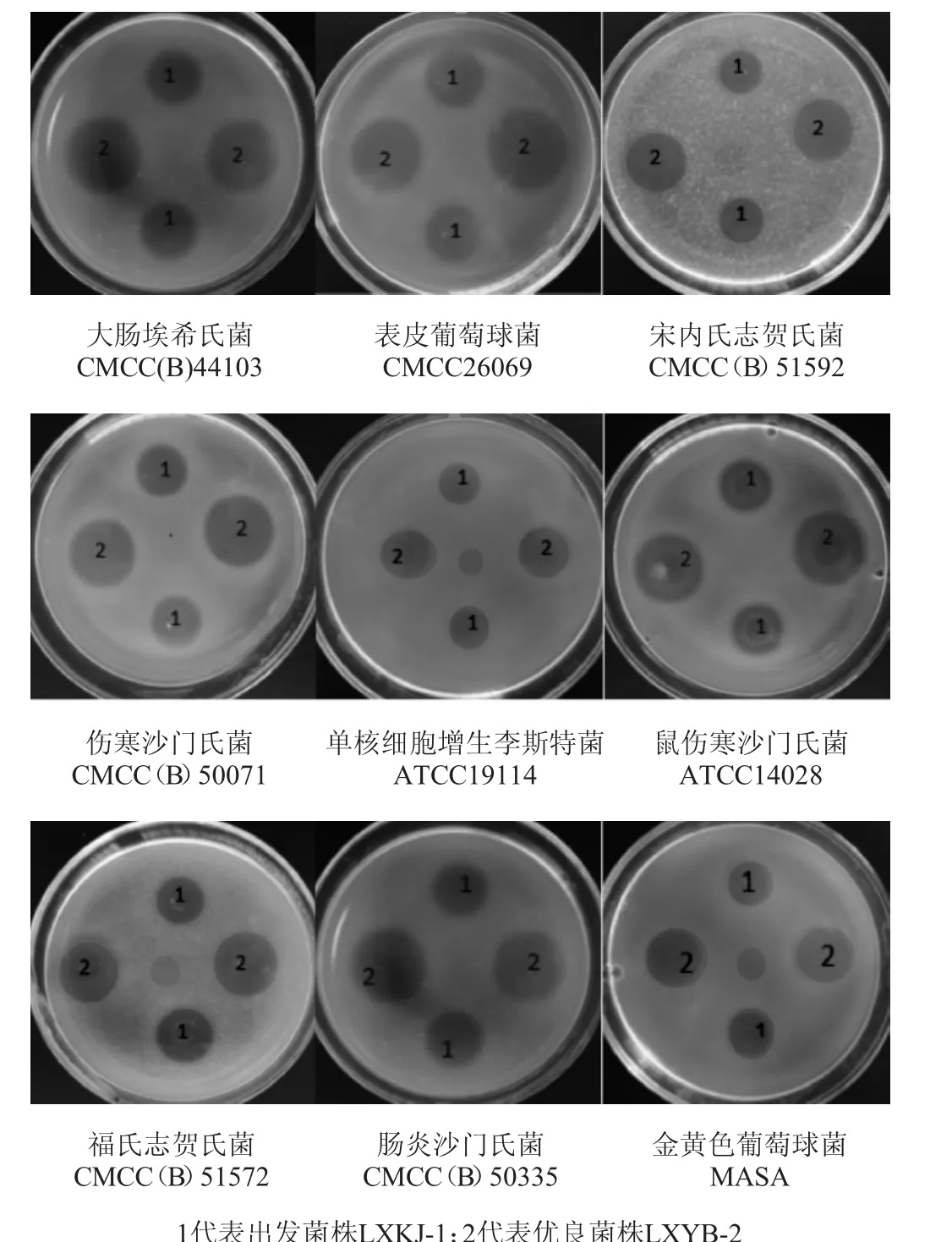
图1 菌株LXYB-2与菌株LXKJ-1发酵液抑菌活性比较Fig.1 Comparison of antibacterial activities of fermentation broth of strains LXYB-2 and LXKJ-1
由图1和表1可知,两株丁酸梭菌菌株对常见的9种致病菌都具有抑菌活性,通过对两株菌抑菌直径的比较,发现两株菌对单核细胞增生李斯特氏菌和金黄色葡萄球菌抑菌活性对比差异不显著(P>0.05),剩余7种均差异性显著(P<0.05),且优良菌株LXYB-2对常见的9种致病菌抑制作用比初始菌株LXKJ-1更强,因此优良菌株LXYB-2具有更好的应用前景。
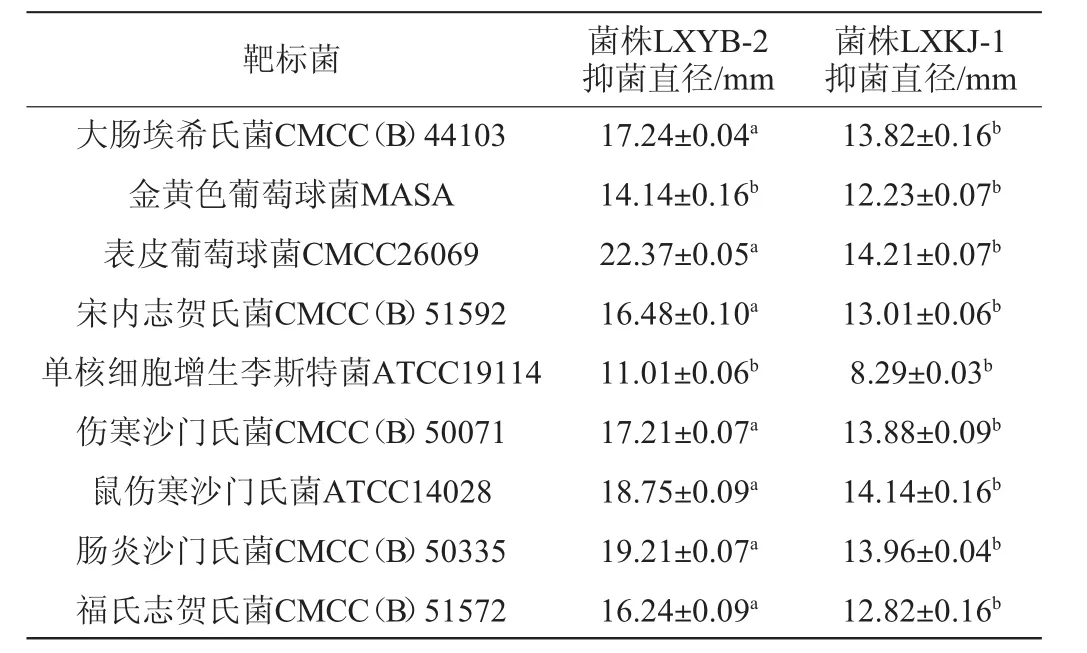
表1 菌株LXYB-2与LXKJ-1发酵液抑菌活性Table 1 Antibacterial activities of fermentation broth of strains LXYB-2 and LXKJ-1
大肠杆菌和沙门氏菌是引起动物腹泻的主要肠道病原菌,与出发菌株LXYB-1相比,优良菌株LXYB-2对上述常见致病菌表现出更强的抑制活性,大肠埃希氏菌CMCC(B)44103抑菌直径提高了24.7%;伤寒沙门氏菌CMCC(B)50071抑菌直径提高了23.99%;鼠伤寒沙门氏菌ATCC14028抑菌直径提高了32.6%;肠炎沙门氏菌CMCC(B)50335抑菌直径提高了37.6%;说明丁酸梭菌LXYB-2比出发菌株LXYB-1更具有替代抗腹泻抗生素的潜力。
林秋云等[14]发现,丁酸梭菌对葡萄球菌尤其是对金黄色葡萄球菌具有强烈的抑制作用,但在本试验中,两株菌株对金黄色葡萄球菌的抑菌活性差异不显著(P>0.05),究其原因可能是丁酸梭菌代谢产物较为复杂,起到抑菌活性的物质不单一,优良菌株LXYB-2与出发菌株LXYB-1相比较究竟是何种具有抑菌性的代谢产物增加了还需要进一步研究。
丁酸梭菌体外抑菌试验的抑菌机理,目前公认的使其代谢产生短链脂肪酸类,降低生长环境的pH,抑制有害菌生长,减少有害菌在肠道内定殖,还通过营养竞争,抑制了有害菌生长[16];或代谢物质中含有蛋白类或多肽类物质对有害菌的抑制[8];本研究中两株丁酸梭菌对9种常见动物致病菌均具有抑制作用,但经过常压室温等离子体(atmospheric and roomtemperature plasma,ARTP)诱变筛选后的优良菌株其抑菌作用更强,可能是由于突变菌株产抑菌活性物质基因的表达量提高了,导致突变菌株产抑菌活性物质能力增强了,究其作用机理却依然值得进一步探讨[15-16]。
2.2 优良菌株LXYB-2与初始菌株LXKJ-1的抗逆性比较结果
2.2.1 耐热性比较结果
菌株的高温耐受性,是微生态制剂是否能够在饲料加工过程中存活下来的一个主要考察指标,耐热性直接关系到其应用范围,因此耐热性考察以及耐热性菌株的筛选是非常重要的。饲料加工过程温度与时间一般为85℃,5 min内[17],实验组分别按照1.3.2中制备的出发菌株LXKJ-1和优良菌株LXYB-2的菌悬液为对照,对出发菌株LXKJ-1和优良菌株LXYB-2的耐热性进行比较,两株菌的高温耐受性结果分别见表2和表3。

表2 菌株LXKJ-1的高温耐受性结果Table 2 Results of resistance of strain LXKJ-1 to high temperature

表3 菌株LXYB-2的高温耐受性结果Table 3 Results of resistance of strain LXYB-2 to high temperature
由表2和表3可知,菌株LXKJ-1与菌株LXYB-2都具有较好的耐热性,在80℃处理5 min后,活菌数均为4.96×108CFU/mL,活菌数差异性比较不显著(P>0.05);但是随着温度的上升,两株菌高温耐受性开始下降,90℃条件下处理5 min后活菌数分别为2.45×108CFU/mL和4.12×108CFU/mL,数据分析差异性比较显著(P<0.05)。两株菌分别在90℃和100℃条件下处理5min后,两株菌株的高温耐受性存在显著差异性(P<0.05),且菌株LXYB-2的存活率较初始菌株分别高了32.4%和17.4%,说明菌株LXYB-2比菌株LXKJ-1具有更好的高温耐受性。
丁酸梭菌高温耐受性试验发现,两株菌都可以耐受饲料加工过程中的高温过程,但是随着加热温度的上升,菌体的存活率呈下降状态,在实际的饲料处理或制粒的过程中,工厂需要缩短热处理时间,时间过长会造成菌体的大量灭活[18]。
2.2.2 人工胃液耐受性研究结果
动物的胃液属于酸性环境,一般pH值在2.5~3.0[19],丁酸梭菌是否能够进入肠道内定殖和发挥作用,必须经过胃液环境的考验,而食物在胃中消化时间一般为1~2 h[20-21],因此,胃液耐受性考察是作为丁酸梭菌应用潜力考察的一个重要指标。分别以按照1.3.2中制备的出发菌株LXKJ-1和优良菌株LXYB-2的菌悬液为对照,比较两株菌株人工胃液耐受性差异,菌株LXKJ-1的人工胃液耐受性结果见表4,优良菌株LXYB-2人工胃液耐受性结果见表5。

表4 LXKJ-1人工胃液耐受性结果Table 4 Results of resistance of strain LXKJ-1 to artificial gastric fluid

表5 LXYB-2人工胃液耐受性结果Table 5 Results of resistance of strain LXYB-2 to artificial gastric fluid
由表4和表5可知,菌株LXYB-2与菌株LXKJ-1经人工胃液处理2.0 h后,活菌数分别为4.93×108CFU/mL和4.49×108CFU/mL,活菌数差异性分析不显著(P>0.05),说明两株菌株胃液耐受性都较强。菌株LXYB-2经人工胃液处理2.0 h后活菌数变化不明显为4.93×108CFU/mL,而菌株LXKJ-1活菌数降低10%左右,为4.49×108CFU/mL,说明菌株LXYB-2人工胃液耐受性优于出发菌株LXKJ-1。
2.2.3 人工肠液耐受性研究结果
张媛媛等[23]指出小肠液的pH值为7.5左右,食物通过小肠的时间为1.5 h;实验按照1.3.2中制备的出发菌株LXKJ-1和优良菌株LXYB-2的菌悬液为对照,出发菌株LXKJ-1人工肠液耐受性结果见表6;优良菌株LXYB-2人工肠液耐受性结果见表7。
由表6和表7可知,菌株LXYB-2与菌株LXKJ-1对人工肠液都具有很好的耐受性,人工肠液处理2.0h,活菌数均为5.0×108CFU/mL,菌株LXYB-2与菌株LXKJ-1的活菌数变化无显著差异性(P>0.05),说明菌株LXYB-2与菌株LXKJ-1都可以在肠道内保持较高的存活率。

表6 菌株LXKJ-1人工肠液耐受性结果Table 6 Results of resistance of strain LXKJ-1 to artificial intestinal fluid

表7 菌株LXYB-2人工肠液耐受性结果Table 7 Results of resistance of strain LXYB-2 to artificial intestinal fluid
在模拟胃、肠液耐受性试验发现,两株丁酸梭菌都具有非常好的耐受性,但是在实际应用过程中,胃肠道环境、饲料中大量抗生素类物质的添加、高铜高锌等因素是否都丁酸梭菌的生存繁殖有影响还需要进一步验证和考察。
2.2.4 胆盐耐受性研究结果
菌株的特性决定了其肠道胆盐的耐受性,一般情况下动物肠道内胆盐的质量分数约为0.03%~0.30%,菌株胆盐耐受性是影响其在肠道定殖的重要因素[22]。菌株LXKJ-1与LXYB-2的胆盐耐受性结果见图2。

图2 菌株LXKJ-1与LXYB-2胆盐耐受性比较Fig.2 Comparison of bile salt resistance between strains LXKJ-1 and LXYB-2
由图2可知,优良菌株LXYB-2与起始菌株LXKJ-1都对胆盐具有很好的耐受性,但是优良菌株LXYB-2在人工胆盐浓度0.4%条件下能够正常生长,而出发菌株LXKJ-1在该浓度下菌株的生长已经受到抑制,两株菌的人工胆盐耐受性差异性显著(P<0.05),说明菌株LXYB-2比菌株LXKJ-1更具有胆盐耐受性,可以保证了其可以顺利地通过小肠,并最终成功定殖于动物肠道后端。
3 结论
通过对菌株LXYB-2与LXKJ-1的抑菌能力比较得出,两株菌对单核细胞增生李斯特氏菌和金黄色葡萄球菌抑菌活性对比差异不显著(P>0.05),对剩余7种靶标菌的抑制能力均差异性显著(P<0.05),且优良菌株LXYB-2对常见的9种致病菌抑制作用比初始菌株LXKJ-1更强。
通过对菌株LXYB-2与LXKJ-1的温度、人工胃液、人工肠液及胆盐耐受性的测定和比较得出:菌株LXKJ-1和菌株LXYB-2都具有较好的高温耐受性,90℃处理5 min,菌株LXYB-2存活率较菌株LXKJ-1高32.4%,差异显著(P<0.05);两株丁酸梭菌菌株均具有很好的人工胃液、人工肠液耐受性,且差异不显著(P>0.05);菌株LXYB-2与菌株LXKJ-1都对胆盐具有较好的耐受性,且菌株LXYB-2比菌株LXKJ-1胆盐耐受性更强,在胆盐浓度为0.4%时,菌株LXYB-2依然可以正常生长,较菌株LXKJ-1胆盐耐受浓度提高了0.1%,胆盐耐受性差异显著(P<0.05)。说明优良菌株LXYB-2更具有应用潜力,这为进一步的筛选和挖掘益生菌的应用潜力提供了参考。
[1]赵建新,张 灏,田丰伟.丁酸菌的分离、鉴定及筛选[J].食品与生物技术学报,2002(6):597-601,612.
[2]LILLY D M,STILLWELL R H.Probiotics:growth-promoting factors produced by microorganisms[J].Science,1965,147(3659):747-748.
[3]杜 鹏,霍贵成.国内外益生菌制品发展现状[J].食品科学,2004,25(5):194-198.
[4]陆 俭,张雪平,孟筱琦.酪酸梭菌和婴儿型双歧杆菌对霍乱弧菌的拮抗试验[J].微生物学通报,2000(5):338-341.
[5]贾丽楠,崔 嘉,陈宝江.丁酸梭菌对肉仔鸡饲料加工过程及消化道环境的耐受性研究[J].动物营养学报,2017,29(10):3787-3791.
[6]刘 磊,田亚男,王鹤松,等.丁酸梭菌CBM01的碳、氮源优化及其对胃肠道耐受性的研究[J].动物营养学报,2017,29(10):3831-3836.
[7]王腾浩,宗 鑫,汪以真,等.产抑菌蛋白的丁酸梭菌的筛选和鉴定及体外益生功能研究[J].中国畜牧杂志,2015,51(13):75-81
[8]曹广添,刘婷婷,周 琳,等.丁酸梭菌对致病菌和有益菌的体外作用效果研究[J].中国饲料,2012(4):16-19.
[9]孙 亮.Bacillus atrophaeusHAB-1的抑菌活性研究及培养条件优化[D].海口:海南大学,2013.
[10]罗 璠,李明雄,杨志荣,等.产类细菌素的乳酸菌的筛选及其抑菌特性研究[J].四川大学学报:自然科学版,2010,47(3):655-660.
[11]张秀红,刘婷婷.具广谱抑菌活性乳酸菌的筛选[J].乳业科学与技术,2010,33(2):56-59.
[12]廖秀冬.丁酸梭菌的筛选及其对动物抗氧化能力和肉鸡肉品质影响的研究[D].北京:中国农业大学,2015.
[13]孔 青.丁酸梭菌培养与发酵动力学以及调节腹泻小鼠肠道菌群平衡的研究[D].杭州:浙江大学,2006.
[14]林秋云,杜光文,曾树权,尹映华.潮州市食品中食源性致病菌污染状况及耐药性监测结果[J].中国热带医学,2008(6):1015-1017.
[15]NAKANISHI S,TANAKA M.Sequence analysis of a bacteriocinogenic plasmid ofClostridium butyricumand expression of the bacteriocin gene inEscherichia coli[J].Anaerobe,2010,16(3):253-257.
[16]WANG L Y,HUANG Z L,LI G,et al.Novel mutation breeding method forStreptomyces avermitilisusing an atmospheric pressure glow discharge plasma[J].J Appl Microbiol,2009,108(3):851-858.
[17]龚利敏,王 恬.饲料加工工艺学[M].北京:中国农业大学出版社,2010:136-151.
[18]邓 庆,廖美德.多种除氧技术培养丁酸梭菌的研究[J].中国酿造,2013,32(10):44-48.
[19]陈桂芳,刘 艳,单春乔,等.费氏丙酸杆菌生物学特性及与5株益生菌拮抗性试验研究[J].中国酿造,2018,37(1):69-73.
[20]霍 恺.乳杆菌旳益生特性研究[D].济南:山东大学,2015.
[21]付小猛.枯草芽孢杆菌CCAM 080032的益生特性及高密度固态发酵工艺的研究[D].武汉:华中农业大学,2011.
[22]张媛媛.复合芽孢杆菌制剂发酵工艺及其耐受性研究[D].哈尔滨:东北林业大学,2012.
