清香型小曲白酒机械化生产中微生物动态变化研究
2018-07-09陈申习夏金阳
陈申习,唐 洁,张 龙,张 磊,夏金阳,杨 强*
(劲牌有限公司 劲牌研究院 中药保健食品质量与安全湖北省重点实验室,湖北 大冶 435100)
小曲清香型白酒从酿造工艺上可分为传统法和纯种根霉酿造两种类型,传统法清香型小曲白酒主要分布在湖北、湖南、江西等地。其酿制设备简单、原料广泛、用曲量少、发酵周期短、出酒率高、酒体醇厚清雅、绵软爽净等优点深受厂家和广大消费者喜爱[1-3]。与国内其他香型白酒相比,传统清香型小曲白酒也存在依靠大量人力来完成整个生产过程的弊端。随着社会经济的发展,越来越多的行业开始依靠技术的革新、设备的升级来提高生产效率。与此同时,酿酒行业也加大了技术创新的步伐,逐渐开始了借助机械化、自动化、信息化代替传统酿造工艺的创新探索[4-6]。湖北劲牌有限公司作为清香型小曲白酒的龙头企业,从2006年就开始了机械化新工艺酿酒的摸索。经过几年的工艺、设备的自主创新,已建成了机械化、信息化程度高的现代化小曲白酒酿造车间,突破了传统酿造模式,把大量人力资源从繁琐的劳动中解放出来,提高了酿造效率,节约了资源,改善了酿酒品质,极大地推动了整个白酒产业转型升级[7]。
在白酒酿造行业,微生物是支撑产品发展的基础与核心,研究清楚微生物在发酵过程中群落组成、消长规律、个体功能以及主要功能菌间的互作关系,对于保持与提升公司产品竞争力至关重要。随着分子生物技术的发展,目前国内外白酒微生物研究者借助先进的高通量测序技术,对传统白酒酿造过程及环境微生物进行了解析,为白酒微生物的研究开拓了思路[8-11]。但由于白酒酿造环境的特殊性,在整个酿造环境中微生物细胞内存在着复杂的生理生化反应,因而目前行业内对整个酿造过程中微生物种类、数量、代谢机理以及微生物各类群之间复杂而密切的关系还缺乏清晰的认识,进而未能充分发挥出酿酒微生物的最佳功能,一定程度上制约了机械化小曲白酒酒质的快速提升[12-15]。同时,现代酿酒企业普遍存在的酒质、出酒率随着酿酒原料、季节的不同而产生差异的问题,尚未得到有效解决。分析这些困扰目前企业发展的难题,归根结底也都与发酵过程中微生物的结构和功能息息相关[16-18]。
因此,为了进一步弄清小曲白酒机械化生产中各类微生物的种类、数量变化情况,在调研前期酿酒微生物研究的基础上[19-21],考虑研究的应用性,本研究采用传统分离培养手段对劲牌有限公司清香型小曲白酒机械化酿造过程中微生物进行了分离鉴定以及数量动态变化跟踪,以期通过不断的研究,阐明酿造过程中主要微生物种类及其在发酵过程中的变化规律,为机械化生产工艺的改进、酒质的不断提升提供技术支撑,从而为社会创造出更多经济效益。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
实验样品于2017年3月采自劲牌有限公司机械化发酵车间。
1.1.2 化学试剂
酵母浸粉、酵母膏、葡萄糖、蛋白胨、琼脂粉(均为生化试剂):国药集团化学试剂有限公司。细菌和真菌基因组DNA提取试剂及引物:上海生工生物技术服务公司。
1.1.3 培养基
WL营养琼脂培养基:葡萄糖5%,酵母浸粉0.4%,蛋白胨0.5%,硫酸镁0.012 5%,磷酸二氢钾0.055%,氯化钾0.042 5%,氯化钙0.012 5%,硫酸锰0.000 25%,氯化铁0.000 25%,溴甲酚绿0.002 2%(灭菌后添加),琼脂2%,青霉素0.01%,调节pH至6.5,121℃灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:酵母提取物1%,葡萄糖2%,蛋白胨2%,青霉素0.01%,固体培养基可添加琼脂粉2%,121℃灭菌30 min。
LB肉汤培养基:胰蛋白胨1%,酵母膏0.5%,NaCl 1%,琼脂2%,pH 7.0,称取0.01%制霉菌素加入培养基中,用于抑制霉菌的生长,121℃灭菌30 min。
MRS乳酸菌培养基:蛋白胨1%,牛肉浸膏1%,酵母浸粉0.5%,葡萄糖0.5%,乙酸钠0.5%,柠檬酸二胺0.2%,吐温80 0.1%,七水硫酸镁0.02%,七水硫酸锰0.005%,磷酸氢二钾0.2%,琼脂2%,pH 6.8,121℃灭菌30 min。
1.2 仪器与设备
AL204电子分析天平:梅特勒-托利多仪器(上海)有限公司;JJ1000电子天平:常熟双杰测试仪器厂;SFG-02B电热恒温鼓风干燥箱:上海精宏实验设备仪器厂;QYC-200全温空气摇床:上海福玛实验设备有限公司;YXQ-LS-75S蒸汽灭菌锅、SPX-100B-Z生化培养箱:上海博讯实业有限公司;BCM-1600A洁净工作台:苏州安泰空气技术有限公司;NikonECLIPSE E200LEDMV Series显微镜:日本Nikon公司。
1.3 试验方法
1.3.1 样品采集
实验样品采自劲牌有限公司机械化发酵车间,目前车间糖化培菌时间为1 d,发酵周期为15 d,一个发酵批次总计16 d。每个车间每天连续进行一个发酵批次。本研究选择糖化后时间点为一个取样点,发酵0~15 d每天固定时间取一次样,故一个发酵批次总计取样17次,每次取样固定一个发酵槽车并采用三点一线取样方法[22],为了获得不同生产批次数据,便于结果对比分析,选择同一个车间相邻4个发酵批次进行取样,共68个样品。
1.3.2 菌株分离纯化
准确称取每份酒醅样品5 g,放入装有95 mL无菌水并带有玻璃珠的250 mL三角瓶中,200 r/min振荡30 min,使酒醅与水充分混合,制成菌悬液。吸取1 mL所得菌悬液注入装有9 mL无菌水的试管中,标记为10-1稀释度,按照同样的方法依次制成10-2、10-3、10-4稀释度的菌悬液。分别从标记为10-1、10-2、10-3和10-4稀释度试管中吸取0.2 mL溶液分别置于无菌WL、YPD、LB和MRS培养基中,每个梯度设置两个平行。采用平板涂布法,吸取200 μL菌液,用无菌玻璃涂棒在平板上涂布均匀,然后平放于试验台上20~30 min,使菌液渗入培养基表层内,再将平板分别倒置于30℃(真菌)、37℃(细菌)培养箱中培养。培养24~72 h后,采用菌落记号方式进行酵母和细菌单菌落数的统计,统计完成后用无菌接种环挑出平板上的单个菌落,划线接种于新的培养基平板上,继续培养48~72 h。经过2~3次平板划线后得到初步纯化的菌落转入相应斜面试管于4℃冰箱保存。
菌落计数方式:根据样品培养结果挑选菌落数在30~300的平板进行统计,最后总数乘以稀释倍数即可算出不同微生物的总数。进一步把平板上所有菌落转移到相应培养基平板上,培养2 d后通过形态及分子鉴定,可获得样品中微生物百分比。
1.3.3 菌株的鉴定
(1)菌株的形态特征观察
根据菌落的颜色、边缘、透明度、大小等特征挑选培养皿上单菌落并进行划线纯化。细胞形态借助显微镜观察,菌株的表型特征参考常见细菌、真菌系统鉴定手册进行描述分类[23-24]。
(2)菌株温度耐受性实验
分别将酵母浸出粉胨葡萄糖、LB肉汤培养基、MRS乳酸菌培养基液体培养基分装至10 mL试管,灭菌备用,然后将酵母、细菌种子液(108CFU/mL)以3%的接种量加入相应试管中,分别在15℃、25℃、30℃、45℃、55℃培养48 h,测定其吸光度值。
(3)菌株分子生物学鉴定
对分离得到的微生物进行基因组(deoxyribonucleic acid,DNA)的提取,以得到的脱氧核糖核酸DNA产物为模板分别使用真菌通用引物内转录间隔1区(internal transcribedspacer 1,ITS1)和ITS4以及细菌通用引物27F/1492R扩增对应的区域,聚合酶链式反应(polymerase chain reaction,PCR)扩增产物经电泳检测,引物及反应条件见表1。
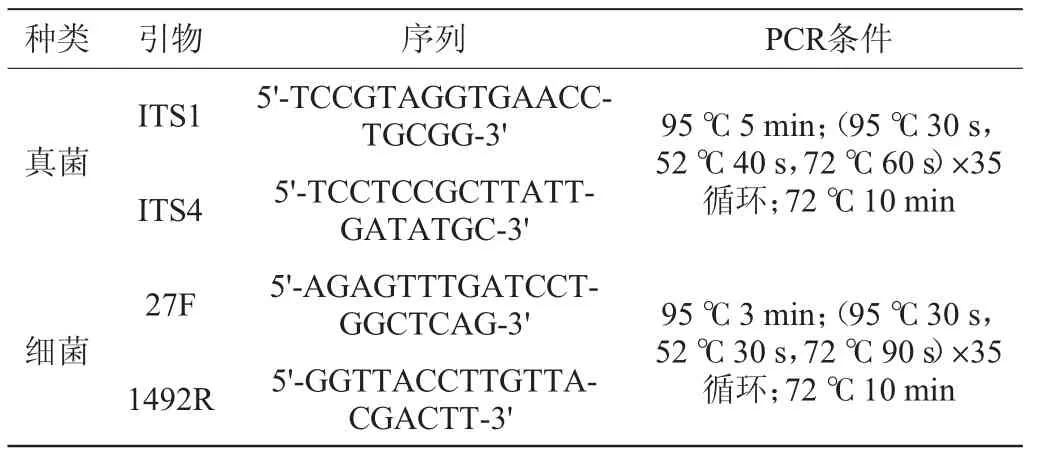
表1 引物信息和PCR反应条件Table 1 Primer information and PCR reaction conditions
2 结果与分析
2.1 菌株的形态描述
通过观察50株真菌和60株细菌的平板菌落及显微形态,结果分别见图1和表2。由图1和表2结果结合常见菌株鉴定手册,对菌株形态进行了初步描述,酵母可分为4种类型、霉菌可分为2种类型、细菌可分为6种类型:
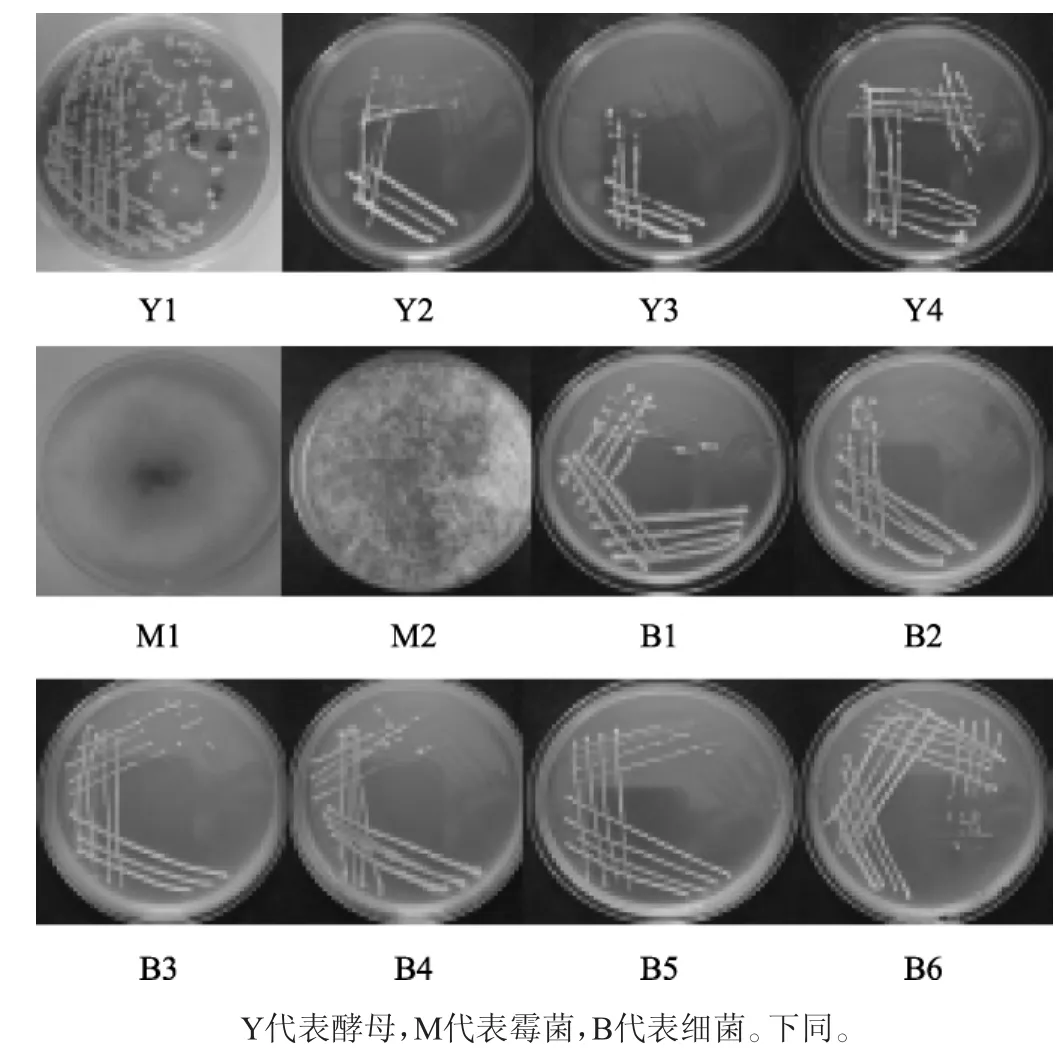
图1 各菌株菌落形态Fig.1 Colony morphology of each strain

表2 菌株形态特征Table 2 Morphological characteristics of strains
2.2 菌株的温度耐受实验
从上述类型酵母和细菌各选择一株进行耐温测试(菌株编号同相应类型编号)。分别在15℃、25℃、30℃、45℃、55℃培养48 h后,测定吸光度值,结果见图2。
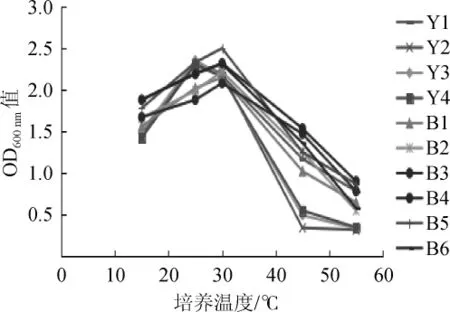
图2 不同温度下酵母和细菌的生长状况Fig.2 Growth status of yeasts and bacteria under different temperature conditions
由图2可知,4株酵母在25℃和30℃生长良好,但随着温度升高,OD600nm值下降较快,45℃时,酵母生长受到明显抑制。而菌株Y1在45℃生长相对较好,具有一定的耐热能力,可以适应清香型小曲白酒糖化时40℃的温度。细菌在30℃生长良好,耐热性强于酵母,在55℃时生长活性减弱。
2.3 菌株的分子生物学鉴定
将分离自发酵酒醅中的50株真菌和60株细菌进行基因组DNA提取,并以此为模板分别使用真菌通用引物内转录间隔(internal transcribed spacer,ITS)1区和ITS4区以及细菌通用引物27F/1492R扩增对应的区域,聚合酶链式反应(polymerase chain reaction,PCR)扩增产物经电泳检测,纯化后的产物进行测序,将测序结果在美国国家生物技术信息中心(nationalcenterforbiotechnologyinformation,NCBI)数据库上进行相应序列比对,与库中菌株同源序列相似性≥99%即初步鉴定该序列所对应的菌种。各类别菌株鉴定见表3与表4。

表3 酒醅真菌鉴定结果Table 3 Identification results of fungi from the fermented grains
对发酵酒醅分离的50株真菌进行菌株鉴定,结合形态,其中确定4种酵母(分别编号为Y1~Y4),包括5株异常威克汉姆酵母(Wickerhamomyces anomalus)、30株酿酒酵母(Saccharomyces cerevisiae)、3株库德里阿兹威毕赤酵母(Pichia kudriavzevii)、2株盔形毕赤酵母(Pichia manshurica)。2种霉菌(编号为M1,M2),分别为2株分枝横梗霉(Lichtheimia ramosa)和8株米根霉(Rhizopus oryzae)。

表4 酒醅细菌鉴定结果Table 4 Identification results of bacteria from the fermented grains
从酒醅中分离获得60株细菌,结合形态描述,经分子鉴定分别属于6个细菌种群(编号为B1~B6),如表4所示。包括5株类地衣芽孢杆菌(Bacillus paralicheniformis)、4株枯草芽孢杆菌(Bacillus subtilis)、5株干酪乳杆菌(Lactobacillus casei)、10株短乳杆菌(Lactobacillus brevis)、8株希氏乳杆菌(Lactobacillus hilgardii)、28株瑞士乳杆菌(Lactobacillus helveticus),发酵后期氧气消耗殆尽,且酸度增高,乳酸菌繁殖较快,占比在90%以上,如瑞士乳杆菌(Lactobacillus helveticus)、短乳杆菌(Lactobacillus brevis)。
2.4 发酵过程数量动态变化分析
对发酵过程进行15 d的微生物计数,每隔24 h取样,每次取样2 kg,每次选择3个重复进行微生物总数统计,连续跟踪统计4个发酵批次,分析车间工艺执行情况。其中酵母菌及细菌数量变化结果分别见图3及图4。
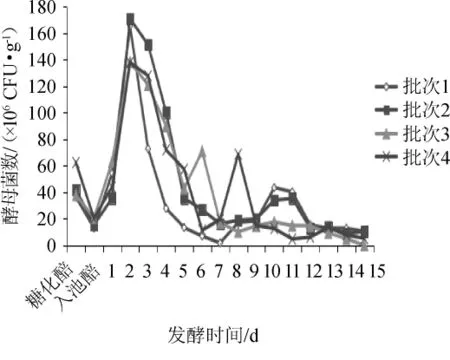
图3 酒醅酵母数量动态变化Fig.3 Dynamic change of yeast number in the fermented grains
由图3可知,酒醅在完成入池后,酵母菌的活菌数量呈一个先增多后降低的趋势。在发酵初期,由于发酵容器剩余氧气的存在,酵母菌处于一个快速繁殖期,在发酵第2天时酵母总数增殖到最大值,达到108CFU/g。随着发酵过程的进行,氧气逐渐消耗,酵母增殖缓慢,活菌数量开始逐渐下降,在发酵第5天后,数量稳定在107CFU/g。因此,在入池第2天时会达到最大生长量。除去不同批次投粮、下曲、糖化、发酵等因素导致的部分时间点酵母数量有微弱差异外,4个批次之间酵母总数总体变化趋势一致,从多个批次相互验证揭示了酵母数量变化规律,也从侧面反映出车间工艺参数控制的稳定性。
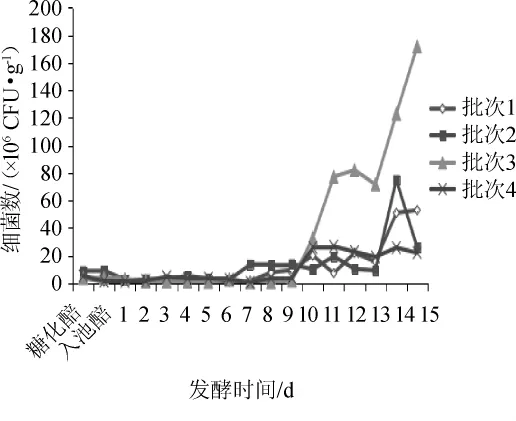
图4 酒醅细菌数量动态变化Fig.4 Dynamic change of bacteria number in the fermented grains
由图4可知,而细菌在酒醅入池后,菌群生长先经历了一个迟滞期,后呈缓慢上升趋势。在发酵的前9d,细菌菌群处于迟缓期,从第10天开始,细菌数量逐渐升高至106CFU/g,此后,细菌增殖较快,总数可以达到107CFU/g。由于固态发酵包括投粮、下曲、糖化、发酵等多个环节,且特殊的密闭发酵环境无法保证不同批次微生物绝对的一致性。因此,不同发酵批次细菌总数在发酵后期略有差异,但总体变化趋势较一致,体现了车间生产的稳定可控。
3 结论
本次研究采用传统分离方法对劲牌清香型小曲白酒机械化酿造过程中微生物种类与数量变化进行了分析统计,并结合形态描述和现代分子技术对所分离菌株进行了鉴定,共得到了4种酵母菌、2种霉菌和6种细菌,分别为异常威克汉姆酵母(W.anomalus)、酿酒酵母(S.cerevisiae)、库德里阿兹威毕赤酵母(P.kudriavzevii)、盔形毕赤酵母(P.manshurica)、分枝横梗霉(L.ramosa)、米根霉(R.oryzae)、地衣芽孢杆菌(B.paralicheniformis)、枯草芽孢杆菌(B.subtilis)、干酪乳杆菌(L.casei)、短乳杆菌(L.brevis)、希氏乳杆菌(L.hilgardii)、瑞士乳杆菌(L.helveticus)。其中,酵母中以酿酒酵母占绝对优势,起主要发酵作用。其他酵母如异常威克汉姆酵母、库德里阿兹威毕赤酵母为生香酵母,细菌中主要为乳酸杆菌,且在发酵后期增殖较快。同时,本研究对清香型小曲白酒机械化发酵过程中微生物数量变化趋势进行了分析总结,得出了酵母和细菌总数在发酵过程中的变化规律,其中酵母总数在发酵过程中先后经历了快速增殖和逐渐死亡的过程,最大数量可以达到108CFU/g。而细菌在发酵前期数量稳定在106CFU/g左右,随着后期发酵环境的改变,为细菌的增殖提供了适合的环境,发酵结束前数量可以升至107CFU/g以上。本研究通过对4个连续发酵批次酒醅微生物分析,从微生物培养结果可以看出各批次微生物变化规律较一致,揭示了车间微生物的整体变化规律,也间接反映出了车间工艺管控的稳定。以上研究结果为后期升级清香型小曲白酒机械化工艺提供了菌株资源,也为监控生产工艺提供了重要的微生物参数指标。
[1]李大和,曹远亮,王进明,等.三种复合香型白酒特点比较[J].酿酒,2016,43(1):26-30.
[2]庾昌文,薛栋升,郭 威,等.酒醅中高产淀粉酶酵母的分离鉴定及产酶条件研究[J].酿酒,2015,42(5):71-75.
[3]刘 永.不同发酵容器对云南小曲清香型白酒风味的影响[N].华夏酒报,2015-09-15(C48).
[4]蔡凤娇.固态法小曲白酒机械化酿造工艺技术研究[D].武汉:湖北工业大学,2013.
[5]汪江波,王 炫,黄达刚,等.我国白酒机械化酿造技术回顾与展望[J].湖北工业大学学报,2011,26(5):50-54.
[6]刘 朋,李志扬,倪红军,等.白酒酿造设备的发展现状与展望[J].中国酿造,2017,36(1):24-28.
[7]杨强.劲牌公司白酒生产机械化发展历程与体会——在全国第四届清香型白酒高峰论坛上的发言[J].酿酒,2011,38(5):12-13.
[8]HUANG Y,YI Z,JIN Y,et al.Metatranscriptomics reveals the functions and enzyme profiles of the microbial community in Chinese nong-flavor liquor starter[J].Front Microbiol,2017,8:1747.
[9]WANG X,DU H,ZHANG Y,et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microbiol,2017:AEM.02369-17.
[10]SONG Z,DU H,ZHANG Y,et al.Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J].Front Microbiol,2017,8:1294.
[11]PANG X N,HAN B Z,HUANG X N,et al.Effect of the environment microbiota on the flavour of light-flavourBaijiuduring spontaneous fermentation[J].Sci Report,2018,8(1):3396.
[12]王万能,王 鹏,王 东,等.多粮小曲清香型白酒发酵过程中微生物动态变化研究[J].重庆理工大学学报,2011(11):30-33.
[13]JIN G,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trend Food Sci Technol,2017,63:18-28.
[14]边名鸿,万世旅,代 梅,等.产酒酵母的筛选鉴定及其在小曲中的应用[J].中国酿造,2016,35(3):57-60.
[15]王 薇,吴 群,徐 岩.清香型白酒固态酿造过程中酵母种群结构和多样性分析[J].微生物学通报,2012,39(9):1272-1279.
[16]赵群丽.酱香大曲中酿酒微生物的筛选及发酵工艺研究[D].贵阳:贵州大学,2016.
[17]陈育新,韩 珍,郭庆东.中国白酒中呈香呈味物质研究进展[J].食品研究与开发,2015,36(2):140-142.
[18]沈永祥,周 敏,薛栋升,等.小曲白酒机械化酿造过程中酒醅微生物的种属鉴定及生物安全性分析[J].酿酒,2014,41(5):31-34.
[19]庾昌文,薛栋升,周 敏,等.清香型小曲白酒机械化酿造过程中细菌多样性及酿造性能分析[J].湖北农业科学,2016(11):2860-2863.
[20]吴树坤,杨 磊,杨玲麟,等.沉香型酒醅中产香芽孢杆菌的分离鉴定及代谢产物分析[J].中国酿造,2018,37(1):35-40.
[21]胡开礼.机械化小曲白酒酿造工艺研究[D].武汉:武汉工程大学,2015.
[22]汪江波,周 敏,沈永祥,等.白酒机械化酿造过程中主要风味物质的生成规律[J].湖北农业科学,2014,53(22):5499-5503.
[23]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001:23-28.
[24]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:37-42.
