高浓度柠檬酸对酿酒酵母生长的抑制效应
2018-07-09王宝石李林波武忠伟张明霞
王宝石,李林波,武忠伟,张 蕾,陈 锋,陈 林,张明霞*
(1.河南科技学院 生命科技学院,河南 新乡 453003;2.现代生物育种河南省协同创新中心,河南 新乡 453003)
山葡萄、越橘、山楂等是含有较高酸度的酿酒原料,其酸度一般为12.0~20.0 g/L,大多需要进行降酸处理才能进行发酵[1]。果酒降酸的方法主要有化学降酸法、物理降酸法和生物降酸法[2],化学降酸和物理降酸会造成酒体不稳定、苦涩味、风味物质及有益成分的损失和颜色的吸附等,生物降酸目前仅对果酒中的苹果酸有效。而富含柠檬酸类果实的pH值可低至1.9,高柠檬酸含量、低pH值(pH<3.0)环境因素对酿酒酵母生长的影响少有报道。因此,如何提高酿酒酵母耐受高柠檬酸、低pH值的环境胁迫并改善其发酵性能,是果酒开发和品质提高所面临的主要问题。
高有机酸、低pH是果酒酿造中酵母面临的主要环境胁迫。酿酒酵母是果酒发酵的主要微生物,但果酒发酵醪液不是酿酒酵母的最佳生理环境。发酵过程中,酿酒酵母持续受到有机酸、pH、渗透压、SO2和乙醇等多种环境因子的胁迫[3-5],尤其是来源于果酒酿造原料的有机酸引起的低pH胁迫[6-7]。有机酸胁迫不是简单的高氢离子的毒性,而是依赖于生物体所暴露的酸化学性质[8]。有机酸会导致酿酒酵母体内pH的改变,影响细胞壁的结构,改变质膜中蛋白质的构型,引起原生质膜对某些离子渗透性的变化,从而影响酵母的正常生理功能、酒精发酵的速度、发酵产物的组成[4,9]。在弱有机酸条件下,为了抵抗细胞内环境的酸化,酵母细胞会增加质膜H+-三磷酸腺苷(adenosine triphosphate,ATP)酶的活性,将质子排出,以保持细胞内部pH的稳定[10-11]。但若仅排出质子,则酸根离子将导致酵母细胞内部渗透压的增加。目前越来越多的研究表明酸根离子的排出也跟质膜相关,主要由质膜ATP结合区转运子(Pdr12p)来完成[12]。关于酵母细胞的抗酸性,除质子泵外,其他泵也可能参与了酵母细胞阴离子排出[13]。有酸胁迫也将导致氧化胁迫,超氧化物歧化酶和过氧化氢酶的活性增强[14]。目前,有机酸胁迫对酿酒酵母的影响及其应激反应的研究主要集中在生物乙醇生产中的乙酸胁迫[15-17]、乳酸胁迫[14],以及在食品防腐剂如山梨酸钾、苯甲酸钠的胁迫等方面[18]。主要从基因水平(如ATP结合区转运子Pdr12)、转录水平(转录因子war1p、Fps1p)、蛋白质水平(质膜H+-ATP酶、超氧化物歧化酶和过氧化氢酶)研究酵母细胞对有机酸胁迫的应答机制[19-20]。但有机酸的种类繁多,各自理化特性差异大,很多有机酸并不遵循典型的酸胁迫理论[21]。NIELSEN M K等[22]研究了在pH3.0、4.0、4.5条件下柠檬酸对酿酒酵母生长代谢的影响,结果发现pH越高,对酿酒酵母的生长抑制越明显,这显示柠檬酸与典型弱有机酸防腐剂的抗微生物机制不同。柠檬酸可能通过鳌合基质中的Ca2+和Mg2+来抑制酿酒酵母生长[22-23],另外酿酒酵母能通过高渗甘油分裂素激活蛋白激酶途径适应柠檬酸对其造成的胁迫[23]。因此,分析柠檬酸及相应pH值对酿酒酵母生长及酒精发酵的影响,是高柠檬酸、低pH原料的发酵研究基础,是果酒质量控制和品质提高的依据。本研究从5种酿酒酵母中筛选了两种代表性的菌种酿酒酵母EC1118和2323,分别研究了不同柠檬酸浓度,pH条件和柠檬酸根浓度的培养条件下两种酿酒酵母的生长曲线,以期揭示柠檬酸对酿酒酵母生长抑制的机制。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomyces cerevisiae)EC1118与2323:法国莱蒙特集团;蛋白胨、酵母膏(均为生化试剂):美国OXOID公司;柠檬酸、强氧化钠(均为分析纯):国药集团化学试剂有限公司。
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:1%酵母浸粉,2%蛋白胨,2%葡萄糖。固体斜面培养基添加2%琼脂。
1.2 仪器与设备
722N型紫外可见分光光度计:上海菁华科技仪器有限公司;ZWF-2112恒温培养振荡器:上海智城分析仪器制造有限公司;HH-6电热数显恒温水浴锅:上海安普科学仪器有限公司;5415D高速离心机:德国Eppendorf公司;徕卡DM1000显微镜:德国Leica公司。
1.3 方法
1.3.1 菌种活化
分别称取活性干酵母EC1118和23235.0g于烧杯中,加入2%葡萄糖溶液50 mL,在28℃恒温培养箱中保温30 min,离心收集细胞(4 000 r/min、5 min、4℃),用灭菌的生理盐水清洗两次。将收集的细胞分别接种到固体斜面培养基上,28℃恒温培养48 h后于4℃冰箱中冷藏备用。
1.3.2 种子培养
挑取3环经活化的固体斜面酵母EC1118与酵母2323分别接种至250 mL摇瓶(装液量50 mL的YPD液体培养基),28℃、120 r/min培养24 h。
1.3.3 柠檬酸对酵母生长的影响
在YPD液体培养基中,分别添加0、0.02mol/L、0.10mol/L、0.20 mol/L、0.30 mol/L和0.40 mol/L柠檬酸,于装液量为30 mL/250 mL的摇瓶中,灭菌(115℃、20 min);分别接入1%的酿酒酵母EC1118与2323,置于28℃恒温培养箱中培养,摇床转速120 r/min,每隔3 h取样,分别考察两种酵母菌在不同柠檬酸浓度的YPD培养基中的生长情况。实验重复3次。
1.3.4 pH值对酵母生长的影响
在YPD液体培养基中添加1 mol/L的HCl,调节培养基初始pH值至7.00、4.50、3.33、2.83、2.63、2.45;添加0、0.02mol/L、0.10 mol/L、0.20 mol/L、0.30 mol/L和0.40 mol/L柠檬酸调节培养基初始pH值至7.00、4.50、3.33、2.83、2.63、2.45;于装液量为30 mL/250 mL摇瓶,灭菌(115℃,20 min);分别接入1%的酿酒酵母EC1118与2323,置于28℃恒温培养箱中,摇床转速120 r/min,每隔3 h取样,分别考察两种酵母菌在不同pH条件下的生长情况。实验重复3次。
1.3.5 柠檬酸根对酵母生长的影响
在YPD液体培养基中,分别添加0.02mol/L、0.10mol/L、0.20 mol/L、0.30 mol/L和0.40 mol/L柠檬酸,用5 mol/L NaOH溶液将培养基pH调至4.50,于装液量为30 mL/250 mL摇瓶,灭菌(115℃,20 min);分别接入1%的酿酒酵母EC1118与2323,置于28℃恒温培养箱中培养,摇床转速120 r/min,每隔3 h取样,以未加柠檬酸为对照组,分别考察两种酵母菌在不同浓度柠檬酸根条件下的生长情况。实验重复3次。
1.3.6 分析测定
取培养的液体种子1 mL置于试管中,用生理盐水进行适度稀释,在波长600 nm处比色测定吸光度值,并在显微镜下用血球计数板计算酵母浓度(CFU/mL),建立吸光度值与酵母浓度的回归方程。按照回归方程计算菌体浓度。
2 结果与分析
2.1 菌体浓度与吸光度值的关系
吸光度值与酵母浓度的回归方程,结果如图1所示。
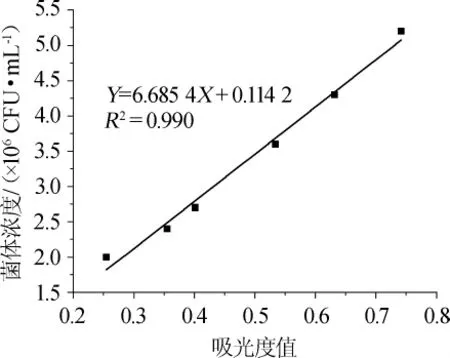
图1 吸光度值与菌体浓度的相关性Fig.1 The correlation between absorbance value and cell count
由图1可知,吸光度值与酵母浓度的回归方程为Y=6.685 4X+0.114 2,相关系数R2=0.990,表明在0.2~0.8范围内吸光度值与酵母浓度线性关系良好。
2.2 柠檬酸对酿酒酵母生长的影响
在果酒酿造过程中,酿酒酵母会面临果实中有机酸尤其柠檬酸的胁迫[24-25];本实验从5种酿酒酵母中筛选了两种具有代表性的菌种酿酒酵母EC1118和酿酒酵母2323,分别考察了柠檬酸添加量(0.02~0.4 mol/L)对两种酵母生长的影响,结果见图2。
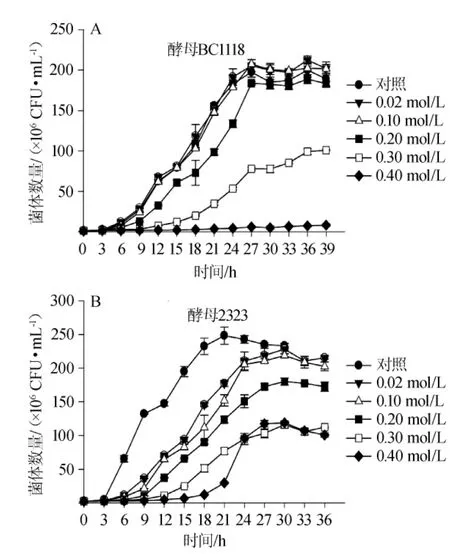
图2 柠檬酸添加量对酿酒酵母EC1118(A)与2323(B)生长的影响Fig.2 Effect of citric acid addition on the growth ofS.cerevisiae EC1118(A)and 2323(B)
由图2A可知,不同浓度柠檬酸对2种酵母生长规律的影响是不同的;柠檬酸添加量<0.10mol/L时,对酵母EC1118的生长影响不大,迟滞期为3 h,对酵母菌生长具有一定的促进作用,分析原因可能是低浓度柠檬酸作为碳源进入三羧酸循环被酵母生长利用[26-27];柠檬酸添加量增至0.20 mol/L时,酵母EC1118的生长受到抑制,菌体数量略有降低。柠檬酸添加量增至0.30 mol/L时,酵母EC1118的生长明显受到抑制,迟滞期延长至9 h,培养基中最大菌数明显减少;酵母EC1118在柠檬酸添加量0.40 mol/L的培养基中几乎停止生长。
由图2B可知,与未添加柠檬酸的酿酒酵母2323相比,培养基中添加柠檬酸(0.02~0.40 mol/L)后,酵母菌2323的生长明显受到抑制,延滞期延长,生长速率下降。柠檬酸添加量在0.02~0.10 mol/L范围内,酵母菌数量略有下降;当柠檬酸添加量增至0.40 mol/L时,酵母菌仍能缓慢生长,但生长受到明显抑制,酵母菌数量明显降低。结果表明,添加柠檬酸对不同酵母菌生长的影响是不同的,低浓度柠檬酸对酵母EC1118生长有一定促进作用,高浓度柠檬酸会抑制酿酒酵母的生长,随着柠檬酸添加量的不断增加,酵母生长受到的抑制程度也逐渐增加。
2.3 pH值对酿酒酵母生长的影响
柠檬酸属有机酸,培养基中添加柠檬酸会影响其初始pH值,会影响酵母菌的生长[6]。为进一步分析柠檬酸对酿酒酵母影响的机制,设计用盐酸调节培养基初始pH值分别至不同柠檬酸浓度对应的pH值,结果如图3所示。
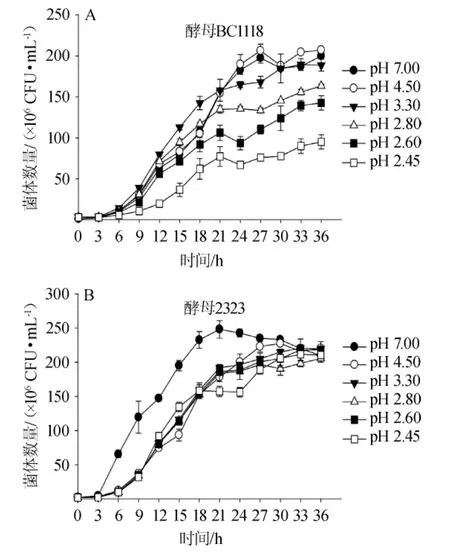
图3 pH值对酿酒酵母EC1118(A)与2323(B)生长的影响Fig.3 Effect of pH on the growth ofS.cerevisiaeEC1118(A)and 2323(B)
由图3A可知,随着pH值的降低,酿酒酵母EC1118生长抑制程度明显增强,菌体数量逐渐降低;当pH值为7.00与4.50时,酵母菌EC1118生长速率较接近;当pH≤2.80时,酵母EC1118生长受到明显抑制,表明酵母EC1118能够适应3.30~7.00的pH范围,低pH环境会明显抑制酵母生长。由图3B可知,pH值为7.00时的生长速率明显高于其他pH条件下的生长速率,初始pH在2.45~4.50条件下时,酵母2323生长速率较接近,在低pH条件下酸性环境部分抑制其生长,此研究结果与柠檬酸对应pH条件下的生长规律明显不同。由此可以看出,在相同pH条件下,不同种类的酸对酿酒酵母生长的抑制效应是不同的,高浓度柠檬酸对酿酒酵母的抑制效应可能不单独是由电离出的氢离子毒性引起的。
2.4 柠檬酸根对酵母生长的影响
为避免培养基中添加柠檬酸后溶液的低pH值对酵母生长产生抑制效应,用NaOH溶液将培养基pH值分别调至4.50,考察酵母EC1118和2323的生长规律,结果如图4所示。
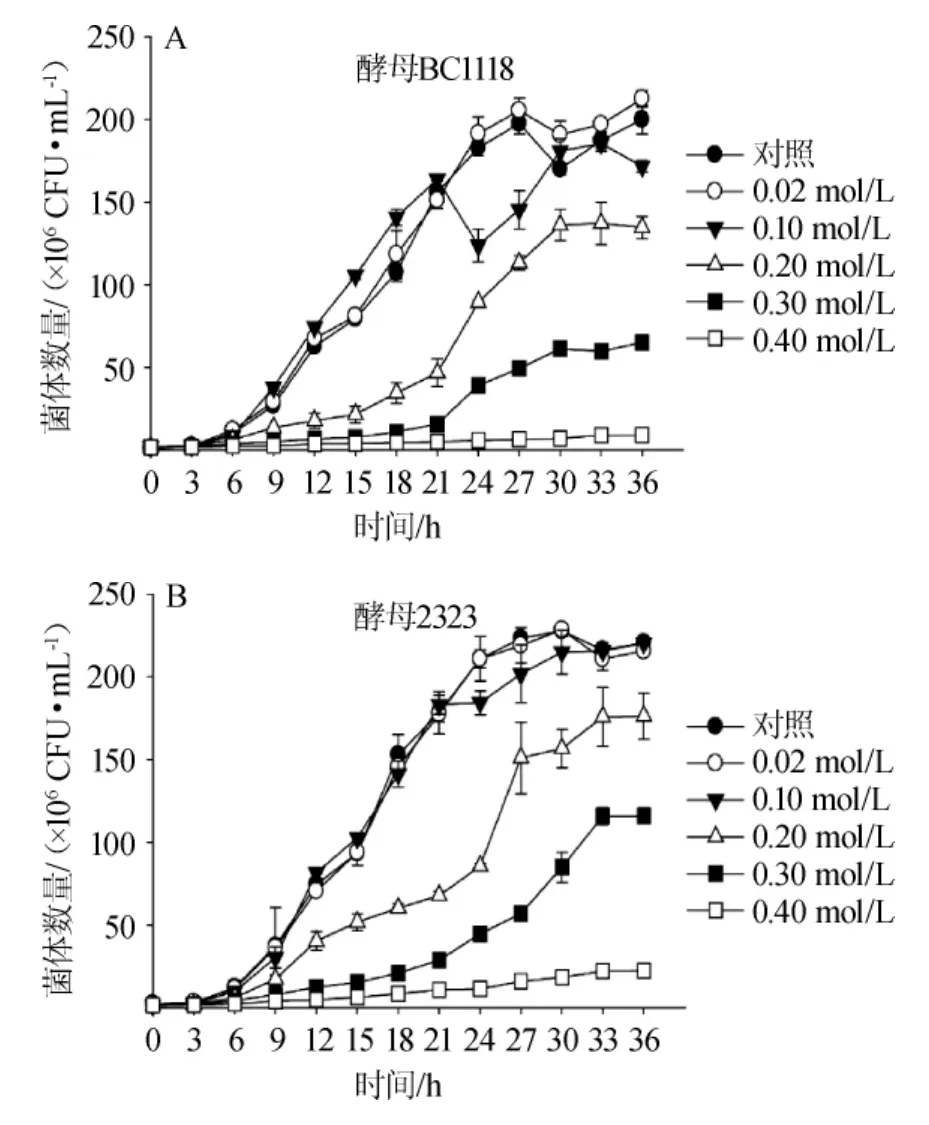
图4 柠檬酸根浓度对酿酒酵母EC1118(A)与2323(B)生长的影响Fig.4 Effect of citrate concentration on the growth ofS.cerevisiae EC1118(A)and 2323(B)
由图4A可知,与未添加柠檬酸的对照组相比,当柠檬酸根浓度为0.02 mol/L时,促进了酵母EC1118的生长。当柠檬酸根浓度分别为0.10 mol/L、0.20 mol/L、0.30 mol/L时,酵母EC1118的生长受到抑制,当浓度增加至0.40 mol/L时,酵母EC1118几乎停止生长,与未回调pH值的酵母生长呈现类似的规律。低浓度柠檬酸根(0.2 mol/L)能够促进酵母EC1118的生长,其可以作为碳源,进入三羧酸循环,被酵母生长利用。
由图4B可知,与未添加柠檬酸的对照组相比,添加不同浓度柠檬酸(0.02~0.40 mol/L)再回调pH至4.5后,酵母2323生长受到明显抑制,与直接添加不同浓度柠檬酸呈现类似的规律。随着柠檬酸根浓度的增加,对酵母2323生长抑制效应逐渐增加;当柠檬酸根浓度为0.4 mol/L时,酵母2323的生长基本停滞。分析原因可能是柠檬酸是较强的有机酸,在溶液中电离出部分氢离子和柠檬酸根离子,柠檬酸根离子能够螯合培养基中的钙离子、镁离子等金属离子,进一步抑制酵母的生长[22]。
柠檬酸在液体培养基中会电离出部分氢离子,引起培养基pH降低,改变酵母的生长环境[28],从而影响酵母的生长;电离出的部分柠檬酸根离子会螯合培养基中的金属离子,影响酵母生长所必需的金属离子[29-30],同时会打破柠檬酸电离平衡而电离出更多氢离子,进一步抑制酵母的生长。因此,液体培养基中高浓度柠檬酸对微生物生长的抑制效应是氢离子和柠檬酸根的叠加影响。
3 结论
研究了S.cerevisiaeEC1118与2323在不同柠檬酸浓度、pH值和柠檬酸根培养条件下的生长规律。高浓度柠檬酸(0.10~0.40 mol/L)会抑制两种酿酒酵母生长,pH值≤2.80时,酿酒酵母的生长均受到抑制。其抑制效应是柠檬酸根与氢离子的叠加效果,且柠檬酸根的影响占主导。本研究为进一步解除有机酸对酿酒酵母抑制效应以及创制新型果酒提供一定理论依据。
[1]仇小妹,王 英,董明盛,等.优良降酸酵母菌的筛选及发酵性能[J].食品科学,2014,35(5):160-164.
[2]杨 华,刘亚娜,郭德军.红豆越橘酿酒优良降酸酵母的筛选及分离鉴定[J].食品科学,2016,37(9):175-180.
[3]BAUER F F,PRETORIUS I S.Yeast stress response and fermentation efficiency:how to survive the making of wine-a review[J].S Afr J Enol Viticult,2000,21:27-51.
[4]ARROYO-LÓPEZ F N,ORLIC′S,QUEROL A,et al.Effects of temperature,pH and sugar concentration on the growth parameters ofSaccharomyces cerevisiae,S.kudriavzeviiand their interspecific hybrid[J].Int J Food Microbiol,2009,131(2-3):120-127.
[5]CARDONA F,CARRASCO P,PEREZ-ORTIN J E,et al.A novel approach for the improvement of stress resistance in wine yeasts[J].Int J Food Microbiol,2007,114(1):83-91.
[6]刘兴艳,贾 博,赵 芳,等.酿酒酵母对弱有机酸胁迫的应激机制研究进展[J].食品与发酵工业,2013,39(6):125-129.
[7]ISMAIL K S K,SAKAMOTO T,HASUNUMA T,et al.Zinc,magnesium,and calcium ion supplementation confers tolerance to acetic acid stress in industrialSaccharomyces cerevisiaeutilizing xylose[J].Biotechnol J,2015,9(12):1519-1525.
[8]ULLAH A,ORIJ R,BRUL S,et al.Quantitative analysis of the modes of growth inhibition by weak organic acids inSaccharomyces cerevisiae[J].Appl Environ Microbiol,2012,78(23):8377-8387.
[9]MARTANI F,FOSSATI T,POSTERI R,et al.Different response to acetic acid stress inSaccharomyces cerevisiaewild-type and lascorbic acid producing strains[J].Yeast,2014,30(9):365-378.
[10]SERRANO R,KIEKKAND-BRANDT MC,FINK G R.Yeast plasma membrane ATPase is essential for growth and has homology with(Na++K+),K+-and Ca2+-ATPase[J].Nature,1986,319,20:689-693.
[11]ORIJ R,BRUL S,SMITS G J.Intracellular pH is a tightly controlled signal in yeast[J].Biochim Biophysica Acta,2011,1810(10):933-944.
[12]GREGORI C,SCHÜLLER C,FROHNER I E,et al.Weak organic acids trigger conformational changes of the yeast transcription factor War1 in vivo to elicit stress adaptation[J].J Biol Chem,2008,283(37):25752-25764.
[13]ULLAH A,ORIJ R,BRUL S,et al.Quantitative analysis of the modes of growth inhibition by weak organic acids inSaccharomyces cerevisiae[J].Appl Environ Microbiol,2012,78(23):8377-8387.
[14]ABBOTT D A,SUIR E,DUONG G H,et al.Catalase overexpression reduces lactic acid-induced oxidative stress inSaccharomyces cerevisi-ae[J].Appl Environ Microbiol,2009,75(8):2320-2325.
[15]WAN C,ZHANG M,FANG Q,et al.The impact of zinc sulfate addition on the dynamic metabolic profiling ofSaccharomyces cerevisiae subjected to long term acetic acid stress treatment and identification of key metabolites involved in the antioxidant effect of zinc[J].Metallomics Integ Biometal Sci,2015,7(2):322-332.
[16]YOSHIYAMA Y,TANAKA K,YOSHIYAMA K,et al.Trehalose accumulation enhances tolerance ofSaccharomyces cerevisiaeto acetic acid[J].J Biosci Bioeng,2015,119(2):172-175.
[17]CORDENTE A G,CORDEROBUESO G,PRETORIUS I S,et al.Novel wine yeast with mutations in YAP1 that produce less acetic acid during fermentation[J].FEMS Yeast Res,2013,13(1):62-73.
[18]STRATFORD M,LAMBERT R J W.Weak-acid preservatives:mechanisms of adaptation and resistance by yeasts[J].Food Aust,1999,51:26-29.
[19]YIN X,LI J,SHIN H D,et al.Metabolic engineering in the biotechnological production of organic acids in the tricarboxylic acid cycle of microorganisms:advances and prospects[J].Biotechnol Adv,2015,33(6):830-841.
[20]OH E J,KWAK S,KIM H,et al.Transporter engineering for cellobiose fermentation under lower pH conditions by engineeredSaccharomyces cerevisiae[J].Bioresource Technol,2017,245:1469-1475.
[21]MIRA N P,TEIXEIRA M C,SÁ-CORREIA I.Adaptive response and tolerance to weak acids inSaccharomyces cerevisiae:a genome-wide view[J].Omics J Integr Biol,2010,14(5):525-540.
[22]NIELSEN M K,ARNEBORG N.The effect of citric acid and pH on growth and metabolism of anaerobicSaccharomyces cerevisiaeandZygosaccharomyces bailiicultures[J].Food Microbiol,2007,24(1):101-105.
[23]LAWRENCE C L,BOTTING C H,ANTROBUS R,et al.Evidence of a new role for the high-osmolarity glycerol mitogen-activated protein kinase pathway in yeast:Regulating adaptation to citric acid stress[J].Mol Cell Biol,2004,24:3307-3323.
[24]文连奎,赵 薇,张 微,等.果酒降酸技术研究进展[J].食品科学,2010,31(11):325-328.
[25]孙洪浩,颜雪辉,张家庆,等.果酒降酸方法研究进展[J].酿酒,2013,40(6):27-30.
[26]杨文洲,薛永常,农晓帆,等.柠檬酸对啤酒酵母TCA循环中有机酸的影响[J].大连工业大学学报,2007,26(4):313-315.
[27]BARNETT J A,KORNBERG H L.The utilization by yeasts of acids of the tricarboxylic acid cycle[J].J Gen Microbiol,1960,23(1):65-82.
[28]WANG B,CHEN J,LI H,et al.Pellet-dispersion strategy to simplify the seed cultivation ofAspergillus nigerand optimize citric acid production[J].Bioprocess Biosyst Eng,2017,40(1):1-9.
[29]李文玲.酵母活力测定方法的建立及高活力酵母的培养[D].无锡:江南大学,2011.
[30]刘兴艳.低pH对酿酒酵母酒精发酵的影响及酵母应答酸胁迫机制初探[D].北京:中国农业大学,2015.
