植物乳杆菌与解淀粉芽孢杆菌对食醋风味的影响
2018-07-09邝格灵孔德华潘志辉赵国忠
邝格灵,张 洁,孔德华,潘志辉,赵国忠*
(1.天津科技大学 食品工程与生物技术学院 教育部食品营养与安全重点实验室,天津 300457;2.天津市食品安全检测技术研究院,天津 300308;3.广州致美斋食品有限公司,广东 广州 510403)
食醋酿造历史悠久,是一种以淀粉质原料为主,通过微生物发酵酿造的酸性调味品。食醋不仅作为调味品,还有各种食疗、保健作用(如软化血管、调节血糖、预防动脉硬化、抗氧化、抗癌、降血压、治疗糖尿病等[1-3])。我国食醋行业经过上千年的不断发展,已成为生物技术产业的重要组成部分。固态发酵食醋由于大多使用多菌种固态开放式的发酵工艺,酿造微生物除了醋酸菌之外,还有乳酸菌、芽孢杆菌、酵母菌和霉菌等微生物的存在,不同微生物代谢产生的产物不同,如醋酸菌可将乙醇转化为乙酸,构成食醋的主体骨架;乳酸菌可以代谢产生乳酸,改善食醋的口感,同时包括乳酸在内的众多有机酸可以对乙酸起到缓冲作用,降低乙酸的刺激口感,使得食醋更加柔和。除此之外,芽孢杆菌、酵母菌和霉菌等微生物在酿醋过程中代谢产生的众多风味物质也可为食醋风味的形成奠定基础。
植物乳杆菌(Lactobacillus plantarum)是一种常见于发酵制品中的乳酸菌,能定植于肠道发挥有益作用[4]。在食品发酵过程中,乳酸菌将食品原料中的糖转变为乳酸,同时产生抗菌肽、胞外多糖和其他代谢产物[5]。不仅如此,乳酸菌还能够产生水解蛋白质的酶,将其水解为氨基酸,让食醋的风味变得更加醇厚和柔和[6]。除此之外,在乳酸菌的生长代谢过程中还能产生少量的乳酸链球菌素,能有效抑制杂菌及多种致病菌的生长,提高产品的稳定性[7]。
芽孢杆菌(Bacillus)是一类好氧菌,可以通过三羧酸循环(tricarboxylic acid cycle,TCA)途径产生有机酸。这些有机酸不仅可以使食醋中的刺激酸味变得柔和,还可以通过酯化反应与乙醇形成各酯类,从而增加食醋的风味。另外,它们还具有利用甘油产酸的能力,表明这些菌株具有多元醇的脱氢酶,此酶可将甘油脱氢产生具有淡薄的甜味的二羟基丙酮,让食醋的香味变得更加浓厚[8]。此外,芽孢杆菌产生的大量蛋白酶可以将蛋白质水解成氨基酸,这些氨基酸对食醋的风味和颜色起着至关重要的作用[9]。芽孢杆菌在食醋中的应用研究较少,但是它却是醋酸发酵中不可缺少的微生物类群之一,在食醋酿造中,其对食醋的酸度、风味的提高具有一定的作用[10]。吕艳歌等[11]采用16S rDNA序列分析法对山西老陈醋醋醅的产酸菌株进行鉴定,经分析后发现,醋醅中产酸菌主要以醋酸杆菌、乳酸杆菌和芽孢杆菌为主。本研究通过将植物乳杆菌(Lactobacillus plantarum)和解淀粉芽孢杆菌(Bacillusamyloliquefaciens)添加到食醋发酵体系当中,采用气相色谱-质谱法(gas chromatography-massspectrometer,GC-MS)研究其风味物质变化,进而提高食醋的品质,对于我国食醋工业的发展具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与材料
酿酒酵母(Saccharomyces cerevisia)、醋酸菌(acetic acid bacteria)、植物乳杆菌(Lactobacillus plantarum)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens):天津科技大学菌种保藏中心提供。
山西老陈醋醋醅来源:采集于山西双园醋业有限公司。
1.1.2 化学试剂
α-淀粉酶(5万 U/g)、糖化酶(5万U/g):河北亚信生物科技有限公司;三磷酸脱氧核糖核苷(deoxyribonucleoside triphosphate,dNTP)、TaqDNA聚合酶(250 U):北京全式金生物技术有限公司。
1.1.3 培养基
MRS培养基[12-13]:蛋白胨10 g/L,牛肉膏10 g/L,酵母膏5 g/L,柠檬酸氢二铵2 g/L,葡萄糖20 g/L,乙酸钠5 g/L,磷酸氢二钾2 g/L,硫酸镁0.58 g/L,硫酸锰0.25 g/L,琼脂18 g/L,pH 6.2~6.6。
1.2 仪器与设备
QP2010型气质联用仪:日本SHIMADZU有限公司;T100 Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国伯乐 BIO-RAD公司;5424R离心机:德国Eppendorf有限公司;FE-20精密pH计、ME3002E电子分析天平:梅特勒-托利多仪器有限公司;MLS-3750立式压力蒸汽灭菌锅:日本SANYO公司;SP-250生化培养箱:南京实验仪器厂;TG-20离心机:长沙英泰仪器有限公司;IKA VORTEX 1漩涡振荡器:广州易测仪器有限公司;DK-S12恒温水浴锅:上海森信实验仪器有限公司;DK-8D电热恒温水槽:上海精密实验设备有限公司。
1.3 方法
1.3.1 菌种的分离鉴定
菌株的分离[14-15]:先取1 mL醋醅样品加入9 mL灭过菌的生理盐水中,然后依次做梯度稀释至10-1、10-2、10-3、10-4、10-5、10-6,然后用灭过菌的移液管吸取100 μL各浓度醋醅移至MRS培养基上,在37℃的恒温培养箱中培养24~36 h后,观察单菌落,挑取不同形态、大小的单菌落进行划线纯化,3次分离纯化之后,对菌株进行革兰氏染色镜检,并确定菌株形态,将镜检菌株接种在MRS液体培养基里于试管中进行传代培养到20代,置于4℃冰箱保存,备用。
菌株的鉴定:对筛选得到的乳酸菌进行16S rDNA序列分析,确定其种属。将活化好的菌液进行菌株的全基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)的提取[16],然后对基因组DNA的16S rDNA区域进行PCR扩增,上游引物27F序列5′-AGAGTTTGATCCTGGCCTCA-3′,下游引物1492R序列:5′-GGTTACCTTGTTACGACTT-3′,扩增片段为1 500 bp。PCR体系50 μL:10×buffer 5 μL;脱氧核糖核苷酸三磷酸(dNTP)5 μL;上游引物(25 μmol/L)0.5 μL;下游引物(25μmol/L)0.5μL;TaqDNA聚合酶(250 U)0.5 μL;模板DNA 1.5μL;ddH2O37μL。PCR扩增条件为:95℃、3min;95 ℃、10 s;55 ℃、30 s;72 ℃、1 min;72 ℃、5 min,2~4反应步骤进行30个循环。扩增产物进行琼脂糖凝胶电泳检测其纯度及浓度,将达到测序要求的扩增产物送至上海华大基因进行测序,将测序结果在美国国立生物技术信息中心(national center for biotechnology information,NCBI)上BLAST进行比对,并确定其种属。
1.3.2 食醋的固态发酵
①米粉液化糖化
食醋固态发酵参考文献[17]。按照1∶2(g∶mL)的料水比将大米粉调成浆液,用碳酸钠调节浆液pH值为6.4±0.1。按照100 U/g大米粉添加α-淀粉酶,90℃保温液化20 min,然后降温至(59±1)℃。用浓H2SO4调节pH值至4.5±0.1,按照100U/g大米粉添加糖化酶,60℃保温糖化4h,糖化完成后,降温至(36±1)℃,即为糖化液。
②酒精发酵阶段

表1 酒精发酵阶段植物乳杆菌和解淀粉芽孢杆菌添加量Table 1 Addition ofL.plantarumandB.amyloliquefaciensduring alcohol fermentation process
按照2%葡萄糖水溶液与安琪酵母粉1∶7的质量比,将安琪酵母粉在30℃条件活化20 min,添加2%活化酵母液到糖化液中,再添加50%麸皮至糖化液中。添加L.plantarum和B.amyloliquefaciens菌液进行酒精发酵,添加量见表1。在(30±1)℃条件下进行酒精发酵,发酵时间为5 d。
③醋酸发酵阶段
酒精发酵结束后,按照3%添加量添加活化好的醋酸菌,进行醋酸发酵。醋酸发酵期间,每天分3个时间段(8:00am、1:00pm和5:00pm)观察温度计温度的上升情况,当温度升至40℃时,需要进行第一次搅拌,以后每天翻醅一次,控温在42℃以下。搅拌数次后,醅料温度下降至35~38℃,此间,利用酸碱中和的原理[18],并以pH为指示终点每天测醋醅的酸度,当酸度不再上升或稍有下降的时候,结束醋酸发酵。
1.3.3 食醋发酵过程中的风味成分分析
①样品预处理
先将固相微萃取(solid phase micro extraction,SPME)萃取头置于气相色谱仪进样口处,于250℃条件下充分老化至没有杂质峰。准确量取5 mL检测醋样置于15 mL的样品瓶中,加入固体氯化钠25 g,盖上盖子并将其置于40℃恒温水浴中。将SPME萃取头插入样品瓶的顶空部分,对样品中的香气成分吸附富集40 min后将SPME萃取头从样品瓶中拔出,插入GC-MS的气相色谱进样口中,推出纤维头,并于250℃条件下解吸2 min,准备样品检测和分析。
②气相色谱检测条件
DB-170色谱柱(30 m×0.25 mm×0.25 μm);载气为氦气(纯度99.999%);流量为1 mL/min;分流比5∶1,SPME萃取头插入进样孔,温度240℃解吸5 min。程序升温:起始温度35℃,保持30 min,以5℃/min的速度升至120℃,保持1min,再以10℃/min的速度升至220℃,保持2 min。
③质谱测定条件
质谱仪的接口温度为280℃,离子源温度为220℃,溶剂延迟时间1.5 min,电离方式为电子电离(electron ioniza tion,EI),电子能量70 eV,扫描质量范围43~450 amu。通过HP-Chemstation System工作站采集和处理数据,先由谱库初步鉴定成分,结合化学成分的保留时间、质谱、实际成分和保留指数等进行定性,采用面积归一化法进行定量。
2 结果与分析
2.1 乳酸菌及芽孢杆菌的分离及鉴定
本研究从食醋醋醅样品中分离得到18株菌,编号为C1~C18。采用16S rDNA序列分析法对筛选到的菌株进行序列分析,得到序列后在NCBI上进行BLAST比对分析,发现其中3株菌为霉菌,另外15株细菌与NCBI上的物种相似度均>98%。将该15株细菌构建系统发育树,结果见图1所示,这18株菌分别鉴定为:乳酸杆菌(Lactobacillus acidophilus),副干酪乳杆菌(Lactobacillus paracasei),植物乳杆菌(Lactobacillus plantarum),解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和瑞士乳杆菌(Lactobacillus helveticus)。
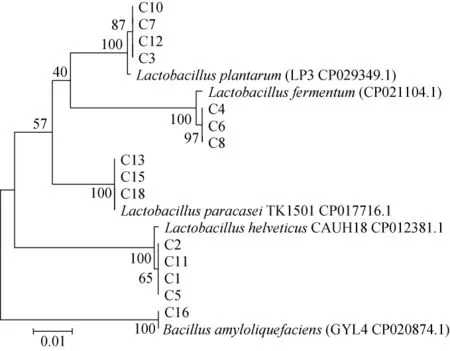
图1 菌株C1~C18 16S rDNA的系统发育树Fig.1 Phylogenetic tree of strains C1-C18 16S rDNA
菌株分解淀粉的能力在食醋发酵行业起非常重要的作用,另外,由于食醋发酵属于植物类发酵,因此本实验选择解淀粉芽孢杆菌(Bacillus amyloliquefaciens)C16和植物乳杆菌(Lactobacillus plantarum)C7为研究对象,其培养24 h后的菌落形态描述见表2。由表2可知,菌株C7直径大小约0.5 mm,边缘平滑,凸起,呈乳白色。菌株C16直径大小约2 mm,边缘褶皱,不规则,半透明。

表2 菌株C7和C16菌落形态描述Table 2 Description of colony morphology of strain C7 and C16
2.2 食醋发酵过程中的风味物质分析
采用GC-MS分别对食醋的酒精发酵过程,醋酸发酵初期,醋酸发酵完成时样品中的挥发性香气成分变化进行了分析。对空白对照组、3%C7、3%C16、2%C7+1%C16、1.5%C7+1.5%C16和1%C7+2%C16样品中香味物质总数和不同酒醅香味物质类型相对含量进行比较分析。
2.2.1 酒精发酵阶段风味物质分析
发酵至第5天时,酒精发酵已基本完成,取其样品进行GC-MS检测,分析其风味物质组成及含量,结果分别见表3和图2。
由表3可知,对照组、3%C7、3%C16、2%C7+1%C16、1.5%C7+1.5%C16和1%C7+2%C16的样品中香味物质总数分别为31、31、30、38、35、29种。
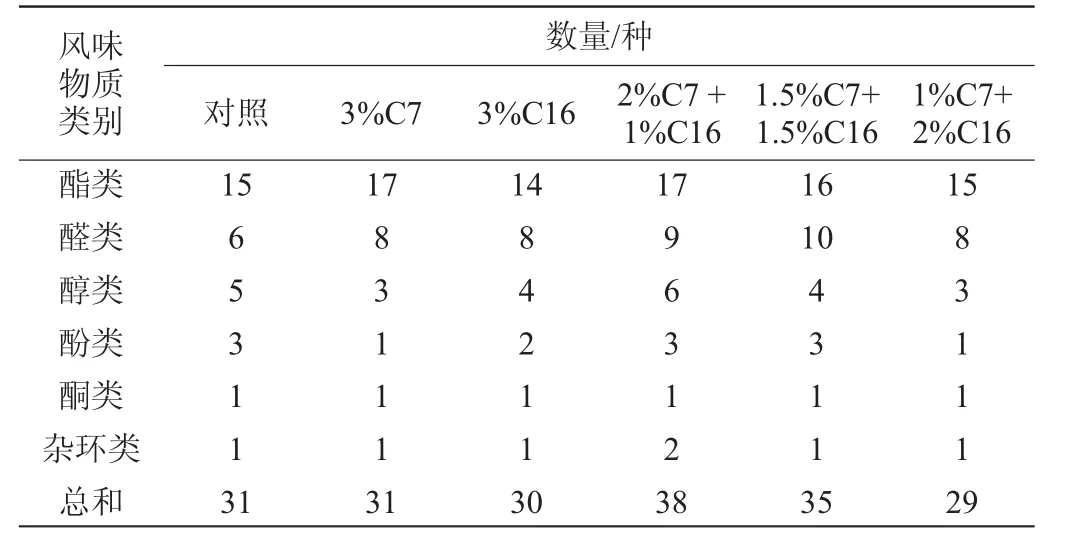
表3 菌株C7和C19对醋醅风味的影响Table 3 Effect of strain C7 and C19 on the flavor substances of vinegarPei
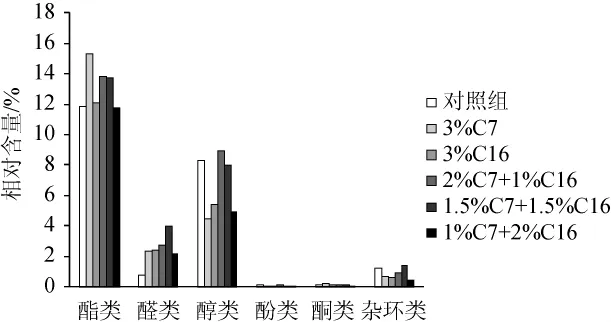
图2 酒精发酵第5天六种不同醋醅风味物质类型相对含量的比较Fig.2 Comparison of the relative contents of flavor substances in six types of vinegarPeion the fifth day of alcohol fermentation
由图2可知,醋酸发酵初期,6个样品风味中占据主体地位的是酯类,醇类和醛类,且3%C7的酯的相对含量是6个样品中最高的,达到15.3%,而1%C7+2%C16的酯的相对含量最低,为11.75%;醇类物质含量最高的是2%C7+1%C16组,为8.93%,最低的是3%C7的样品,为4.43%;醛类物质含量最高是添加1.5%C7+1.5%C16样品,为4.01%,最低的是对照样品,相对含量为0.74%。因此,在酒精发酵阶段,相对高含量的植物乳杆菌在混菌体系中产生更多的酯类和醇类风味物质。
2.2.2 醋酸发酵第1天风味物质分析

表4 菌株C7和C19对醋酸发酵开始时风味物质的影响Table 4 Effect of strain C7 and C19 on the flavor substances at the beginning of acetic fermentation
由表4可知,对照组、3%C7、3%C16、2%C7+1%C16、1.5%C7+1.5%C16和1%C7+2%C16的样品中香味物质总数分别为43、50、39、41、45、39种。
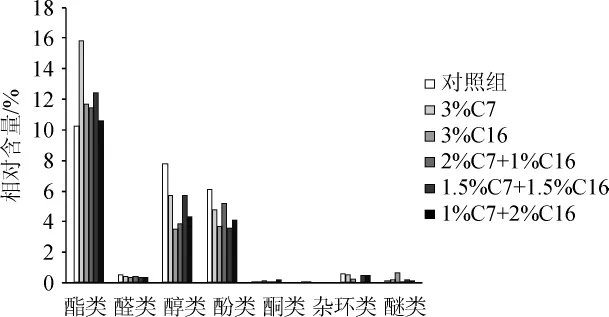
图3 醋酸发酵第1天六种不同醋醅风味物质类型相对含量的比较Fig.3 Comparison of the relative contents of flavor substances in six types of vinegarPeion the first day of acetic fermentation
由图3可知,在醋酸发酵初期,6个样品风味中占据主体地位的是酯类物质,醇类和酸类,且3%C7中酯类香味物质相对含量最多,高达15.83%,而对照组酯类香味物质相对含量最少,仅为10.28%;醇类物质含量最高的是对照组,相对含量为7.78%,最低的是3%C16组,仅占3.54%;酸类物质相对含量最高的是对照组,占6.1%,最低的是1.5%C7+1.5%C16组,占3.6%。
2.2.3 醋酸发酵结束时(醋酸发酵终止)风味物质分析
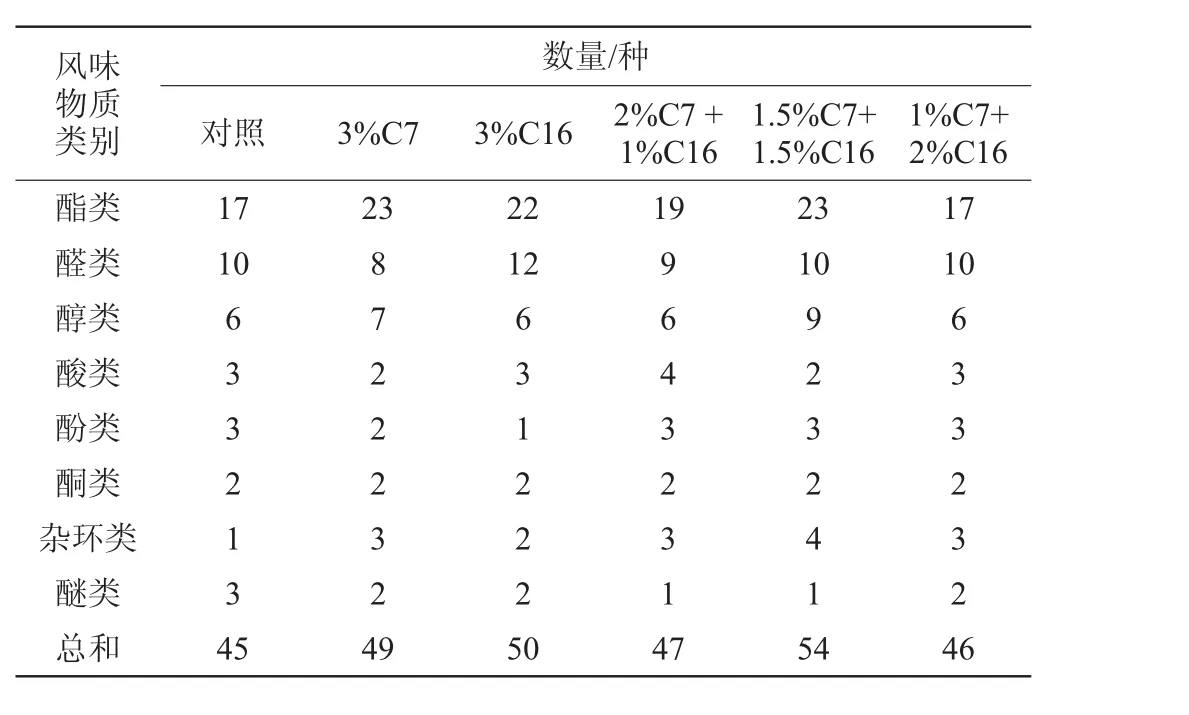
表5 菌株C7和C19对醋酸发酵终止时风味物质的影响Table 5 Effect of strain C7 and C19 on the flavor substances at the end of acetic fermentation
由表5可知,醋酸发酵阶段随着发酵时间的延长,样品中风味物质的种类明显增多。对照组、3%C7、3%C16、2%C7+1%C16、1.5%C7+1.5%C16和1%C7+2%C16的样品中香味物质总数分别为45、49、50、47、54、46种。
由图4可知,在醋酸发酵末期,除了对照组样品风味中占据主体位置的是酸类以外,其余5个样品风味中占据主体地位的均是酯类物质。6个样品中酯类的相对含量最高的是3%C7组,占27.06%,最低的是对照组,酯类物质含量仅占18.62%,主要是乙酸乙酯。酸类的相对含量最高的是对照组,占26.62%,主要是乙酸,而最低的是1.5%C7+1.5%C16组,占17.26%;醇类物质相对含量最高的是1.5%C7+1.5%C16组,占10.75%,最低的是3%C16组,仅占4.51%;醛类物质含量最高的是3%C16的样品,最低的是空白样品。C7的添加,明显提高了酯类的种类和含量。
3 结论
本研究从食醋醋醅中分离得到L.plantarum和B.amyloliquefaciens。利用这两株菌与醋酸菌进行多菌种固态发酵,利用GC-MS检测发酵过程中的风味物质。结果表明,在食醋发酵的混菌体系中,相较于空白对照组,其他组中香味物质的总数都高于空白样品,而当添加1.5%植物乳杆菌和1.5%解淀粉芽孢杆菌时,可以得到最多数量的香味物质(54种)和最高的醇类物质含量(10.75%),其中含量最高为3-甲基-1-丁醇(6.13%);其他5个样品酯类物质的含量也明显高于空白样品,当添加3%植物乳杆菌的时候,可以得到最高的酯类物质含量(27.06%),主要是乙酸乙酯;当添加3%解淀粉芽孢杆菌的时候,可以得到最高的醛类物质含量(3.05%),其中含量最高为苯甲醛(0.57%)。因此,该两株菌有助于食醋风味物质的改善,拟为酿造风味优良、营养丰富的食醋提供理论依据。
[1]霍君生.食醋的医疗保健功能(上)[J].上海调味品,1999(2):30-31.
[2]霍君生.食醋的医疗保健功能(中)[J].上海调味品,1999(3):30-31.
[3]霍君生.食醋的医疗保健功能(下)[J].上海调味品,1999(3):27-28.
[4]ROSS P R,MORGAN S,HILL C.Preservation and fermentation.Past,present and future[J].Food Microbiol,2002,79(1-2):3-16.
[5]CAPLICE E,FITZAGERALD G F.Food fermentation role of microorganisms in food production and preservation[J].Food Microbiol,1999,50:131-149.
[6]ZHAOHL,LIZX,YANGXM,et al.Vinegar identification byultraviolet spectrum technology and pattern recognition method[J].Scientia Magna,2009,5(3):104-111.
[7]刘杨岷,张家骊,王利平,等.食醋风味成分比较研究[J].食品与机械,2005(5):40-42.
[8]李宜丰,王海洪,温丽琴,等.食醋酿造中芽孢杆菌的活动及其作用初探[J].中国调味品,1988(5):25-27.
[9]聂志强,汪越男,郑 宇,等.传统食醋酿造过程中微生物群落的多样性及功能研究进展[J].中国酿造,2012,31(7):4-5.
[10]吕艳歌,马海乐,李云亮,等.山西老陈醋产酸菌的分离鉴定及系统学分析[J].中国食品学报,2013,13(12):163-171.
[11]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995:343-345.
[12]张 娜,郭元昕,王泽建,等.一株乳酸菌的鉴定,生物学特性与发酵培养基优化研究[J].食品工业,2012(12):136-140.
[13]吴方琴,王 超,潘苗苗,等.农家酸菜中优质乳酸菌的筛选分离及其产酸性能优化[J].中国酿造,2011,30(10):100-103.
[14]方 祥,胡文锋,张辉华,等.乳酸菌的分离,鉴定及其生长特性[J].中国微生物学杂志,2000,12(5):262-264.
[15]许 伟.镇江香醋醋酸发酵过程微生物群落及其功能分析[J].无锡:江南大学,2011.
[16]MILLER D N,BRYANT J E,MADSEN E L,et al.Evaluation and optimization of DNA extraction and purification procedures for soil and sediment samples[J].Appl Environ Microbiol,1999,65(11):4715-4724.
[17]杜连启,吴燕涛.酱油食醋生产新技术[M].北京:化学工业出版,2010:212-217.
[18]ZHALNINA K,DIAS R,QUADROS P D D,et al.Soil pH determines microbial diversity and composition in the park grass experiment[J].Microbial Ecol,2014,69(2):395-406.
