奥沙利铂联合紫杉醇脂质体治疗晚期胃癌的疗效分析
2018-07-09毛爱芹张育荣苏爱江梁平魏广占
毛爱芹,张育荣,苏爱江,梁平,魏广占
北京市朝阳区三环肿瘤医院内科,北京100021
胃癌是消化系统最常见的恶性肿瘤之一,中国以及日本、韩国是胃癌的高发地区,中国每年新发病例约40万例,占世界总发病例的42%,并且胃癌的总病死率亦呈上升趋势,中国每年约有35万例患者因胃癌死亡,居恶性肿瘤死因的第3位[1-2]。早期胃癌患者进行根治性手术切除后的5年生存率可达90%[3],但由于胃癌早期的临床症状不明显,以及普查不足等原因,约80%的患者就诊时已属于晚期[4]。中国胃癌的早期检出率不足10%,单纯手术治疗的总生存率仅为20%[5]。
目前,对于晚期胃癌尚无标准化的治疗方案,常结合术前或术后辅助放化疗的方法来提高患者的生存率[6]。常用的胃癌化疗药物主要包括紫杉类、铂类、氟尿嘧啶及其衍生物和拓扑异构酶抑制药等,这几类药物组成的各种联合化疗方案不同程度地延长了胃癌患者的生存时间[7],但统一标准的胃癌化疗方案仍未达成共识。本研究分析了奥沙利铂联合紫杉醇脂质体方案和奥沙利铂联合替吉奥方案治疗晚期胃癌的临床疗效及不良反应,现报道如下。
1 对象与方法
1.1 研究对象
选取2014年1月至2016年10月于北京市朝阳区三环肿瘤医院进行治疗的46例晚期胃癌患者作为研究对象。纳入标准:①年龄≥18岁;②根据国际抗癌联盟/美国癌症联合委员会发布的胃癌第8版TNM分期标准[8]判定为ⅢB~Ⅳ期胃癌;③至少有1个可评估的病灶;④半年内未接受过化疗;⑤卡氏功能状态(Karnofsky performance status,KPS)评分>60分;⑥血常规、肝肾功能、心电图等无明显异常;⑦无明显化疗禁忌证;⑧临床资料完整。排除标准:①对化疗药物过敏者;②合并其他恶性肿瘤者;③合并血液系统、免疫系统或内分泌系统严重疾病者;④进食困难或恶液质患者。46例晚期胃癌患者中,胃癌根治术后复发者7例,初次诊断即为晚期胃癌而无法手术者39例。采用随机数字表法将46例晚期胃癌患者随机分为A组和B组,每组23例。其中,A组患者接受奥沙利铂联合紫杉醇脂质体方案化疗,B组患者接受奥沙利铂联合替吉奥化疗。两组患者的年龄、性别、病理类型、KPS评分、TNM分期等基线资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究经医院医学伦理委员会批准通过,所有研究对象均对本研究知情同意并签署知情同意书。
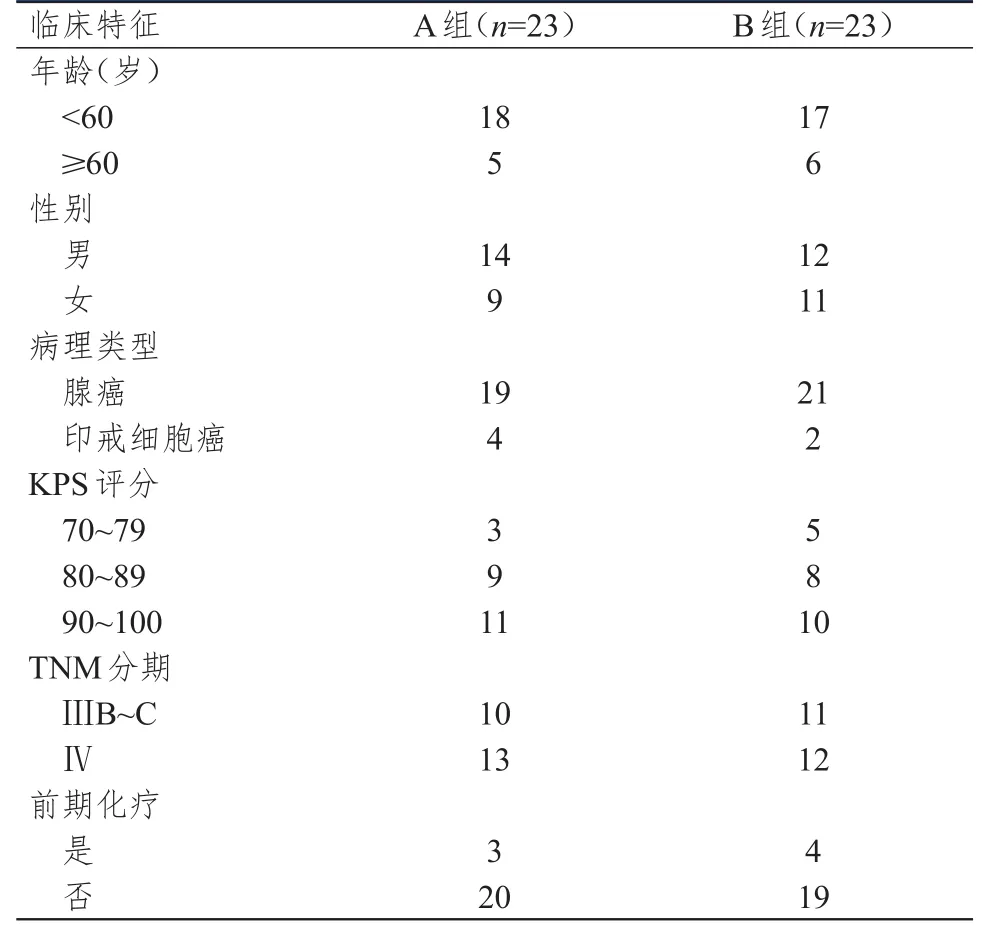
表1 两组患者的基本临床特征
1.2 治疗方案
全部患者使用的奥沙利铂给药剂量均为130 mg/m2,第1天静脉滴注。A组的化疗方案:紫杉醇脂质体135 mg/m2,第1天和第8天静脉滴注;B组的化疗方案:替吉奥40~60 mg,早餐和晚餐后1 h服用,每天2次,第1天至第14天。两组均以21天为1个周期,至少完成2个周期的治疗。化疗前常规给予地塞米松(5 mg,静脉注射)和西米替丁(300 mg,静脉滴注)进行预处理,化疗前后检查血常规和肝肾功能等,如有异常,给予对应处理。每2个周期后对患者进行全面复查并评价临床疗效,每个周期后均对患者进行不良反应评价。
1.3 评价标准
1.3.1 疗效评价 可测量病灶的近期疗效评价按照实体瘤疗效评定标准(response evaluation criteria in solid tumors,RECIST)[9]进行评价,分为完全缓解(complete response,CR),所有可见靶病灶完全消失,无新病灶出现;部分缓解(partial response,PR),肿瘤靶病灶的最长直径之和减少30%以上;疾病稳定(stable disease,SD),肿瘤靶病灶既未缩小到PR,也未增大到疾病进展(progression disease,PD);PD,肿瘤靶病灶最长直径之和增加至少20%或出现1个或多个新病灶。其中,CR和PR至少持续4周。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%。疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。
1.3.2 不良反应评价 每个治疗周期记录患者不良反应的发生情况,不良反应按照美国国立癌症研究所常见不良反应分级标准进行评价,分为0~4级。
1.4 随访
治疗结束后,每2个月进行1次随访,随访截止日期为2017年7月30日。记录晚期胃癌患者的总生存期(overall survival,OS)和无进展生存期(progression free survival,PFS)。OS定义为患者从化疗开始之日起至患者死亡或末次随访之日的时间;PFS定义为患者自治疗开始至第1次发生PD或任何其他原因死亡的时间。
1.5 统计学分析
采用SPSS 22.0软件对数据进行统计分析。计数资料以例数或率(%)表示,组间比较采用χ2检验-或Fisher确切概率法;计量资料以均数±标准差(±s)表示,组间比较采用t检验;等级有序分类变量的比较采用秩和检验;PFS和OS生存分析采用Kaplan-Meier法。以P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效的比较
所有患者均至少完成2个周期的化疗;A组患者平均化疗3.4个周期,B组患者平均化疗3.3个周期。A组患者的ORR为47.8%,DCR为78.3%;B组患者的ORR为43.5%,DCR为69.6%;两组患者的ORR和DCR比较,差异均无统计学意义(χ2=0.088,P=0.767;χ2=0.451,P=0.502)。A组患者和B组患者的临床疗效比较,差异无统计学意义(Z=0.703,P=0.482)。(表2)
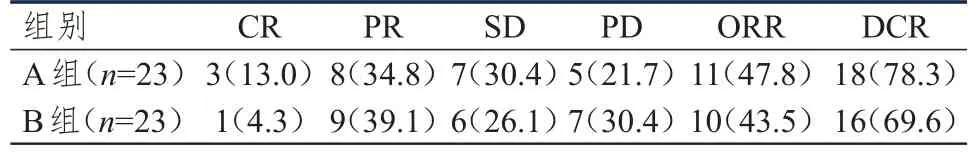
表2 两组患者的近期疗效[ n(%)]
2.2 生存情况的比较
截至2017年7月30日,A组患者的随访时间为2~12个月,中位随访时间为6.5个月;B组患者的随访时间为1~12个月,中位随访时间为7个月。随访期间,A组和B组各有1例和2例患者中途失访,失访率分别为4.3%和8.7%。A组患者的中位OS为9.4个月(95%CI:7.9~10.9个月),B组患者的中位OS为9.5个月(95%CI:8.1~10.8个月),两组比较,差异无统计学意义(χ2=0.012,P=0.911),详见图1。A组患者的中位PFS为6.9个月(95%CI:6.2~7.8个月),长于B组患者的5.4个月(95%CI:4.0~5.9个月),差异有统计学意义(χ2=4.102,P=0.048),详见图2。
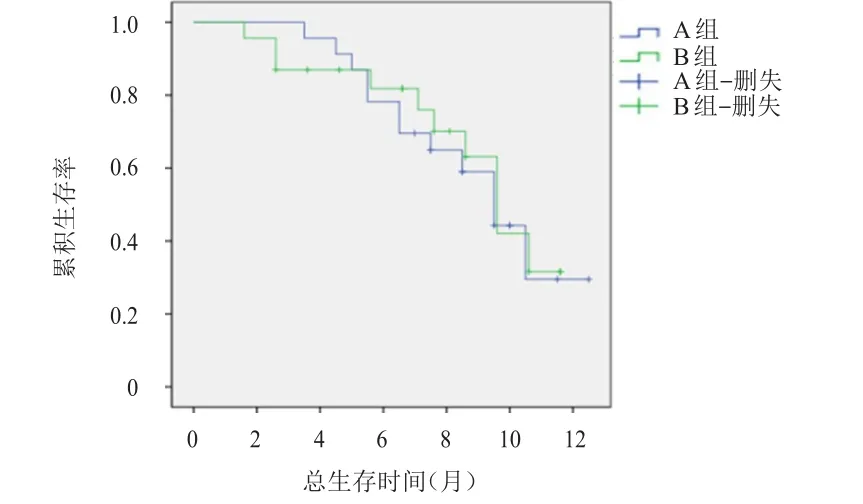
图1 两组患者的总生存曲线

图2 两组患者的无进展生存曲线
2.3 不良反应发生情况的比较
化疗后,两组患者的不良反应主要集中发生于血液系统、消化系统和神经系统,并且主要为1~2级不良反应。两组患者的中性粒细胞减少、血小板减少、贫血、疲劳乏力、腹泻、关节肌肉疼痛、恶心呕吐以及神经毒性的发生率比较,差异均无统计学意义(P>0.05)。(表3)
3 讨论
中国属于胃癌发病率和病死率均较高的国家,根据中国肿瘤登记年报及卫生统计年鉴数据,恶性肿瘤中胃癌的发病率位居第2位,病死率位居第3位,而且仍呈上升趋势[10]。对于不可手术切除的晚期胃癌患者,通常采用姑息性的化疗方法,大部分患者能够通过化疗缓解症状并获益,然而单药化疗对晚期胃癌的效果有限,联合化疗更能够延长晚期胃癌患者的生存期,并改善患者的生活质量[11]。
目前对于胃癌尚无统一的化疗标准,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)胃癌指南[12]建议使用紫杉醇联合顺铂、顺铂联合氟尿嘧啶、奥沙利铂联合氟尿嘧啶等方案,每个月化疗1次,通常进行1~2次,并且于化疗结束后2周视患者情况进行根治性胃癌切除术。Cunningham等[11]观察了化疗联合手术治疗对进展期胃癌患者的临床疗效,观察组接受3个周期的化疗后实施胃癌切除手术,术后继续给予3个周期术后化疗;而对照组患者仅接受胃癌根治术治疗。结果发现,观察组患者的5年总生存率及无进展生存率高于对照组,复发率低于对照组,说明化疗在胃癌治疗过程中发挥了重要作用。
针对胃癌的一线化疗药物包括铂类、氟尿嘧啶类和紫杉类,其中,奥沙利铂属于第3代水溶性铂类化合物,可通过产生水化衍生物有效抑制肿瘤细胞DNA的合成,可作用于多种肿瘤,与顺铂相比,它对胃癌的疗效和安全性更好[13-14]。紫杉醇被广泛应用于胃癌的治疗,能够抑制肿瘤细胞的有丝分裂,诱导胃癌细胞凋亡,紫杉醇脂质体则是将紫杉醇包封在新型药物载体中,增强其水溶性,并减少药物的变态反应,同时脂质体本身具有被动靶向作用,可提高药物疗效,减少不良反应[15]。替吉奥属于第4代氟尿嘧啶类口服抗癌药物,与5-氟尿嘧啶持续静脉滴注的疗效类似,它由替加氟、吉美嘧啶及奥替拉西钾按照1.0∶0.4∶1.0摩尔浓度比例组成,其中,替加氟在体内可转化为氟尿嘧啶,并具有较高的口服利用度;吉美嘧啶可抑制氟尿嘧啶的分解,维持肿瘤组织中较高的血药浓度;奥替拉西钾可通过抑制乳清酸磷酸核糖转移酶活性,阻碍氟尿嘧啶的磷酸化,从而减轻胃肠不良反应[16]。
有研究表明,替吉奥联合紫杉醇与替吉奥联合奥沙利铂化疗的疗效近似,且不良反应均可很好耐受[17],又有研究报道奥沙利铂和氟尿嘧啶具有协同作用,而替吉奥中的替加氟是氟尿嘧啶的前体药物,在肿瘤内转化为氟尿嘧啶,因此,奥沙利铂可能与替吉奥亦具有协同作用[16]。本研究分别采用奥沙利铂联合紫杉醇脂质体和奥沙利铂联合替吉奥两种化疗方案治疗晚期胃癌,其中,奥沙利铂联合紫杉醇脂质体方案的ORR和DCR分别为47.8%和78.3%,中位OS和中位PFS分别为9.4个月和6.9个月;而奥沙利铂联合替吉奥方案的ORR和DCR分别为43.5%和69.6%,中位OS和中位PFS分别为9.5个月和5.4个月;两种方案治疗晚期胃癌的近期疗效及中位OS比较,差异均无统计学意义(P>0.05),但奥沙利铂联合紫杉醇脂质体方案的中位PFS长于奥沙利铂联合替吉奥方案(P=0.048)。
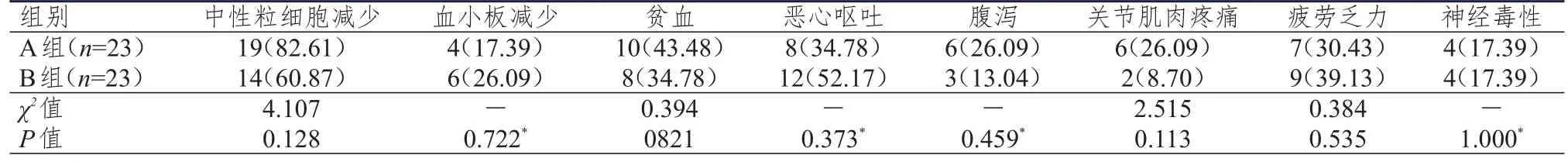
表3 两组患者不良反应发生率的比较[ n(%)]
本研究发现,两组患者各不良反应的发生率比较,差异均无统计学意义(P>0.05)。晚期胃癌患者多数具有体质差和化疗耐受性差等特点,而奥沙利铂联合替吉奥方案引起的中性粒细胞减少、血小板减少和贫血等不良反应相对较轻,患者耐受性更好,因此更适合于体质较差的患者,但许多晚期胃癌患者可能出现幽门梗阻而无法进食,此时口服替吉奥有困难,则更适合接受奥沙利铂联合紫杉醇脂质体化疗方案。
此外,本研究中尽管奥沙利铂联合紫杉醇脂质体治疗组患者的ORR和DCR均高于奥沙利铂联合替吉奥组,但差异无统计学意义,可能是由于本研究纳入的患者数量较少,因此有待于扩大样本量以及延长随访时间以进一步深入研究,为提高晚期胃癌患者的治疗效果提供更好的临床依据。
[1]邹文斌,李兆申.中国胃癌发病率及死亡率研究进展[J].中国实用内科杂志,2014,34(4):408-415.
[2]邹小农,孙喜斌,陈万青,等.2003—2007年中国胃癌发病与死亡情况分析[J].肿瘤,2012,32(2):109-114.
[3]Piazuelo MB,Correa P.Gastric cáncer:overview[J].Colomb Med(Cali),2013,44(3):192-201.
[4]季加孚.我国胃癌防治研究三十年回顾[J].中国肿瘤临床,2013,40(22):1345-1351.
[5]Yamamoto M,Rashid OM,Wong J.Surgical management of gastric cancer:the east vs.west perspective[J].J Gastrointest Oncol,2015,6(1):79-88.
[6]Yashiro M,Matsuoka T.Sentinel node navigation surgery for gastric cancer:overview and perspective[J].World J Gastrointest Surg,2015,7(1):1-9.
[7]Shitara K,Matsuo K,Mizota A,et al.Association of fluoropyrimidines,platinum agents,taxanes,and irinotecan in any line of chemotherapy with survival in patients with advanced gastric cancer[J].Gastric Cancer,2011,14(2):155-160.
[8]陕飞,李子禹,张连海,等.国际抗癌联盟及美国肿瘤联合会胃癌TNM分期系统(第8版)简介及解读[J].中国实用外科杂志,2017,37(1):15-17.
[9]Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[10]Lu Y,Liu Z,Zhang J.S-1 plus oxaliplatin vs.S-1 as firstline treatment in patients with previously untreated advanced gastric cancer:a randomized phase II study[J].J Chemother,2014,26(3):159-164.
[11]Cunningham D,Allum WH,Stenning SP,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl J Med,2006,355(1):11.
[12]National Comprehensive Cancer Network.Gastric cancer(Version 1.2015)[DB/OL].United States:NCCN,2015(2015-03-25)[2017-02-06].http://www.nccn.org/professionals/physiciangls/pdf/gastric.pdf.
[13]Huang J,Zhao Y,Xu Y,et al.Comparative effectiveness and safety between oxaliplatin-based and cisplatin-based therapy in advanced gastric cancer:a meta-analysis of randomized controlled trials[J].Oncotarget,2016,7(23):34824-34831.
[14]Koudelka Š,Mašek J,Korvasová Z,et al.Liposomes with high encapsulation capacity for paclitaxel:preparation,characterisation and in vivo anticancer effect[J].J Pharm Sci,2010,99(5):2309-2319.
[15]Yamada Y,Higuchi K,Nishikawa K,et al.Phase III study comparing oxaliplatin plus S-1 with cisplatin plus S-1 in chemotherapy-naïve patients with advanced gastric cancer[J].Ann Oncol,2015,26(1):141-148.
[16]Fushida S,Kinoshita J,Kaji M,et al.Phase I/II study of intraperitoneal docetaxel plus S-1 for the gastric cancer patients with peritoneal carcinomatosis[J].Cancer Chemother Pharmacol,2013,71(5):1265-1272.
[17]Yanli QU,Tang X,Tang Y.Clinical observation of S-1 combined with oxaliplatin or paclitaxel on advanced gastric cancer[J].Cancer Res Prevent Treat,2014,41(7):811-814.
