TSC2基因发生体细胞镶嵌突变导致结节性硬化症一例
2018-07-07王炫多丽娜杨勇曹先伟林志淼
王炫 多丽娜 杨勇 曹先伟 林志淼
100034北京大学第一医院皮肤科[王炫(现在南昌大学第一附属医院皮肤科,330006)、多丽娜、杨勇、林志淼];南昌大学第一附属医院皮肤科(曹先伟)
结节性硬化症(tuberous sclerosis complex,TSC)是一种常染色体显性遗传性疾病[1],典型的皮肤表现为色素减退斑、面部血管纤维瘤、胶原瘤和甲周纤维瘤。患者常伴有癫痫发作、精神异常等症状,皮肤损害往往是其最初的临床表现[2]。TSC致病基因为TSC1(染色体9q34)和TSC2(染色体16p13)[3⁃4],均属肿瘤抑制基因,分别编码错构瘤蛋白(hamartin)和马铃薯球蛋白(tuberin)。这两种蛋白可在体内形成二聚体,传导生长因子信号和能量调控信号[5],并与其他细胞骨架结构间具有相互作用。任一基因发生突变,都可能会破坏细胞骨架介导的细胞基质间黏附,导致mTOR通路活性增强,引发细胞增生失控,导致错构瘤发生[2,6]。基因检测是TSC确诊的金标准,然而即使结合能够检测大片段缺失和插入的多重探针连接扩增技术检测,整体检出率仅有80%左右[7]。本研究通过PCR和测序的方法确诊了1例体细胞镶嵌突变引起的TSC患者。
资料与方法
1.对象:患者男,汉族,28岁,出生时无异常,约3~4岁时面部出现多发血管纤维瘤,5~7岁时臀部出现结缔组织痣,16~17岁时左足趾甲出现甲周纤维瘤。患者无癫痫病史,智力正常。体检:患者面部中央可见多发粉红色丘疹,左颧部融合成约6~10 mm斑块(图1A);右侧腰部可见长约4 cm柳叶状白斑(图1B);右足第3趾甲可见约绿豆大肤色质硬结节,伴局部甲板轻度破坏(图1C)。腹部超声示肾部血管平滑肌脂肪瘤。根据国际TSC共识[7],该患者诊断为TSC。患者双亲健康,三代内直系或旁系血亲未见类似症状。本研究通过北京大学第一医院医学伦理委员会批准,患者签署知情同意书。
2.外周血DNA提取:取患者及其父母外周血3 ml,2%乙二胺四乙酸抗凝,采用DNA试剂盒(北京天根生化科技有限公司)提取基因组DNA,按照说明书步骤操作。检测所提DNA纯度和浓度,要求A260/A280范围1.7~ 1.9,浓度50~ 100 ng/μl。
3.瘤体DNA提取:取患者瘤体组织100 mg,采用DNA提取试剂盒(美国ThermoFisher公司)提取组织DNA。检验所提DNA纯度和浓度。200例无TSC病史的无关正常人基因组DNA作为对照。
4.PCR扩增目的基因:以200例无TSC病史的无关正常人基因组DNA作为对照。根据TSC1和TSC2基因序列(来源Ensemble),利用Primer⁃BLAST在线设计特异性引物,涵盖TSC1基因23个外显子和TSC2基因42个外显子及各自的侧翼序列,引物由北京天一辉远生物科技有限公司合成,引物序列:正向引物,5′⁃TGCAGTGCAGGAAAGGTAGG⁃3′;反向引物,5′⁃GCTGAGGGAGCCCCATATTC⁃3′。PCR 反应体系 25 μl,含基因组 DNA 50 ng,dNTPs 0.4mmol/L,MgCl22.0mmol/L,正反向引物各10μmol/L,Taq DNA聚合酶2.5 U。PCR反应条件:95℃预变性5 min,94℃变性30 s,62℃退火30 s(每个循环依次降 0.5℃),72℃延伸45 s,10个循环;94℃变性30 s,57℃退火30 s,72℃延伸45 s,35个循环;最后72℃延伸9 min,于4℃保存。取5 μl PCR扩增产物,2%琼脂糖凝胶电泳。
5.PCR产物序列测定及分析:所有PCR产物经纯化后送至北京天一辉远生物科技有限公司测序。测序结果采用Bioedit软件与Ensemble数据库(http://asia.ensembl.org/index.html)公布的 TSC1 和TSC2基因组正常序列进行比对。
6.TSC相关基因二代测序:委托北京迈基诺基因公司制备患者DNA文库,通过制定芯片对TSC1和TSC2目标基因的编码区及其侧翼序列进行捕获和富集,使用Illumina Hiseq2000高通量测序平台进行突变检测。
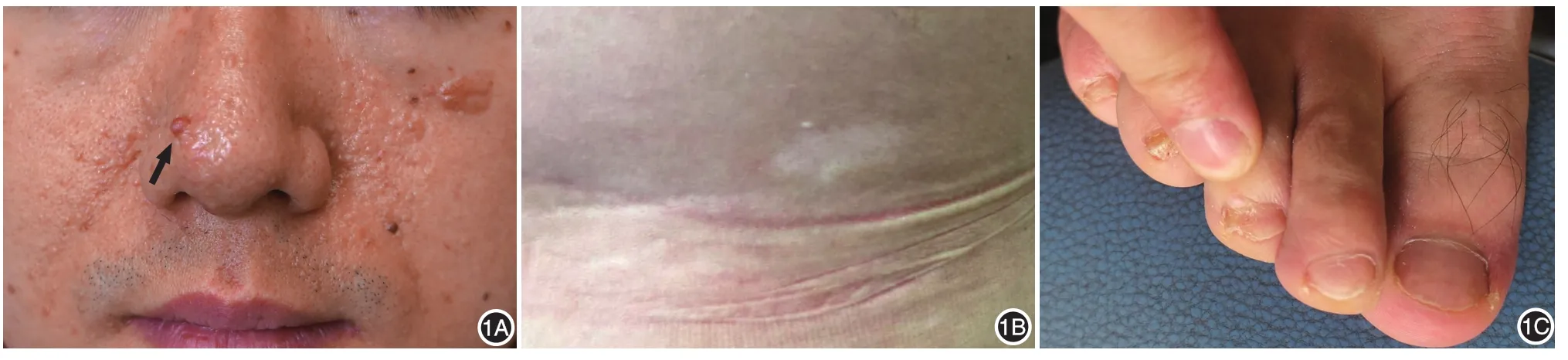
图1 患者皮损表现 1A:面部中央密集粉红色丘疹,左颧部融合成斑块。箭头指示提取皮损部位DNA进行突变位点验证所选瘤体;1B:腰部柳叶状白斑,长轴约4 cm;1C:右足第3趾甲绿豆大无色质硬结节
结 果
1.患者DNA基因筛查:患者外周血DNA TSC1及TSC2基因扩增产物经凝胶电泳均可见目标条带,参照基因组正常序列,人工进行比对未发现突变位点。外周血DNA行第二代测序发现TSC2基因中存在1个仅8%的低频变异位点(移码突变,核苷酸改变c.5130_5131insT,氨基酸改变p.V1711Cfs*18)。患者瘤体DNA扩增产物发现TSC2基因第40号外显子携带有TSC2 c.5130_5131insT突变,导致了低频移码突变峰。再次比对Sanger测序检测外周血DNA相应的TSC2位点,发现存在相同的低频率移码突变峰(因突变峰较低,人工核对时遗漏)。见图2。上述所有突变位点均经反向测序验证。TSC2 c.5130_5131insT突变位点尚未见于HGMD数据库、ExAC或1000G基因组计划数据库中。利用MutationTaster软件对该突变位点进行功能预测,预测分数为1(分数范围0~1,分数越高提示致病可能性越大)。
2.患者父母及无关对照基因筛查:患者父、母基因该位点测序未见异常(图2A、2B),200例无关正常对照未携带类似基因突变。
讨 论
TSC临床表现复杂,约85%的患者可以检测出突变基因,TSC1和TSC2基因突变分别占31%和69%,突变类型多样且无热点突变[8⁃9]。HGMD数据库内目前已报道的TSC1、TSC2基因突变导致TSC的分别有294种和940种,点突变为最主要的突变方式,分别占43%和50%,其次为小片段缺失突变,分别占比33%和21%,其余已有报道的6种突变类型以散发性病例多见,高达75%的病例来源于新的自发突变。虽然基因检测是TSC确诊的金标准,且目前并未有证据支持存在其他致病基因,但仍然有近20%的TSC患者在基因筛查过程中未能检测到TSC1和TSC2基因突变[9⁃10]。因而,对于临床症状明显而外周血DNA基因筛查阴性的患者,并不能排除TSC的诊断。而这种高比例的血液检测阴性结果,部分可能由镶嵌现象所致[9⁃11],“镶嵌现象”为个体发育期间一部分体细胞发生突变导致出现新的性状的现象。
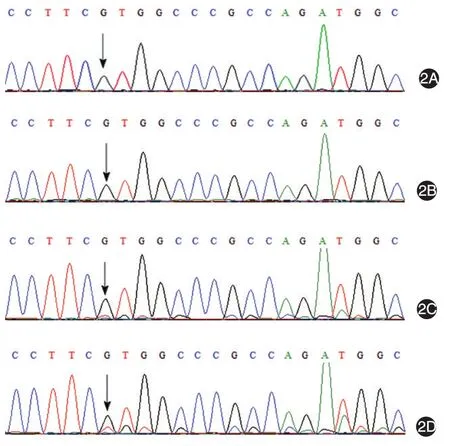
图2 TSC2基因测序图(箭头指示突变位点) 2A、2B:患者父母血液DNA测序,未携带样本TSC2基因c.5130⁃5131insT突变;2C:患者血液DNA测序,c.5130⁃5131insT突变位点后出现低频率移码突变峰;2D:患者瘤体真皮组织DNA测序,突变位点c.5130⁃5131insT后出现较血液DNA稍高频率的移码突变峰
本例患者未发生癫痫及相关精神症状但出现了TSC的典型皮损,可以确诊。最初利用患者血液样本提取的基因组DNA进行TSC1和TSC2基因的Sanger测序时,并未发现典型等高比例测序峰值的杂合性突变位点。在对患者外周血DNA进行高通量二代测序时,发现1个频率为8%的TSC2基因可疑突变位点c.5130_5131insT(p.V1711Cfs*18)。由于不能排除二代测序可能带来的低频率假阳性突变位点,我们进一步对患者脸部血管纤维瘤组织进行DNA提取,并进行相应位点的Sanger测序验证。同时回顾之前外周血DNA测序峰图,发现血液及组织DNA的Sanger测序图都存在低峰值的TSC2基因双峰区段,拆解双峰区段序列分析确定突变为c.5130_5131位点插入了1个碱基T而导致的移码突变,将导致终止密码子出现,最终影响蛋白的功能。该突变不仅未在患者父母及200个无关正常对照中发现,在109的千人基因组计划数据库和ExAC超过6万人的数据库中均未发现该突变位点(已上传dbSNP数据库,收录号BankIt2066017 Seq1 MG589762)。因此,我们最终认为发生在体细胞的TSC2基因c.5130_5131insT突变很可能是该患者的病因。该患者临床表现相对典型TSC患者轻(皮损较局限,未出现神经系统症状)很可能也和镶嵌突变仅累及部分而非全身细胞有关,因此临床表现轻,且皮疹更局限[12];同时,镶嵌现象在TSC中发生率高达26%,且迄今为止所有报道携带有TSC1或TSC2镶嵌突变的患者均可发现TSC症状[13]。因此,镶嵌现象的存在也对我们分析TSC患者基因型与临床表型之间关系提出了新的思路,对于临床表现已能明确诊断TSC而血液样本基因筛查呈阴性的患者,可以考虑取典型皮损组织DNA进一步筛查致病基因,排除体细胞镶嵌突变的可能。此外,对于此类存在镶嵌现象的疾病,在进行遗传咨询和产前诊断时需考虑其伴有生殖镶嵌体的可能,并进一步寻找能够更加快速可靠发现镶嵌突变的筛查方法。
综上,本研究检出的TSC2基因的c.5130_5131insT为新发现的突变,该病例的镶嵌现象及突变位点的发现不仅丰富了我们对TSC相关致病基因基因型与表型关系的认识,也为我们为患者提供遗传咨询和进行产前诊断提供了依据。
[1]HancockE,TomkinsS,SampsonJ,etal.Lymphangioleiomyomatosis and tuberous sclerosis[J].Respir Med,2002,96(1):7⁃13.
[2]De Waele L,Lagae L,Mekahli D.Tuberous sclerosis complex:the past and the future[J].Pediatr Nephrol,2015,30(10):1771⁃1780.doi:10.1007/s00467⁃014⁃3027⁃9.
[3]European Chromosome 16 Tuberous Sclerosis Consortium Identifi⁃cation and characterization of the tuberous sclerosis gene on chromosome 16[J].Cell,1993,75(7):1305⁃1315.
[4]Povey S,Burley MW,Attwood J,et al.Two loci for tuberous sclerosis:one on 9q34 and one on 16p13[J].Ann Hum Genet,1994,58(Pt 2):107⁃127.
[5]Laplante M,Sabatini DM.mTOR signaling in growth control and disease[J].Cell,2012,149(2):274⁃293.doi:10.1016/j.cell.2012.03.017.
[6]Zech R,Kiontke S,Mueller U,et al.Structure of the tuberous sclerosis complex 2(TSC2)n terminus provides insight into complex assembly and tuberous sclerosis pathogenesis[J].J Biol Chem,2016,291(38):20008 ⁃20020.doi:10.1074/jbc.M116.732446.
[7]Krueger DA,Northrup H.Tuberous sclerosis complex surveillance and management:recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference[J].Pediatr Neurol,2013,49(4):255⁃265.doi:10.1016/j.pediatrneurol.2013.08.002.
[8]DiMario FJ,Sahin M,Ebrahimi⁃Fakhari D.Tuberous sclerosis complex[J].Pediatr Clin North Am,2015,62(3):633 ⁃648.doi:10.1016/j.pcl.2015.03.005.
[9]刘林莉,张正中.结节性硬化症致病基因及基因突变研究进展[J].实用皮肤病学杂志,2017,10(1):44⁃47.doi:10.11786/sypfbxzz.1674⁃1293.20170113.
[10]Krishnan A,Kaza RK,Vummidi DR.Cross⁃sectional imaging review of tuberous sclerosis[J].Radiol Clin North Am,2016,54(3):423⁃440.doi:10.1016/j.rcl.2015.12.003.
[11]冯建华,戴宇文,山本俊至.聚合酶链反应和单链构象多态性技术检测结节性硬化症的基因突变[J].中华皮肤科杂志,2002,35(5):399⁃399.doi:10.3760/j.issn:0412⁃4030.2002.05.024.
[12]Kwiatkowski D.TSC1,TSC2,TSC3?or mosaicism?[J].Eur J Hum Genet,2005,13(6):695⁃696.doi:10.1038/sj.ejhg.5201412.
[13]Roberts PS,Dabora S,Thiele EA,et al.Somatic mosaicism is rare in unaffected parents of patients with sporadic tuberous sclerosis[J].J Med Genet,2004,41(5):e69.
