胶原诱导性关节炎炎症条件下诱导的调节性T细胞与B细胞的相互作用①
2018-07-06杨懿铭邹和建万伟国
孔 宁 孙 娟 杨懿铭 邹和建 杨 洁 万伟国
(复旦大学附属华山医院风湿科,上海 200040)
类风湿关节炎(Rheumatoid arthritis,RA)是一种可以导致关节毁损、多脏器损害的系统性疾病,也是导致劳动力丧失的主要免疫性关节炎之一;T细胞和B细胞均参与了疾病的发生和发展[1,2]。B细胞,作为主要的免疫细胞之一,除了体液免疫,还在细胞免疫中发挥着重要作用。首先,B细胞可以作为抗原提呈细胞激活效应性T细胞分泌炎症因子,并且是效应性T细胞激活增殖的必需条件之一。取自μMT-/-NOD小鼠(缺乏B细胞的NOD小鼠模型)的T细胞与NOD小鼠(1型糖尿病的小鼠模型)的T细胞相比,丧失了对其自身抗原肽(GAD65)刺激的反应能力,不会进展为1型糖尿病[3],去除B细胞后,即便有其他抗原提呈细胞的辅助,T细胞的增殖能力仍明显减弱[4]。其次,B细胞是自身反应性CD4+T细胞激活的必需条件[5]。已知,RA经典的动物模型—胶原诱导性关节炎(Collagen-induced arthritis,CIA)的重要发病机制之一是淋巴细胞对自身抗原Ⅱ型胶原(Collagen Ⅱ,C Ⅱ)的免疫耐受异常,产生了针对CⅡ的特异性应答,抗原特异性的自身反应性CD4+T细胞被激活,在不同细胞因子的诱导下,分化成不同的效应性T细胞,包括Th17细胞、Th1细胞、Th2细胞等,并进一步分泌多种炎症因子,进而导致关节炎的发生和发展。尚有研究发现CD4+T细胞激活对B细胞的依赖仅表现在自身免疫性应答中[6,7]。再者,自身反应性CD4+T细胞尤其对表达共刺激分子(CD80、CD86)和MHC Ⅱ类分子的B细胞的刺激产生应答[8-10]。B细胞被激活后细胞表面共刺激分子(CD80、CD86)和MHC Ⅱ 类分子的表达会增加[11],转而发挥作为专业抗原提呈细胞的功能。
调节性T细胞(regulatory T cells,Tregs)作为发挥免疫抑制作用的T细胞亚群,对维持机体免疫稳态发挥着重要作用,其数量和/或功能的异常可导致自身免疫性疾病的发生[12],包括RA和CIA[13-18]。既往的研究已发现体外诱导的Tregs(induced T regulatory cells,iTregs)有着与体内天然的Tregs(natural T regulatory cells,nTregs)相似的表型和抑制功能,对CIA小鼠起到预防和早期治疗的作用[19,20];并且在已发病的关节炎小鼠体内,foxp3+细胞发生了明显的扩增[19],但扩增的机制尚不明确。有关Tregs免疫调节机制的研究发现,炎症环境下的BAFF转基因小鼠(BAFF,B cell activating factor belonging to TNF family,促进B细胞的成熟,维持B细胞的存活)体内,foxp3+Tregs扩增明显增多;而在B细胞缺乏的小鼠中,扩增现象消失[21];由此可见,炎症环境下体内Tregs的扩增依赖于B细胞。本研究拟探讨在CIA小鼠的炎症环境下,iTregs与B细胞间的相互作用,进一步理解iTregs对CIA小鼠的预防和早期治疗作用。
1 材料与方法
1.1材料
1.1.1实验动物 8周龄雄性DBA1/J小鼠购自上海斯莱克实验动物中心,饲养在室温,相对湿度(55±10)%,照明/黑暗为12 h/12 h环境中,自由摄食及饮水。
1.1.2实验试剂 牛Ⅱ型胶原(CⅡ,Chondrex,Redmond,WA,USA);完全弗氏佐剂(CFA,Difco,Detroit,MI,USA);不完全弗氏佐剂(IFA,Difco);CD4+T细胞分选试剂盒(Miltenyi Biotec Technology & Trading,Shanghai,China);抗CD25-PE单克隆抗体(BD Biosciences,San Jose,CA,USA);抗PE的磁珠(Miltenyi);抗CD62L-PE单克隆抗体、抗CD19-PE单克隆抗体(BD);10%胎牛血清(Invitrogen,Thermo Fisher Scientific Inc.,MA,USA);IL-2(R&D Systems,Minneapolis,MN,USA)、TGF-β(R&D Systems)和CD3/CD28单抗偶联磁珠(Miltenyi);CD4-FITC、CD25-PE(BD)和foxp3-APC(eBioscience,San Diego,CA,USA);CD80-FITC、CD86-FITC、MHCⅡ-FITC和CD19-APC(BD);羧基荧光素二醋酸盐琥珀酰亚胺酯(Carboxyfluorescein diacetate succinimidyl ester,CFSE,CellTraceTMCFSE Cell Proliferation Kit,Invitrogen,Germany);CTLA-4-PE(CTLA-4,Cytotoxic T lymphocyte-associated antigen-4,细胞T淋巴细胞相关抗原4,BD)。
1.2方法
1.2.1CIA模型的诱导 牛Ⅱ型胶原(CⅡ)和完全弗氏佐剂按照1∶1 的体积比充分乳化,50 μl乳化液在小鼠尾根部皮下注射;初次免疫后第21天,CⅡ和不完全弗氏佐剂按照1∶1的体积比充分乳化,50 μl乳化液在小鼠尾根部皮下注射,完成CIA模型的诱导。在二次免疫后,隔天,按既定评分标准[17]进行评分和记录。
1.2.2细胞制备 CD4+CD62L+CD25-T细胞的制备:无菌分离DBA1/J小鼠的脾脏,研磨得单个细胞悬液,裂解红细胞,采用CD4+T细胞分选试剂盒分选得CD4+T细胞;分选所得的CD4+T细胞与抗CD25-PE单克隆抗体孵育后,加入抗PE的磁珠,分选出CD4+CD25-T细胞。CD4+CD25-T细胞先后加入抗CD62L-PE单克隆抗体、抗PE的磁珠再次孵育后,分选得到CD4+CD62L+CD25-T细胞。
CIA B细胞(CIA-B)和正常B细胞(N-B)的制备:分别无菌分离DBA1/J小鼠或初次免疫后第35天已有关节炎发作的CIA小鼠的脾脏,研磨得单细胞悬液,裂解红细胞,加入抗CD19-PE单克隆抗体,然后与抗PE的磁珠共孵育后分选出CD19+细胞。
1.2.3细胞培养 经典iTregs的生成:分离自正常DBA1/J小鼠脾脏的CD4+CD62L+CD25-T细胞,采用RPMI1640、10%胎牛血清、40 U/ml IL-2、2 ng/ml TGF-β和CD3/CD28单抗偶联磁珠(细胞∶磁珠=4∶1)培养4 d。体外,不同B细胞诱导Tregs的生成:CD4+CD62L+CD25-T细胞分别与N-B和CIA-B以 1∶1 细胞比例在100 U/ml IL-2和5 ng/ml TGF-β条件下共培养3 d;收集细胞,标记CD4-FITC、CD25-PE和foxp3-APC,流式细胞仪检测CD4+CD25+foxp3+细胞的百分比。经典iTregs与CIA-B细胞共培养:经典iTregs与CIA-B以1∶1比例共培养,同时加入IL-2(100 ng/ml) 和CⅡ(200 ng/ml) 共培养 3 d,3 d后收集培养的细胞,分别标记CD80-FITC、CD86-FITC、MHCⅡ-FITC和CD19-APC,流式细胞仪分别检测CD80+CD19+、CD86+CD19+、MHCⅡ+CD19+细胞的百分比。
1.2.4细胞增殖实验 经典iTregs与CIA-B细胞共培养:iTregs标记CFSE,与CIA-B细胞以1∶1比例共培养;同时加入IL-2(100 ng/ml) 和CⅡ(200 ng/ml)共培养3 d,3 d后收集细胞,流式细胞仪检测CFSE+细胞的百分比。
1.2.5Transwell实验 经典iTregs与CIA-B以1∶1比例共培养,iTregs置于下层,CIA-B细胞置于上层;同时加入IL-2(100 ng/ml)和CⅡ(200 ng/ml) 共培养3 d,3 d后收集培养的细胞。①标记抗CTLA-4-PE,流式细胞仪检测CTLA-4+细胞的百分比;②分别标记CD80-FITC、CD86-FITC、MHCⅡ-FITC和CD19-APC,流式细胞仪分别检测CD80+CD19+、CD86+CD19+、MHCⅡ+CD19+细胞的百分比。
1.2.6抗体染色和流式细胞仪检测
1.2.6.1约1×106的培养细胞加入抗CD4-FITC和CD25-PE单抗孵育0.5 h后,1×PBS清洗,固定并破膜,加入抗foxp3-APC单抗孵育,1×PBS清洗后上机检测。
1.2.6.2约1×106的培养细胞分别加入抗CTLA-4-PE单抗孵育半小时,1×PBS清洗后上机检测;加入抗CD80-FITC和CD19-APC、抗CD86-FITC和CD19-APC、抗MHCⅡ-FITC和CD19-APC抗体,1×PBS清洗后上机检测。
2 结果
2.1CIA B细胞(CIA-B)较正常B细胞(N-B)诱导更多Tregs的生成 已知CIA-B共刺激分子表达上调而具有更强的抗原提呈能力,并且在已发病的CIA关节炎小鼠体内foxp3+细胞可以进一步扩增,由此本研究设立下述实验观察CIA-B对foxp3+细胞(Tregs)的诱导作用。将CD4+CD62L+CD25-细胞分别以CIA-B或N-B作为抗原提呈细胞,加以IL-2和/或TGF-β共培养3 d,收集培养的细胞,流式细胞仪检测CD25+foxp3+细胞的表达。如图1所示,CIA-B较N-B诱导更多的CD25+foxp3+细胞的生成[(54.497±1.830)% vs(45.783±0.484)%,P=0.010]。
2.2CIA-B促进iTregs的增殖并上调iTregs细胞表面CTLA-4的表达 观察CIA-B作为抗原提呈细胞是否可以直接作用于iTregs。将iTregs标记CFSE后与CIA-B按细胞数1∶1 的比例共培养3 d,实验分为iTregs组和iTregs+CIA-B组,3 d后收集细胞,流式细胞仪检测iTregs-CFSE的表达即iTregs的增殖;结果显示与CIA-B共培养后,iTregs的增殖明显增加[见图2A,(47.920±2.049)% vs(23.960±0.493)%,P<0.000 1]。另一组实验,将iTregs与CIA-B按细胞数1∶1的比例共培养3 d,实验分为iTregs+CIA-B组和iTregs+CIA-B Transwell组(iTregs+CIA-B T),3 d后收集细胞,流式细胞仪检测CTLA-4的表达;结果显示与CIA-B共培养后,iTregs细胞表面CTLA-4的表达上调,并且该作用通过iTreg与CIA-B细胞间的直接接触而实现[见图2B,(76.147±4.338)% vs(5.910±0.565)%,P<0.000 1]。
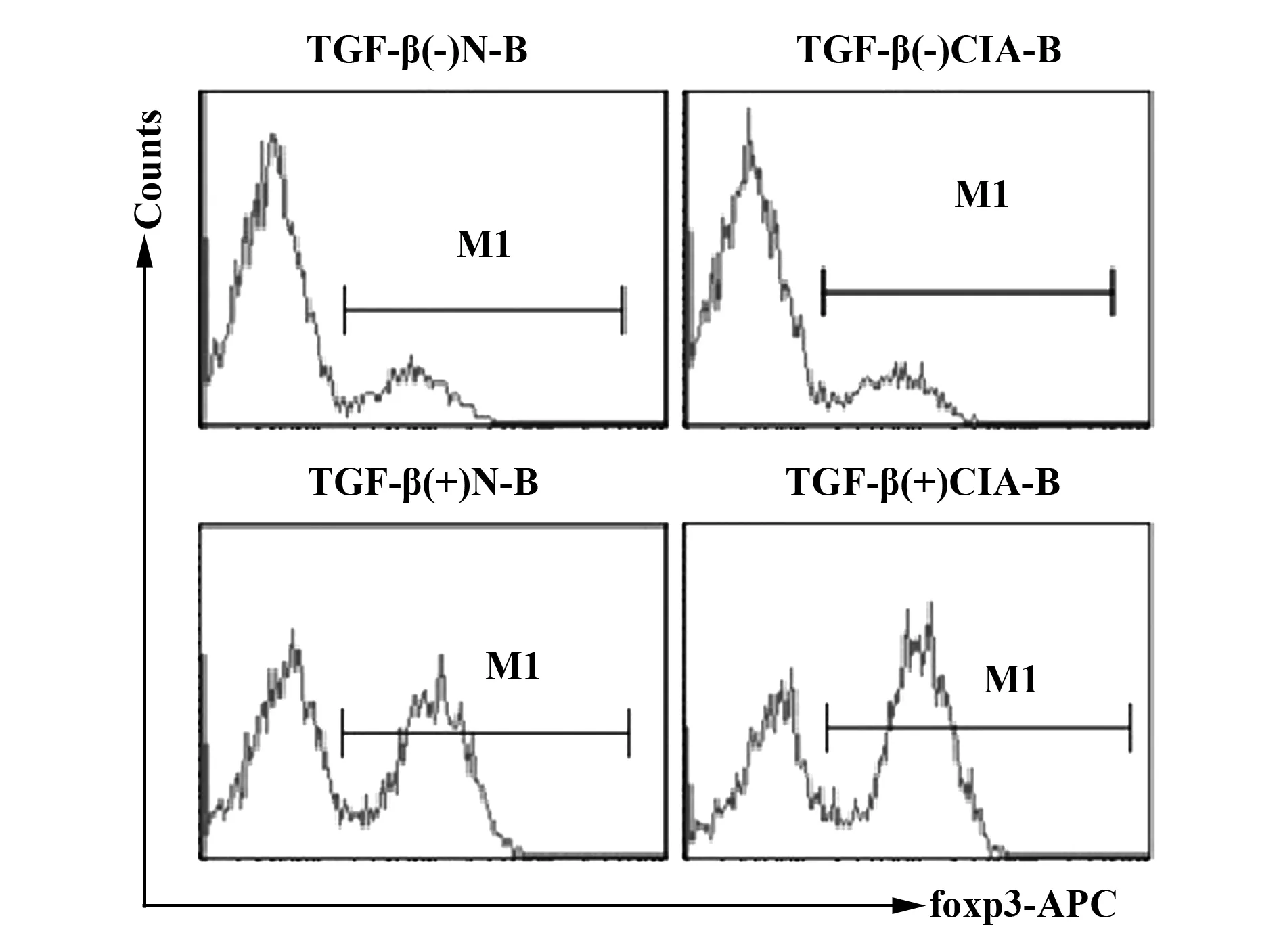
图1 CIA-B较N-B诱导更多Tregs的生成Fig.1 CIA-B induced more Tregs production than N-B
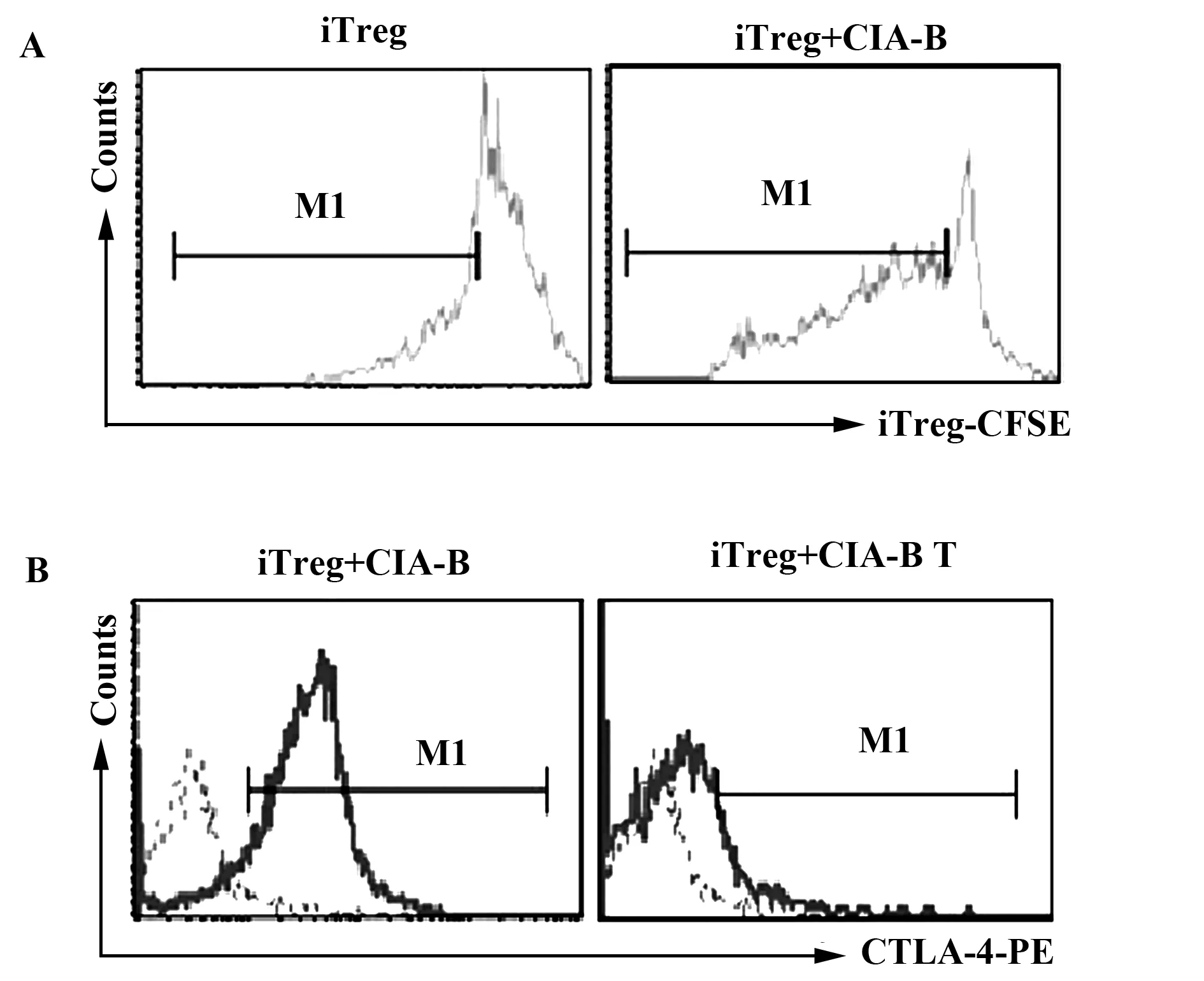
图2 CIA-B促进iTregs的增殖并上调iTregs细胞表面CTLA-4的表达Fig.2 CIA-B promoted iTregs proliferation and CTLA-4expression
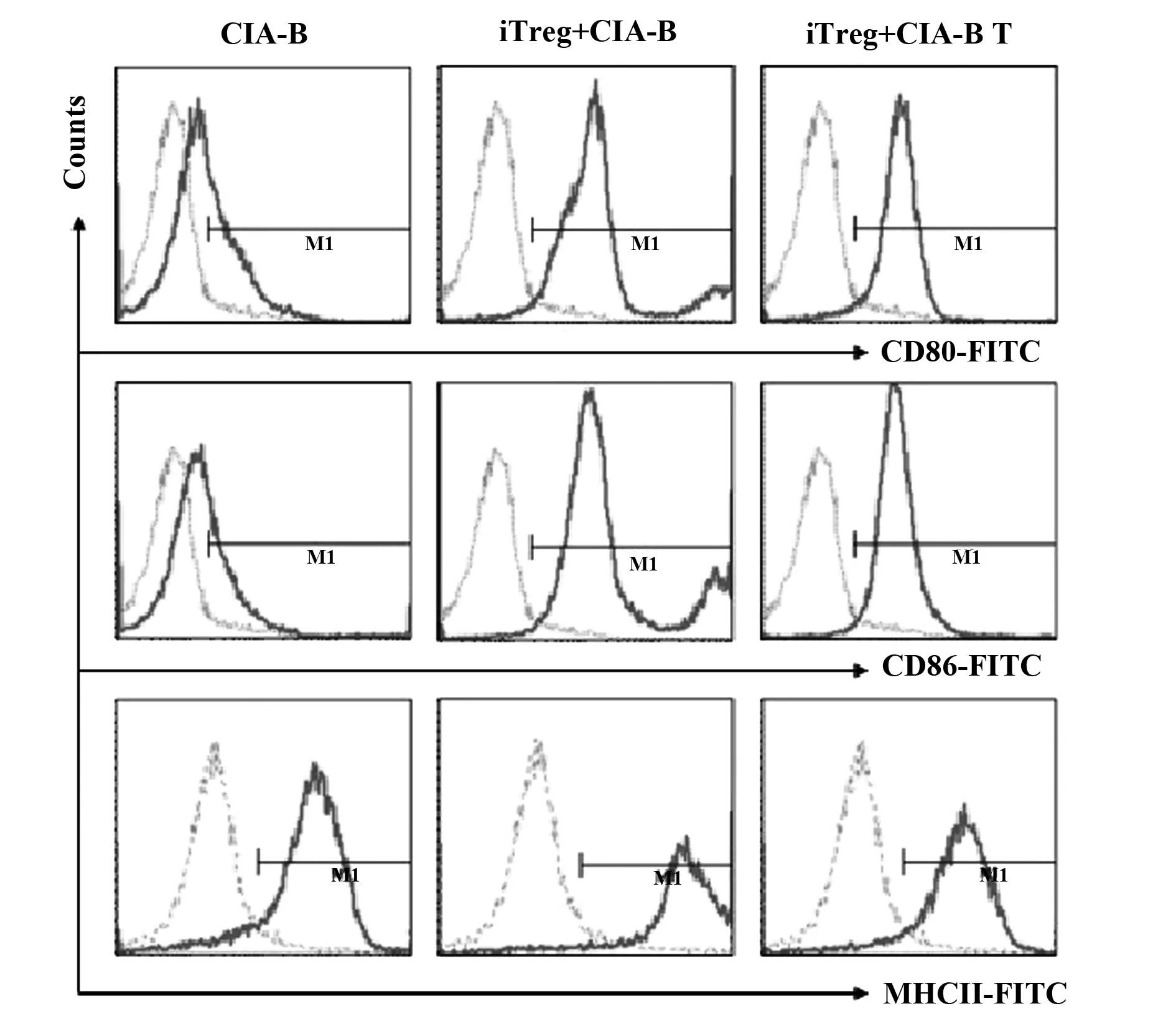
图3 iTregs通过细胞直接接触促进CIA-B细胞表面共刺激分子和MHCⅡ类分子的表达Fig.3 iTregs increased the expressions of co-stimulators(CD80,CD86) and MHCⅡ on CIA-B through a cell-contact pathway
表1iTregs通过细胞直接接触促进CIA-B细胞表面共刺激分子和MHCⅡ类分子的表达
Tab.1iTregsincreasedtheexpressionsofco-stimulators(CD80,CD86)andMHCⅡonCIA-Bthroughacell-contactpathway
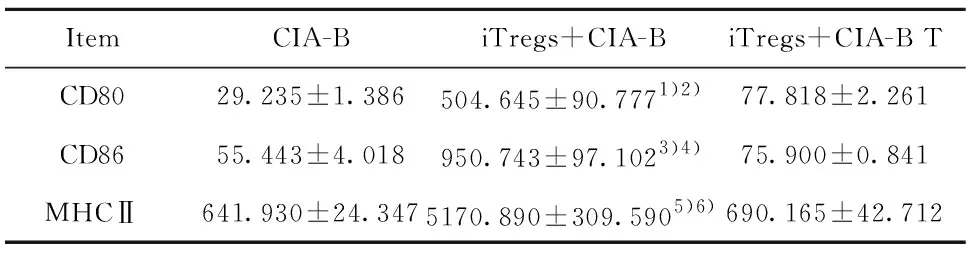
ItemCIA-BiTregs+CIA-BiTregs+CIA-B TCD8029.235±1.386504.645±90.7771)2)77.818±2.261CD8655.443±4.018950.743±97.1023)4)75.900±0.841MHCⅡ641.930±24.3475170.890±309.5905)6)690.165±42.712
Note:1)CIA-B vs iTregs+CIA-B,P=0.001 9;2)iTregs+CIA-B vs iTregs+CIA-B T,P=0.003 3;3)CIA-B vs iTregs+CIA-B,P<0.000 1;4)iTregs+CIA-B vs iTregs+CIA-B T,P=0.001;5)CIA-B vs iTregs+CIA-B,P<0.000 1;iTregs+CIA-B vs iTregs+CIA-B T,P<0.000 1.
2.3iTregs促进CIA-B细胞表面共刺激分子(CD80,CD86)和MHCⅡ类分子的表达 将iTregs与CIA-B细胞按照1∶1 的细胞比例共培养3 d,实验设为CIA-B组、iTregs+CIA-B组和iTregs+CIA-B Transwell实验组(iTregs+CIA-B T);3 d后,收集细胞,流式细胞仪分别检测CD80+CD19+、CD86+CD19+、MHCⅡ+CD19+细胞的表达情况。结果如图3和表1所示,研究发现与iTregs共培养后,CIA-B细胞表面共刺激分子(CD80,CD86)和MHCⅡ类分子的表达都显著升高;在进行Transwell实验将iTregs与CIA-B细胞隔离开共培养后,三者的表达都显著回落甚至是接近共培养前的水平。
3 讨论
已知,B细胞通过B细胞表面抗原受体和表达于T细胞表面的一些分子配体相结合,实现两者间的相互作用[22],从而调控效应性T细胞的激活、调节性T细胞的生成及抑制性免疫应答[23]。在这种相互作用中,B细胞被激活而表达更多的共刺激分子,或分化成浆细胞;同时表达更多共刺激分子的B细胞可以作为抗原提呈细胞通过提呈特异性抗原而激活自身反应性T细胞[24]。任何对B细胞和T细胞相互作用的影响都可能诱发自身免疫性疾病的发生和发展[22]。
既往研究发现,在将iTregs注射入已发病的CIA小鼠后,iTregs在体内明显扩增,但具体机制不详[19];结合已有的BAFF转基因小鼠研究结果[21],推测在CIA已发病的关节炎小鼠的炎症环境下,iTregs的扩增也有赖于B细胞。研究结果发现,已发病的CIA小鼠的B细胞较正常DBA1/J小鼠的B细胞诱导更多Tregs细胞(foxp3+细胞)的生成。不仅如此,CIA小鼠的B细胞还可以促进iTregs本身的增殖,并通过细胞直接接触的方式上调iTregs细胞表面CTLA-4的表达。
既然B细胞与T细胞存在着明确的相互作用,研究随后观察了iTregs对B细胞的可能作用方式。结果意外地发现,iTregs显著上调了B细胞表面共刺激分子(CD80、CD86)和MHCⅡ类分子的表达,这三者代表着B细胞的激活和抗原提呈能力;这个作用依赖于细胞直接接触而实现。
iTregs又是如何避免B细胞持续过度地活化呢?已有研究证实,Tregs可通过CD28/CD80/86/CTLA-4平衡直接抑制B细胞的功能[23]。表达于B细胞表面的CD80/CD86可以通过与两种表达于T细胞表面的受体分子结合而分别发挥抑制或促进T细胞功能的作用,这两种受体分子包括CTLA-4和CD28。CTLA-4又称CD152,是下调免疫应答的一种关键蛋白受体,与CD28共享CD80/CD86分子配体,而CTLA-4与CD80/CD86分子结合后诱导T细胞无反应性,参与免疫反应的负调节[25-29]。CTLA-4可表达于人和小鼠的Tregs表面,是Tregs发挥免疫抑制功能的重要途径之一[30-32]。iTregs表面的CTLA-4可以结合CD80/CD86发挥对B细胞甚至是效应性T细胞的抑制作用;而CD80/CD86则可与T细胞表面的CD28结合起到促进效应性T细胞增殖的作用;已知CTLA-4可以竞争性结合CD80/CD86。由此可见,iTregs可以通过上调B细胞表面CD80、CD86和MHCⅡ类分子的表达,增强其抗原提呈的能力,进而促进iTregs本身的增殖并诱导更多Tregs的生成;同时这些B细胞可以上调iTregs表面CTLA-4的表达,通过CTLA-4与CD80/CD86的结合直接抑制B细胞并可直接和或间接抑制效应性T细胞,而利于免疫抑制功能的发挥并避免B细胞的过度激活。
本研究探讨了CIA关节炎小鼠炎症环境下iTregs与B细胞的相互作用模式,推动了iTregs对关节炎小鼠治疗作用机制的研究,将有助于RA细胞免疫治疗的发展。
参考文献:
[1] Angelotti F,Parma A,Cafaro G,etal.One year in review 2017:pathogenesis of rheumatoid arthritis[J].Clin Exp Rheumatol,2017,35(3):368-378.
[2] Bugatti S,Vitolo B,Caporali R.B cells in rheumatoid arthritis:from pathogenic players to disease biomarkers[J].Biomed Res Int,2014,2014:681678.
[3] Noorchashm H,LieuYK,Noorchashm N,etal.I-Ag7-mediated antigen presentation by B lymphocytes is critical in overcoming a checkpoint in T cell tolerance to islet beta cells of nonobese diabetic mice[J].J Immunol,1999,163:743-750.
[4] Serreze DV,Fleming SA,Chapman HD,etal.B lymphocytes are critical antigen-presenting cells for the initiation of T cell-mediated autoimmune diabetes in nonobese diabetic mice[J].J Immunol 1998,161:3912-3918.
[5] Villadangos JA,Schnorrer P.Intrinsic and cooperative antigen-presenting functions of dendritic-cell subsets in vivo[J].Nat Rev Immunol,2007,7:543-555.
[6] Marino E,Villanueva J,Walters S,etal.CD4(+)CD25(+)T-cells control autoimmunity in the absence of B-cells[J].Diabetes,2009,58:1568-1577.
[7] Bouaziz JD,Yanaba K,Venturi GM,etal.Therapeutic Bcell depletion impairs adaptive and autoreactive CD4+T cell activation in mice[J].Proc Natl Acad Sci U S A,2007,104:20878-20883.
[8] Marino E,Batten M,Groom J,etal.Marginal-zone B-cells of nonobese diabetic mice expand with diabetes onset,invade the pancreatic lymph nodes,and present autoantigen to diabetogenic T-cells[J].Diabetes,2008,57:395-404.
[9] Wheat W,Kupfer R,Gutches DG,etal.Increased NF-kappaB activity in B cells and bone marrow-derived dendritic cells from NOD mice[J].Eur J Immunol,2004,34:1395-1404.
[10] Hussain S,Delovitch TL.Dysregulated B7-1 and B7-2 expression on nonobese diabetic mouse B cells is associated with increased T cell costimulation and the development of insulitis[J].J Immunol,2005,174:680-687.
[11] Wither JE,Roy V,Brennan LA,etal.Activated B cells express increased levels of costimulatory molecules in young autoimmune NZB and(NZB x NZW)F(1) mice[J].Clin Immunol,2000,94(1):51-63.
[12] Sakaguchi S,Sakaguchi N,Asano M,etal.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J].J Immunol,1995,155(3):1151-1164.
[13] Van Amelsfort JM,Jacobs KM,Bilsma JW,etal.CD4+CD25+regulatory T cells in rheumatoid arthritis:differences in the presence,phenotype,and function between peripheral blood and synovial fluid[J].Arthritis Rheum,2004,50:2775-2785.
[14] Ehrenstein MR,Evans JG,Singh A,etal.Compromised function of regulatory T cells in rheumatoid arthritis and reversal by anti-TNF-α therapy[J].J Exp Med,2004,200:277-285.
[15] Mottonen M,Heikkinen J,Mustonen L,etal.CD4+CD25+T cells with the phenotypic and functional characteristics of regulatory T cells are enriched in the synovial fluid of patients with rheumatoid arthritis[J].Clin Exp Immunol,2005,140:360-367.
[16] Flores-Borja F,Jury EC,Mauri C,etal.Defects in CTLA-4 are associated with abnormal regulatory T cell function in rheumatoid arthritis[J].Proc Natl Acad Sci,2008,105:19396-19401.
[17] Cao D,Malmström V,Baecher-Allan C,etal.Isolation and functional haracterization of regulatory CD25brightCD4+cells from the target organ of patients with rhumatoid arthritis[J].Eur J Immunol,2003,33(1):215-223.
[18] Lawson CA,Brown AK,Bejarano V,etal.Early rheumatoid arthritis is associated with a deficit in the CD4+CD25highregulatory T cell population in peripheral blood[J].Rheumatology(Oxford),2006,45:1210-1217.
[19] Kong N,Lan Q,Chen M,etal.Antigen-specific transforming growth factor β-induced Treg cells,but not natural Treg cells,ameliorate autoimmune arthritis in mice by shifting the Th17/Treg cell balance from Th17 predominance to Treg cell predominance[J].Arthritis Rheum,2012,64(8):2548-2558.
[20] Kong N,Lan Q,Chen M,etal.Induced T regulatory cells suppress osteoclastogenesis and bone erosion in collagen-induced arthritis better than natural T regulatory cells[J].Ann Rheum Dis,2012,71(9):1567-1572.
[21] Walters S,Webster KE,Sutherland A,etal.Increased CD4+FoxP3+T cells in BAFF-transgenic mice suppress T cell effector responses[J].J Immunol,2009,182:793-801.
[22] Tangye SG,Brink R,Goodnow CC,etal.SnapShot:interactions between B cells and T cells[J].Cell,2015,162(4):926-926.
[23] Brzostek J,Gascoigne NR,Rybakin V,etal.Cell type-specific regulation of immunological synapse dynamics by B7 ligand recognition[J].Front Immunol,2016,7:24.
[24] Murphy,Kenneth.Janeway′s Immunobiology[M].8th Edition.New York,NY:Garland Science,2012:351.
[25] Oderup C,Cederbom L,Makowska A,etal.Cytotoxic T lymphocyte antigen-4-dependent down-modulation of costimulatory molecules on dendritic cells in CD4+CD25+regulatory T-cell-mediated suppression[J].Immunology,2006,118:240-249.
[26] Onishi Y,Fehervari Z,Yamaguchi T,etal.FoxP3+natural regulatory T cells preferentially form aggregates on dendritic cells in vitro and actively inhibit their maturation[J].Proc Natl Acad Sci,2008,105:10113-10118.
[27] Wing K,Onishi Y,Prieto-Martin P,etal.CTLA-4 control over FoxP3+regulatory T cell function[J].Science,2008,322:271-275.
[28] Ville S,Poirier N,Blancho G,etal.Co-Stimulatory blockade of the CD28/CD80-86/ CTLA-4 balance in transplantation:impact on memory T cells?[J].Front Immunol,2015,6:411.
[29] Chikuma S.CTLA-4,an essential immune-checkpoint for T-cell activation[J].Curr Top Microbiol Immunol,2017,410:99-126.
[30] Read S,Malmstrom V,Powrie F.Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation[J].J Exp Med,2000,192:295-302.
[31] Takahashi T,Tagami T,Yamazaki S,etal.Immunologic self-tolerance maintained by CD25(+)CD4(+) regulatory T cells constitutively expressing cytotoxic T lymphocyte-associated antigen 4[J].J Exp Med,2000,192:303-310.
[32] Dieckmann,D,Plottner,H,Berch-told,S,etal.Ex vivo isolation and characterization of CD4(+)CD25(+) T cells with regulatory properties from human blood[J].J Exp Med,2001,193:1303-1310.