氯喹对正常胃上皮细胞GES-1和胃癌细胞HGC-27凋亡的不同影响①
2018-07-06张亚萍张鑫艳张晓延
曹 丽 苏 强 张亚萍 张鑫艳 程 凯 张晓延
(山西医科大学汾阳学院,汾阳 032200)
近年来,胃癌的发病率显著上升,在我国恶性肿瘤中占比较大,因在早期不易被发现,当就医诊断时往往处于中晚期,而目前对于胃癌的诊断和治疗仍依赖于传统手段,存在治疗效果不佳、副作用大等问题。因此目前迫切需要深入研究,寻找更加科学合理的早期诊断和预防治疗的方案。
氯喹(Chloroquine,CQ)属于4-氨基喹诺酮类药,由两个芳香环组成,是一种古老而应用广泛的治疗疟疾的药物。在自噬研究中,氯喹作为一种经典的溶酶体抑制剂,抑制自噬体与溶酶体的融合,起到抑制自噬流的作用。近年有研究发现,氯喹可发挥抗肿瘤作用,有应用于肿瘤治疗的前景[1]。已有研究表明氯喹能诱导胃癌细胞发生凋亡[2],因此我们想到如果氯喹也能诱导正常细胞发生凋亡,将会在临床应用中发生较严重的毒副作用。本研究中我们以正常胃上皮细胞为对照,观察了氯喹是否对人胃癌HGC-27 细胞有特异性的促凋亡作用,以期待为胃癌的临床治疗提供新的参考。
1 材料与方法
1.1材料
1.1.1细胞株 人胃癌HGC-27 细胞和人正常胃上皮GES-1细胞由山西医科大学汾阳学院张笑添老师馈赠,我课题组冻存培养。培养条件:含10%胎牛血清的MEM和DMEM 培养基,37℃,5%CO2培养箱。
1.1.2主要试剂 MEM 培养基、DMEM 培养基、胰蛋白酶、无支原体胎牛血清(武汉博士德生物技术有限公司);CCK-8试剂(博士德生物科技有限公司);氯喹(上海中西制药有限公司);细胞线粒体膜电位检测试剂盒(江苏凯基生物技术股份有限公司);PAGE凝胶配制试剂(赛默飞公司);NC膜(PALL公司);Caspase-3抗体、PARP抗体、LC3A/B抗体(CST公司);GAPDH抗体(万类生物科技有限公司)。
1.2方法
1.2.1实验分组 两种细胞的实验分组各为加溶剂对照组和用氯喹、雷帕霉素(Rapamycin,RAP)作用后的实验组。细胞密度接近95%时将两种细胞传代至6孔板,每孔50万个,12 h后细胞密度约90%时分别换成含1%血清的MEM维持液和DMEM 维持液培养,设对照组和处理组。
确定药物处理方案:结合相关文献以及我们前期的预实验结果,观察到用10 μmol/L的CQ和100 nmol/L的RAP药物处理细胞72 h,细胞在形态以及生理指标上的变化差异最明显,故选取此方案进行处理。
1.2.2使用倒置显微镜观察CQ 处理后这两种细胞形态学变化 细胞处理方法同1.2.1,设对照组和氯喹处理组。在37℃,5%CO2培养箱中培养72 h后,用倒置显微镜观察细胞形态并拍照。
1.2.3采用DAPI核染色检测CQ 对HGC-27 细胞凋亡的作用 细胞处理方法同1.2.1,设对照组和氯喹处理组,在37℃,5%CO2培养箱中培养72 h后,DAPI染核5 min,用PBS洗3遍后在荧光显微镜下观察并拍照。
1.2.4CCK-8法检测细胞的增殖活性 选取处于对数生长期且活性大于95%的细胞进行实验。用完全培养基调整细胞浓度为4×104ml-1,每孔100 μl加入96孔培养板,待细胞贴壁后换成含1%血清的维持液。实验分为3组,氯喹组:用10 μmol/L的CQ干预;RAP组:用100 nmol/L的RAP干预;对照组:不加药物的溶剂作为对照。每组设2个复孔,作用72 h,在终止培养的前2 h,每孔加入10 μl的CCK-8试剂[2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐],在酶标仪450 nm波长下测定各孔的吸光度值,计算各孔平均OD 值,以对照组细胞活性为100%,计算各孔的细胞存活率。细胞存活率:细胞存活率/%=(实验组A 值-阴性对照组A 值)/(空白对照组A值-阴性对照组A值)×100%。以上实验重复3次。
1.2.5JC-1检测CQ处理后细胞线粒体膜电位的变化 细胞处理方法同上。在氯喹作用细胞72 h后,吸除培养液,PBS洗涤细胞1 次,加入0.5 ml细胞培养液,再加入0.5 ml JC-1 染色工作液,充分混匀。细胞培养箱中37℃孵育20 min。孵育结束后,吸除上清,用JC-1 染色缓冲液洗涤2 次,加入1 ml细胞培养液,荧光显微镜下通过荧光通道检测,分别拍照。
1.2.6Western blot检测凋亡相关蛋白 分别收集两种细胞的对照组和处理组,加入60 μl RIPA 裂解液冰浴15 min,BCA法测定蛋白质浓度;样品通过SDS-PAGE电泳分离,并转移到硝酸纤维素膜(NC)上;膜用5%脱脂奶粉常温封闭2 h,然后分别孵育凋亡蛋白Caspase-3抗体,PARP抗体和GAPDH抗体以及LC3抗体,4℃过夜;清洗后,用辣根过氧化物酶(HRP)标记的二抗在室温下孵育2 h;最后使用化学发光法显影。
2 结果
2.1氯喹处理对GES-1细胞和HGC-27细胞形态的影响 10 μmol/L的CQ 分别作用于GES-1细胞和HGC-27细胞72 h后,镜下可见:GES-1细胞氯喹组和对照组细胞贴壁生长情况较一致,细胞间连接紧密,细胞呈多角形,胞膜清晰,胞质饱满,说明氯喹干预未明显改变正常胃上皮细胞形态;而HGC-27氯喹组细胞与对照组细胞相比较,间隙增宽,悬浮细胞数目逐渐增多,细胞密度明显减少,细胞逐渐萎缩变圆,胞质减少,失去正常细胞形态,显示氯喹干预后胃癌细胞发生了较为明显的形态改变(图1)。
2.2核染色检测CQ诱导的HGC-27细胞凋亡 10 μmol/L的CQ分别作用于GES-1细胞和HGC-27细胞72 h后,用DAPI荧光染色法检测氯喹处理细胞后细胞核的变化。如图2所示,与同种细胞对照组相比,氯喹组GES-1细胞核浅染、核大小形态均未发生变化;而氯喹组HGC-27细胞细胞核呈浓缩致密的固缩形态或颗粒状荧光,且细胞数目也减少。
2.3氯喹和雷帕霉素对GES-1和HGC-27细胞增殖活性的影响 分别用10 μmol/L CQ和100 nmol/L RAP处理GES-1和HGC-27细胞72 h,CCK-8试剂盒检测结果显示:CQ能抑制HGC-27细胞增殖(P<0.05),对GES-1细胞的增殖活性无明显抑制作用(P>0.05)。本研究将自噬诱导剂雷帕霉素作为氯喹干预的对照药物,结果显示雷帕霉素可明显增加正常胃上皮细胞GES-1增殖活性(P<0.05),而对胃癌HGC-27细胞的促增殖活性不明显(P>0.05)(图3)。结果提示氯喹对胃癌细胞的增殖活性抑制作用可能与抑制细胞自噬有关。
2.4JC-1检测CQ处理后两种细胞线粒体膜电位的变化 JC-1是检测细胞膜电位变化的理想指示剂。JC-1在细胞内有单体和多聚体两种存在状态,当以低浓度的单体形式存在时会聚集于胞内发射绿色荧光,当进入线粒体以高浓度的多聚体形式存在时会发射红色荧光,当发生凋亡时,细胞线粒体膜电位会下降,就会由红色荧光向绿色荧光发生转变[3]。10 μmol/L CQ作用GES-1细胞和HGC-27细胞72 h后,荧光显微镜下观察可见,GES-1细胞中的红色荧光和绿色荧光无明显变化,而HGC-27细胞中的JC-1 出现从红色荧光向绿色荧光转变,说明CQ处理后HGC-27细胞发生了线粒体膜电位的下降(图4)。
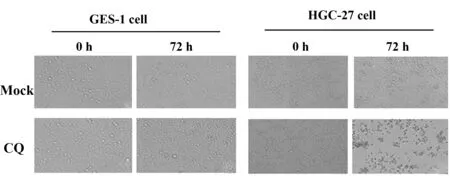
图1 两种细胞氯喹处理后的形态学变化(×20)Fig.1 Morphological changes of two cells after treated by CQ(×20)
2.5氯喹对胃癌细胞HGC-27凋亡相关蛋白水平的影响 由于氯喹和雷帕霉素是自噬相关药物,为验证这两种药物作用于两种细胞后自噬发生情况,我们用10 μmol/L CQ和100 nmol/L RAP药物作用于两种细胞72 h后观测自噬标记蛋白LC3的水平。与各自的对照组比较,氯喹组LC3Ⅰ型和Ⅱ型出现增多,表明自噬流被抑制,而雷帕霉素组出现了LC3Ⅰ型向Ⅱ型的转变,表明细胞自噬的发生(图5A)。随后,研究了这两种药物作用于两种细胞后凋亡蛋白的水平改变。药物处理72 h后,CQ处理组和雷帕霉素处理组的GES-1细胞Caspase-3和PARP表达较对照组无明显差异(P>0.05);CQ处理组HGC-27细胞中凋亡蛋白Caspase-3和PARP表达较相同细胞对照组和雷帕霉素处理组均降低,差异有统计学意义(P<0.05)。见图5B、C。
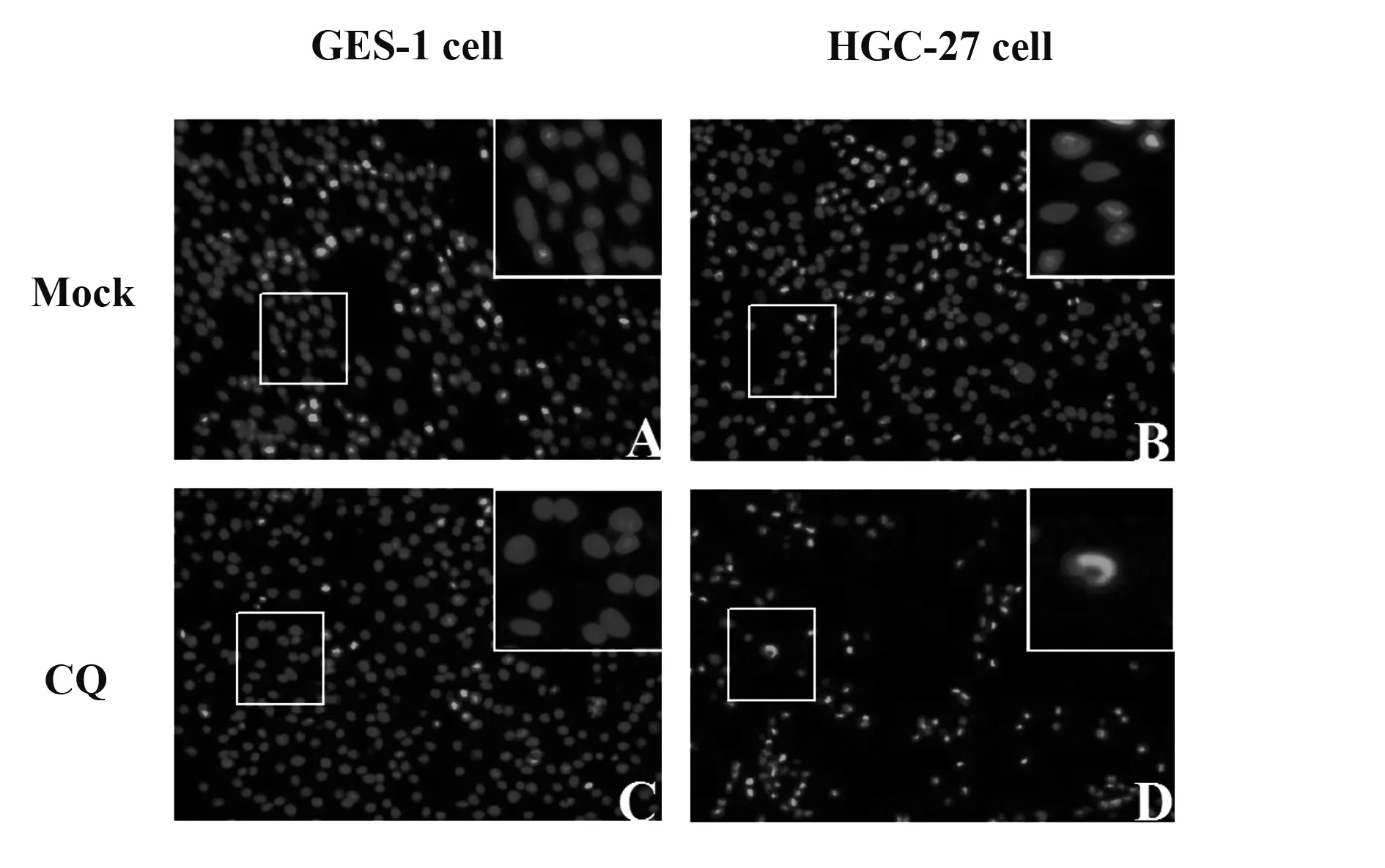
图2 两种细胞氯喹处理后的细胞核染色变化(×20)Fig.2 Nuclear staining changes in two kinds of cells after treated with CQ(×20)
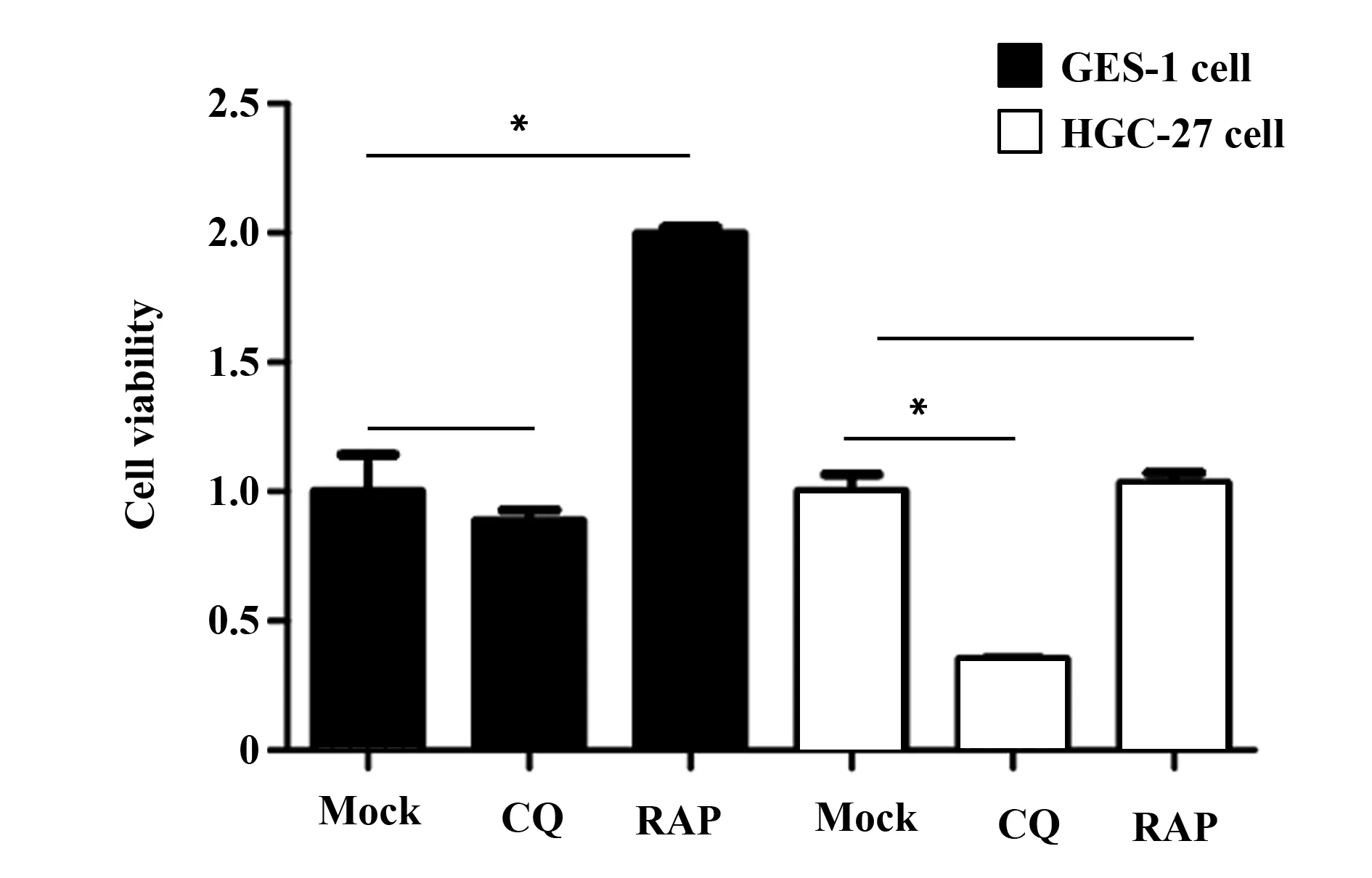
图3 两种药物对GES-1和HGC-27细胞的细胞增殖活性的影响Fig.3 Proliferative activity of GES-1 and HGC-27 cells after 72 hNote: *.P<0.05.


图4CQ处理后两种细胞线粒体膜电位的变化(×20)
Fig.4EffectsofchloroquineonmitochondrialmembranepotentialofGES-1andHGC-27cells(×20)
Note: Counting certain cells randomly and calculating the ratio of red fluorescence to green fluorescent,*.P<0.05.

图5 Western blot检测两种药物处理GES-1细胞和胃癌细胞HGC-27细胞后凋亡蛋白的表达Fig.5 Expression of proteins in GES-1 and HGC-27 cells by Western blotNote:*.P<0.05.
3 讨论
胃癌是威胁人类的十大癌症之一,每年全球有近80万例患者死于胃癌,这其中约有一半患者来自中国[4]。所以,找到一种新的有效治疗方法是众多科研工作者和临床医师一直努力的方向。CQ长期以来被用作抗疟疾药物,近年来又发现其可靶向溶酶体,通过改变溶酶体内pH值从而阻断自噬溶酶体的形成和自噬体内容物的降解,可抑制自噬的晚期效应阶段[5,7]。值得一提的是,已有研究表明氯喹已作为一种新的抗肿瘤药物被应用于临床试验[8-10]。Zhang等[2]发现氯喹通过Toll样受体9/NF-κB 信号转导通路抑制MGC803胃癌细胞生长和迁移,并具有抗肿瘤活性;Zhu等[5]发现氯喹促进顺铂发挥抑制卵巢癌细胞生长、迁移的作用,通过氯喹抑制自噬从而增强顺铂的抗肿瘤效应。也有相同的研究报道见于其他肿瘤[11,12],但均未观察药物对正常细胞的毒副作用。考虑到作为一种抗肿瘤药物对肿瘤细胞的选择性作用越强,其应用价值才越高,故本研究以正常胃上皮细胞作为对照来进行研究。与预期相符,结果发现氯喹能诱导胃癌细胞HGC-27发生凋亡,这与Zhang等[2]、Ye等[3]研究结果相同。除此之外,更有意义的是本研究发现与氯喹对胃癌细胞的诱导凋亡和抑制增殖的作用不同的是,氯喹对正常胃上皮细胞无明显地诱导细胞凋亡和细胞毒作用。这种对肿瘤细胞特异性的作用就为氯喹应用于临床抗肿瘤治疗提供了进一步的实验基础。
细胞自噬和凋亡是维持机体内环境稳态的重要机制,干扰细胞自噬或凋亡会使细胞的生长代谢发生紊乱。通过扰乱肿瘤细胞自噬和凋亡的联系,在一定程度上抑制肿瘤的生长,成为治疗肿瘤的一种策略。氯喹和雷帕霉素是一对经典的自噬抑制剂和自噬诱导剂,本研究以雷帕霉素为对照,探究了这两种药物对两种细胞的不同作用。我们认为自噬的发生保护肿瘤细胞,阻止其发生凋亡。有学者发现小剂量的CQ通过抑制自噬可增强苦参碱诱导的凋亡[13]。他们的研究中使用小剂量的氯喹与其他抗肿瘤药物连用也可以起到诱导肿瘤细胞凋亡的效果。因此,我们推测低剂量的氯喹可以部分抑制自噬体内容物的降解,但还不足以直接诱导肿瘤细胞的凋亡,而我们实验中使用的中等剂量的氯喹可较强的阻断自噬溶酶体的形成和自噬体内容物的降解,使之积聚在胞内,直接导致肿瘤细胞的凋亡。
Caspase-3和PARP 都是细胞发生凋亡的重要标志。PARP,即聚腺苷二磷酸-核糖聚合酶(Poly ADP-ribose polymerase),是细胞凋亡核心成员胱天蛋白酶(Caspase)的切割底物。本实验中,我们发现氯喹作用于两种细胞72 h后,胃癌细胞HGC-27中凋亡相关蛋白酶Caspase-3和凋亡底物PARP发生降解,提示氯喹诱导的胃癌细胞凋亡与Caspase途径有关联。有研究表示许多抗肿瘤药物作用于肿瘤细胞后能诱导细胞内产生ROS,ROS会使线粒体功能丧失如线粒体跨膜电位的变化,细胞色素C从线粒体释放至细胞质,然后这种释放会引发Caspase活化、DNA的断裂,最终导致细胞发生凋亡[14,15]。因此接下来我们进一步探究了氯喹作用于胃癌细胞HGC-27后是否通过这一机制来诱导胃癌细胞HGC-27凋亡。
我们以正常胃上皮细胞GES-1作为对照细胞,运用DAPI染色、CCK-8试验以及JC-1膜电位变化、蛋白印迹Western blot等试验方法验证了氯喹可以诱导胃癌细胞发生凋亡并抑制其细胞活力,而对正常胃上皮细胞无明显作用。这种差异提示在两种细胞中自噬溶酶体受抑制后的活动不同,但具体的机制仍需进一步实验探索。氯喹能抑制胃癌细胞的自噬溶酶体形成阶段诱导胃癌细胞发生凋亡,提示自噬溶酶体在自噬和凋亡调控之间发挥着重要的作用,我们接下来将对这种调控的机制做进一步的研究探索,以从自噬和凋亡调控的角度为癌症的临床治疗提供更多的参考。
参考文献:
[1] Sui X,Chen R,Wang Z,etal.Autophagy and chemotherapy resistance:a promising therapeutic target for cancer treatment[J].Cell Death Dis,2013,4(10):1-20.
[2] Zhang Y,Li Y,Li Y,etal.Chloroquine inhibits MGC803 gastric cancer cell migration via the Toll-like receptor 9/nuclear factor kappa B signaling pathway[J].Mol Med Rep,2015,11(2):1366-1371.
[3] Ye H,Chen M,Cao F,etal.Chloroquine,an autophagy inhibitor,potentiates the radiosensitivity of glioma initiating cells by inhibiting autophagy and activating apoptosis[J].BMC Neurol,2016,16:178-186.
[4] Wang C,Zhang J,Cai M,etal.DBGC:a database of human gastric cancer[J].PLoS One,2015,10(11):1-10.
[5] Zhu J,Zheng Y,Zhang H,etal.Low concentration of chloroquine enhanced efficacy of cisplatin in the treatment of human ovarian cancer dependent on autophagy[J].Am J Transl Res,2017,9(9):4046-4058.
[6] Liang DH,Choi DS,Ensor JE,etal.The autophagy inhibitor chloroquine targets cancer stem cells in triple negative breast cancer by inducing mitochondrial damage and impairing DNA break repair[J].Cancer Let,2016,376(2):249-258.
[7] 李 倩,袁冬梅,宋 勇.氯喹抗肿瘤作用及研究进展[J].医学综述,2016,22(13):2541-2543.
Li Q,Yuan DM,Song Y.The antitumor or role and research progness of chloroqine[J].Med Rev,2016,22(13):2541-2543.
[8] Lv X,Liu F,Shang Y,etal.Honokiol exhibits enhanced antitumor effects with chloroquine by inducing cell death and inhibiting autophagy in human non-small cell lung cancer cells[J].Oncol Rep,2015,34(3):1289-1300.
[9] Zhang HQ,Fang N,Liu XM,etal.Antitumor activity of chloroquine in combination with Cisplatin in human gastric cancer xenografts[J].Asian Pac J Cancer Prev,2015,16(9):3907-3912.
[10] Zhao XG,Sun RJ,Yang XY,etal.Chloroquine-enhanced efficacy of cisplatin in the treatment of hypopharyngeal carcinoma in xenograft mice[J].PLoS One,2015,10(4):1-12.
[11] Tao Hu,Pei Li,Luo Z,etal.Chloroquine inhibits hepatocellular carcinoma cell growth in vitro and in vivo[J].Oncol Rep,2016,35(1):43-49.
[12] 陈 君,吴少花,窦茗瀚,等.氯喹对杨梅素诱导HeLa细胞凋亡的影响[J].中国妇幼保健,2015,30(22):3894-3897.
Chen J,Wu SH,Dou MH,etal.The effect of chloroquine on the hela cell apoptosis induced by waxberry[J].Chin Maternity Child Care,2015,30(22):3894-3897.
[13] Wang L,Gao C,Yao S,etal.Blocking autophagic flux enhances matrine-induced apoptosis in human hepatoma cells[J].Int J Mol Sci,2013,14(12):23212-23230.
[14] Xiong Y,Ye T,Wang M,etal.A novel cinnamide YLT26 induces breast cancer cells apoptosis via ROS-mitochondrial apoptotic pathway in vitro and inhibits lung metastasis in vivo[J].Cell Physiol Biochem,2014,34(6):1863-1876.
[15] 赵凯迪,高 静,李 香,等.吡啶锰配合物诱导肿瘤细胞死亡的作用及对线粒体功能的影响[J].中国细胞生物学学报,2012,34(6):544-554.
Zhao KD,Gao J,Li X,etal.The effect of pyridine manganese complexes on inducing tumor cell death and mitochondrial function[J].Chin J Biol,2012,34(6):544-554.