多巴胺D1受体在豚鼠耳蜗中的作用
2018-07-06李雪实李兴启韩琳王琳余力生
李雪实李兴启韩琳王琳余力生
1北京大学人民医院耳鼻咽喉科(北京100044)
2解放军耳鼻咽喉科研究所(北京100853)
随着对噪声性聋、老年性聋、药物中毒性聋等感音神经性聋研究的深入,耳蜗传出神经系统对耳蜗的保护作用逐渐受到重视。研究表明,橄榄耳蜗束(Olivocochlear bundle,OCB)是唯一已被证实的听觉传出通路,可以在一定程度上减轻噪声、缺氧对毛细胞损伤,并对耳蜗水平的言语编码和初级识别有一定的调控作用[1]。在耳蜗传出神经系统中,多数神经递质在内、外侧橄榄耳蜗束均有表达,而多巴胺只存在于外侧橄榄耳蜗束中,其通过抑制伤害性刺激造成的谷氨酸兴奋性中毒作用,保护内毛细胞[2]。在听觉适应过程中,持续给声刺激时,听神经的冲动发放速率开始时最大,然后很快降低,其原因可能是多巴胺对谷氨酸兴奋的抑制作用[3]。
现已知多巴胺受体为G蛋白偶联受体,多巴胺受体家族包括两类:D1样受体:包括D1、D5;D2样受体:包括D2、D3、D4。Beaulieu[4]等发现,D1样受体可激活腺苷酸环化酶,D2样受体可抑制腺苷酸环化酶的活性,推测二者对多巴胺的调节可能起到相反的作用。Niu[5]等通过免疫组化的方法发现D1受体位于内毛细胞下传入神经树突上,而外毛细胞下未见到其免疫标记。Garborjan[6]等发现多巴胺D1受体拮抗剂和激动剂均可增加静息和电诱导下多巴胺的释放。Ruel[7]等发现应用多巴胺受体拮抗剂可增加CAP振幅,接着可迅速下降至用药前水平。Niu等全耳蜗灌流D1受体激动剂后发现CAP振幅增加。Sun[8]等灌流多巴胺受体激动剂后发现螺旋神经节细胞出现内向电流,动作电位(AP)振幅下降。综上所述,目前对多巴胺D1受体对突触后调节作用的研究结果不尽相同,同时,研究中未观察CAP及CM输入/输出函数曲线(imput/output,I/O曲线)的变化,也未观察对DPOAE的影响。基于此点,本研究通过电生理的方法观察多巴胺D1受体拮抗剂对豚鼠耳蜗电位及耳声发射的影响,探讨多巴胺D1受体在豚鼠耳蜗中的作用。
1 材料与方法
1.1实验动物与分组
选用健康、耳廓反射灵敏的白色红目豚鼠20只,雌雄不拘,300-400g,随机分为2组,每组10只,均取左耳为实验耳。灌流人工外淋巴液作为对照组;灌流多巴胺D1受体拮抗剂(SCH23390)作为实验组。实验过程中豚鼠生命体征稳定,实验结束后断头处死。
1.2实验方法
1.2.1 手术操作
常规称重、麻醉、备皮、检查鼓膜、固定给声管。将豚鼠头部固定,行气管切开,经腹侧暴露听泡,暴露耳蜗,放置电极。将银丝记录电极钩于豚鼠耳蜗底转,银球末端置于圆窗龛。参考电极置于同侧颈部肌肉。地线置于鼻尖。左耳给声管接耳机,记录钻孔前的数据。行全耳蜗灌流,在豚鼠耳蜗底回的鼓阶及前庭阶分别钻孔,直径约0.2mm。记录钻孔后即刻的数据。将玻璃微管(尖端直径约50μm)插入鼓阶上的微孔,深度约0.2mm。灌流速度150μl/h。
1.2.2 数据记录
分别在钻孔前、灌流前、灌流后5min、15min、30min、60min、120min,应用美国爱声公司INTEL⁃LENGENT HEARING系统的SMART-EP软件记录:①复合动作电位(CAP),选用短声(click)诱发,滤波带通100-3kHz,叠加次数为1024次,扫描时间10ms,刺激重复率20次/s,0-110dB SPL,每5dB一档。记录电极引入EGG放大器,放大后的信号由TDT信号处理仪处理,计算机显示波形,记录CAP阈值及各声强下振幅,并做CAP输入/输出(I/O)函数曲线;②耳蜗微音电位(CM),选用4kHz短纯音(tone burst)诱发,上升/下降时间为4ms,平台为12ms,40-100dB SPL,每10dB一档,记录各声强下CM振幅,并做CM输入/输出(I/O)函数曲线;③畸变产物耳声发射(DPOAE),取f1的4k、8k、12k、16k、20k、24kHz为测试和分析频率,f2/f1=1.22,L1=65dB SPL,L2=55dB SPL,叠加次数200次。记录各刺激声频率下DPOAE振幅。以刺激声强度为横坐标,CAP及CM振幅为纵坐标,分别绘制CAP及CM I/O曲线。
1.2.3 统计学分析
应用Excel 2007软件(Microsoft公司,美国)分别计算对照组及实验组内相同时间点、相同刺激声强度和频率下①CAP阈值;②CAP振幅;③CM振幅;④ DPOAE振幅的均数(x)及标准差(s)。应用SPSS 17.0软件(SPSS公司,美国)对实验数据进行分析。数据符合正态分布,方差齐,结果以±s表示。采用独立样本t检验,对灌流前后CAP阈值及振幅、CM振幅、DPOAE振幅的变化进行对比分析。采用单因素方差分析,对各组间的CAP振幅进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 CAP的变化
2.1.1 CAP阈值的变化
各组灌流前后,CAP的阈值及阈移(表1)。人工外淋巴液组及多巴胺D1受体拮抗剂组灌流前后,CAP阈值无明显升高或降低,平均波动±5dB。灌流前及灌流2h后,CAP阈值及阈移组间差异没有统计学意义(P > 0.05)。
2.1.2 CAP振幅的变化(表2-3)
灌流人工外淋巴液2h后,CAP振幅轻度降低,输入/输出函数曲线仍呈非线性特点。灌流多巴胺D1受体拮抗剂5min后,CAP振幅增高,与灌流前相比具有统计学意义(*P=0.005)。灌流多巴胺D1受体拮抗剂时间延长,CAP振幅逐渐降低,低于灌流前水平,在刺激声强为110、50、30dB SPL时最明显,组间差异具有统计学意义(*P=0.02)。灌流多巴胺D1受体拮抗剂后,CAP I/O曲线仍具有非线性特点。
2.1.3 CAP I/O曲线
灌流人工外淋巴液2h后,CAP振幅降低,I/O曲线仍呈非线性特点(图1)。灌流多巴胺D1受体拮抗剂5min后,CAP振幅增高,与灌流前相比具有统计学意义(*P=0.005)。灌流多巴胺D1受体拮抗剂时间延长,CAP振幅逐渐降低,低于灌流前水平,组间差异具有统计学意义(*P=0.02)。灌流多巴胺D1受体拮抗剂后,CAP I/O曲线仍具有非线性特点(图2)。

图1 灌流人工外淋巴液前后CAP输入/输出曲线Fig.1 The input/output function curve of CAP before and after perfusion of artificial perilymph solutions
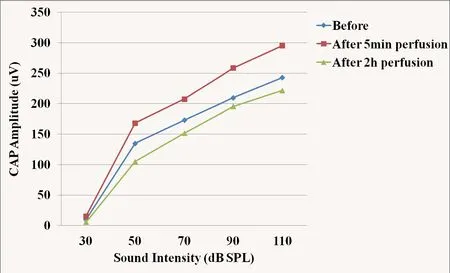
图2 灌流多巴胺D1受体拮抗剂前后CAP输入/输出曲线Fig.2 The input/output function curve of CAP before and after perfusion of dopamine D1 receptor antagonist
表1 灌流前后CAP阈值和阈移(dB SPL,±s,n=10)Table 1 CAP threshold and threshold shift before and after perfusion(dB SPL,±s,n=10)

表1 灌流前后CAP阈值和阈移(dB SPL,±s,n=10)Table 1 CAP threshold and threshold shift before and after perfusion(dB SPL,±s,n=10)
Dopamine D1 ReceptorAntagonist Before perfusion After 2h perfusion Threshold shift Artificial Perilymph Solutions 22.5±2.7 29.4±1.8 6.9±2.6 23.75±2.3 28.1±2.6 4.4±1.9
表2 灌流人工外淋巴液前后CAP振幅(uV,±s,n=10)Table 2 CAP amplitude before and after perfusion of artificial perilymph solutions(uV,±s,n=10)

表2 灌流人工外淋巴液前后CAP振幅(uV,±s,n=10)Table 2 CAP amplitude before and after perfusion of artificial perilymph solutions(uV,±s,n=10)
Before After 5min After 15min After 30min After 1h After 2h 30dB 6.9±4.6 4.3±3.2 4.3±3.1 4.1±3.1 3.3±2.3 2.7±2.0 50dB 126.6±16.0 118.6±13.7 114.8±13.4 114.5±10.9 109.5±10.3 103.1±7.0 70dB 178.2±21.2 175.1±25.2 173.1±24.4 173.2±20.6 169.7±13.1 159.5±17.3 90dB 214.4±32.7 206.9±33.3 198.4±40.3 200.6±31.9 214.1±30.1 204.4±22.3 110dB 229.6±15.4 241.6±27.2 232.9±28.9 232.4±22.0 243.6±30.2 225.2±32.3
2.2 CM的变化(表4-5)
人工外淋巴液组及多巴胺D1受体拮抗剂组灌流前后,CM振幅均无明显改变,差异没有统计学意义(P>0.05)。灌流各时间点,CM振幅组间差异没有统计学意义(P>0.05)。灌流人工外淋巴液2h后,CM振幅轻度降低,I/O曲线仍呈非线性特点(图3)。灌流多巴胺D1受体拮抗剂5min后CM振幅轻度升高,随后振幅逐渐降低,差异没有统计学意义(P >0.05),I/O曲线仍呈非线性特点(图4)。
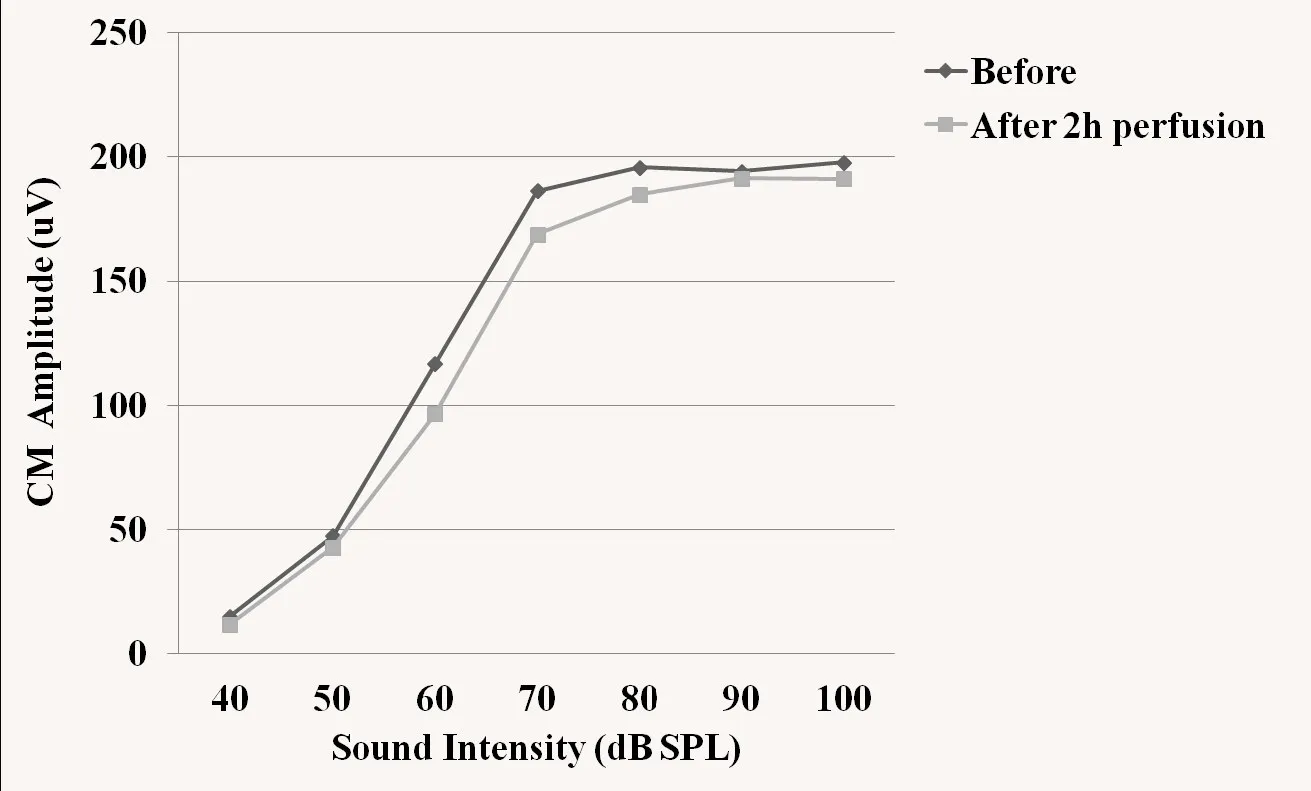
图3 灌流人工外淋巴液前后CM输入/输出曲线Fig.3 The input/output function curve of CM before and after perfusion of artificial perilymph solutions
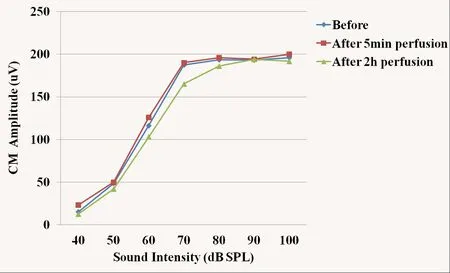
图4 灌流多巴胺D1受体拮抗剂前后CM输入/输出曲线Fig.4 The input/output function curve of CM before and after perfusion of dopamine D1 receptor antagonist
表3 灌流多巴胺D1受体拮抗剂前后CAP振幅(uV,±s,n=10)Table 3 CAP amplitude before and after perfusion of dopamine D1 receptor antagonist(uV,±s,n=10)
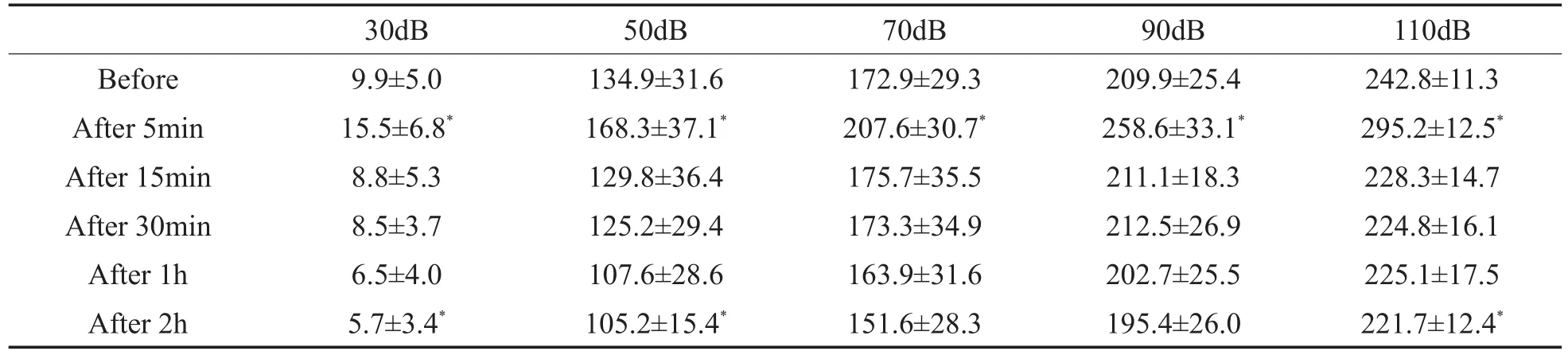
表3 灌流多巴胺D1受体拮抗剂前后CAP振幅(uV,±s,n=10)Table 3 CAP amplitude before and after perfusion of dopamine D1 receptor antagonist(uV,±s,n=10)
Before After 5min After 15min After 30min After 1h After 2h 30dB 9.9±5.0 15.5±6.8*8.8±5.3 8.5±3.7 6.5±4.0 5.7±3.4*50dB 134.9±31.6 168.3±37.1*129.8±36.4 125.2±29.4 107.6±28.6 105.2±15.4*70dB 172.9±29.3 207.6±30.7*175.7±35.5 173.3±34.9 163.9±31.6 151.6±28.3 90dB 209.9±25.4 258.6±33.1*211.1±18.3 212.5±26.9 202.7±25.5 195.4±26.0 110dB 242.8±11.3 295.2±12.5*228.3±14.7 224.8±16.1 225.1±17.5 221.7±12.4*
表4 灌流人工外淋巴液前后CM振幅(uV,±s,n=10)Table 4 CM amplitude before and after perfusion of artificial perilymph solutions(uV,±s,n=10)

表4 灌流人工外淋巴液前后CM振幅(uV,±s,n=10)Table 4 CM amplitude before and after perfusion of artificial perilymph solutions(uV,±s,n=10)
Before After 5min After 15min After 30min After 1h After 2h 40dB SPL 15.2±4.5 21.6±7.4 16.9±5.4 17.3±6.6 13.2±4.8 11.9±4.3 60dB SPL 116.7±21.4 118.1±18.3 121.1±33.5 109.2±21.4 105.6±32.0 96.6±32.1 80dB SPL 195.7±4.4 195.7±7.5 193.8±9.2 193.8±10.2 190.4±10.0 184.9±9.8 100dB SPL 197.9±3.1 199.2±7.7 197.0±8.3 193.2±9.0 194.8±9.5 191.1±8.9
表5 灌流多巴胺D1受体拮抗剂前后CM振幅(uV,±s,n=10)Table 5CM amplitude before and after perfusion of dopamine D1 receptor antagonist(uV,±s,n=10)

表5 灌流多巴胺D1受体拮抗剂前后CM振幅(uV,±s,n=10)Table 5CM amplitude before and after perfusion of dopamine D1 receptor antagonist(uV,±s,n=10)
Before After 5min After 15min After 30min After 1h After 2h 40dB SPL 15.4±4.2 23.3±6.3 18.1±5.6 20.8±7.2 14.6±5.9 12.7±4.8 60dB SPL 116.6±20.3 125.9±19.9 128.7±32.7 125.6±20.1 113.9±33.3 103.0±33.0 80dB SPL 193.5±6.5 195.9±7.3 194.3±9.3 197.4±10.8 191.5±10.2 186.1±9.9 100dB SPL 196.1±6.8 200.1±7.4 197.5±8.4 197.5±5.3 195.9±9.4 191.7±8.9
2.3 DPOAE的变化(图5)
人工外淋巴液及多巴胺D1受体拮抗剂灌流前后,DPOAE振幅均无明显改变,组间差异没有统计学意义(P > 0.05)。

图5 各组灌流前后DPOAE平均振幅Fig.5 DPOAE amplitude before and after perfusion in different groups
3 讨论
3.1多巴胺D1受体在内毛细胞下突触复合体中的作用
研究表明[9],外源性谷氨酸可以引起CAP阈值升高,内毛细胞及其下方的神经纤维出现空泡,证明谷氨酸过度释放可以产生兴奋性毒性,多巴胺可以抑制谷氨酸的兴奋性毒性,对内毛细胞具有保护作用。
多巴胺D1及D2受体在内毛细胞下突触复合体中均存在于突触前膜及突触后膜3(图6)[10]。近年来,研究热点集中在突触前膜的受体对多巴胺释放的调节。Gaborjan6等发现,D1受体促进多巴胺释放,D2受体起到负反馈调节的作用,抑制多巴胺释放,二者的相反作用平衡了多巴胺的总体效应。

图6 内毛细胞下突触复合体Fig.6 The inner hair cell synaptic complex
3.2多巴胺D1受体拮抗剂可以瞬时性阻断多巴胺对传入神经的抑制作用
前已提到,目前对多巴胺D1受体对突触后调节作用的研究结果不尽相同,有关多巴胺抑制作用的具体机制有待进一步阐明。CAP是听神经同步化放电的总体效应,反映了毛细胞的声-电转换、传入突触的电-化学传递和传入神经的化学-电冲动3个环节[11]。声刺激下放电率降低或者兴奋后抑制,都可以使CAP振幅降低。
本研究发现全耳蜗灌流多巴胺D1受体拮抗剂后5min后,CAP振幅增高,提示多巴胺D1受体拮抗剂可以阻断多巴胺对传入神经的抑制作用。随着灌流时间延长,CAP振幅逐渐降低,略低于灌流前水平,其I/O曲线在各时间点仍具有非线性特点,提示这种阻断作用具有瞬时性。推测原因可能是,当多巴胺的抑制作用减弱后,谷氨酸的作用增强,内毛细胞突触下复合体产生兴奋性中毒的早期表现,从而使CAP振幅轻度降低。CAP阈值在各时间点均无明显变化,且振幅仍保持非线性特点,说明内毛细胞下突触复合体结构和功能的完整性未受明显影响,但需要进一步形态学的研究证实。
3.3多巴胺D1受体对外毛细胞功能没有影响
CM产生于耳蜗声-电转换环节,小部分是内毛细胞及盖膜压电效应的反映,大部分反映外毛细胞的功能[12]。载体的外毛细胞胞内记录证明,CM的I/O曲线表现出非线性特点,CM非线性特点由外毛细胞的功能决定。DPOAE主要起源于外毛细胞,选择性损伤外毛细胞可以使DPOAE减弱,选择性损伤内毛细胞DPOAE无明显变化。本研究发现全耳蜗灌流多巴胺D1受体拮抗剂前后,各时间点CM及DPOAE振幅均无明显改变,且CM I/O仍呈非线性特点,从电生理的角度证明了多巴胺D1受体对外毛细胞功能没有影响。Darrow等[13]用免疫组化的方法发现多巴胺能神经末梢不支配II型节细胞树突,而仅存在于内毛细胞区域。这与本研究的实验结果相符。
4 展望
国内外研究表明,各种突发性聋和声损伤等引起的暂时性听力损失可有一定程度的恢复,进而开展了有关耳蜗损伤后修复的研究。Ruttiger等[14]发现,动物在声创伤后,耳蜗的高频区内毛细胞内突触体减少和传入神经受阻;在通过行为学检查,被认为耳鸣的大鼠耳蜗内,内毛细胞内突触体减少的更加明显。因此,内毛细胞内突触体结构和功能异常,被认为与传入神经退变相关。研究发现[15],在强声、缺血等环境下,传入突触的急性损伤在5天内完成再生长,谷氨酸N-甲基-D天门冬氨酸(NMDA)受体在病理状态下具有亲神经性,延缓神经突的生长,阻碍神经损伤修复;多巴胺D1受体与NMDA受体的羧基端可以通过蛋白-蛋白相互作用,D1受体被阻断后可能引起NMDA受体功能异常,从而促进传入神经再生,维持耳蜗正常形态和功能。对多巴胺及其受体功能的揭示,可能为听神经损伤修复提供新的治疗靶点。另有研究发现[16],在动物耳鸣模型中,下丘内多巴胺水平显著降低,表明多巴胺作为重要神经递质参与耳鸣发生。随着对多巴胺及其受体在耳蜗及中枢中作用的不断深入研究,相信一定能为耳鸣等疾病的治疗提供新思路。
1 李兴启,申卫东,卢云云等.从内毛细胞下突触复合体结构和功能看听神经病的发病机制及部位——读书心得[J].听力学及语言疾病杂志.2005,13(4):223-225.Li XQ,Shen WD,Lu YY,et al.The Mechanism and Location of Auditory Neuropathy from the Structure and Function of the Syn⁃aptic Complex under the Inner Hair Cells-Profited from Read⁃ing[J].Journal of Audiology and Speech Pathology,2005;13(4):223-225.
2 Darrow KN,Maison SF,Liberman MC.Selective Removal of Lat⁃eral Olivocochlear Efferents Increases Vulnerability to Acute Acoustic Injury[J].Neurophysiol,2007,97(2):1775-1785.
3 郭玲伶,余力生,李兴启.多巴胺受体在耳蜗中的分布及其功能[J].国际耳鼻咽喉头颈外科杂志.2009,33(4):205-208.Guo LL,Yu LS,Li XQ.The Distribution and Function of Dopa⁃mine Receptors in the Cochlea[J].International Journal of Otolar⁃yngology-Head and Neck Surgery,2009,33(4):205-208.
4 Beaulieu JM,Gainetdinov RR.The Physiology,Signaling,and Pharmacology of Dopamine Receptors[J].Pharmacol Rev,2011,63(1):182-217.
5 Niu X,Canlon B.The Signal Transduction Pathway for the Dopa⁃mine D1 Receptor in the Guinea-pig Cochlea[J].Neuroscience,2006,137(3):981-990.
6 Gaborjan A,Lendvai B,Vizi ES.Neurochemical Evidence of Dopa⁃mine Release by Lateral Olivocochlear Efferents and its Presynap⁃tic Modulation in Guinea-pig Cochlea[J].Neuroscience,1999,90(1):131-138.
7 Ruel J,Nouvian R,Gervais AC,et al.Dopamine Inhibition of Au⁃ditory Nerve Activity in the Adult Mammalian Cochlea[J].Eur J Neurosci,2001,14(6):977-986.
8 Sun W,Salvi RJ.Dopamine Modulates Sodium Currents in Co⁃chlear Spiral Ganglion Neurons[J].Neuroreport,2001,12(4):803-807.
9 郭玲伶,余力生,李兴启.多巴胺对豚鼠噪声性听力损失的保护作用[J].中国耳鼻咽喉头颈外科.2010,17(8):411-414.Guo LL,Yu LS,Li XQ.The Protective Effect of Dopamine on the Noiseinduced Hearing Loss of Guinea Pigs[J].Chinese Archives of Otolaryngology-Head and Neck Surgery,2010,17(8):411-414.
10 Lendvai B,Halmos GB,Polony G.,et al.Chemical Neuroprotec⁃tion in the Cochlea:The Modulation of Dopamine Release from Lateral Olivocochlear Efferents[J].Neurochem Int,2011,59(2):150-158.
11 孙勍,孙建和,单希征等.谷氨酸对豚鼠畸变产物耳声发射和听性脑干反应的影响[J].中华耳鼻咽喉头颈外科杂志.2005,40(6):435-439.Sun Q,Sun JH,Shan XZ,et al.Effect of Glutamate on Distortion Product Otoacoustic Emission and Auditory Brainstem Response in Guinea Pigs[J].Chinese Journal of Otorhinolaryngology Head and Neck Surgery,2005;40(6):435-439.
12 曾凡倩,郑铨艺,柯朝阳.短纯音耳蜗微音电位评估耳蜗功能的临床应用价值[J].中华耳科学杂志.2017,15(2):157-162.Zeng FQ,Zheng QY,Ke CY.Clinical Values of Tone Burst Evoked Cochlear Microphonics in Evaluating Cochlear Function.Chinese Journal of Otology,2017,15(2):157-162.
13 Darrow KN,Simons EJ,Dodds L,et al.Dopaminergic Innervention of the Mouse Inner Ear:Evidence for a Separate Cytochemical Group of Cochlear Efferent Fibers[J].J Comp Neurol,2006,498(3):403-414.
14 Ruttiger L,Singer W,Panford-Walsh R,et al.The Reduced Co⁃chlear Output and the Failure to Adapt the Central Auditory Re⁃sponse Causes Tinnitus in Noise Exposed rats[J].PLoS One,2013,8(3):e57247.
15 Ruel J,Wang J,Rebillard G,et al.Physiology,Pharmacology and Plasticity at the Inner Hair Cell Synaptic Complex[J].Hear Res,2007,227(1-2):19-27.
16 刘俊秀,刘轶君,毛兰群等.水杨酸钠对大鼠下丘多巴胺水平影响的研究[J].中华耳科学杂志.2016,14(2):167-169.Liu XJ,Liu YJ,Mao LQ,et al.Effects of Salicylate on Dopamine Levels in Rat Inferior Colliculus[J].Chinese Journal of Otology,2016,14(2):167-169.
