两性霉素B产生菌的诱变育种及发酵条件优化
2018-07-06,,,
,,,
(1.浙江省生物有机合成技术研究重点实验室,浙江 杭州 310014;2. 浙江工业大学 生物工程学院,浙江 杭州 310014)
两性霉素B(Amphotericin B,AmB)是由Streptomycesnodosus产生的一种能有效抑制念珠菌、隐球菌和曲霉菌等大多数真菌的多烯大环内酯类抗生素[1],主要用于临床治疗深部真菌感染,也是临床治疗利什曼病的唯一一个尚未发现耐药性的抗生素[2-3],具有高效广谱和耐药菌株少等优点.尽管AmB已经上市50多年,且各种新开发的抗真菌药物如棘白菌素类抗生素推广使用的情况下[4],AmB在临床应用上依然不可替代,被视为治疗许多重度深部真菌感染的“黄金标准”[5-6].目前工业上AmB的生产菌主要是S.nodosus,但由于该菌种发酵周期长、两性霉素B发酵单位低和工业化生产工艺不稳定导致生产成本过高,严重限制了AmB的工业化生产.因此采用育种技术提高AmB产生菌的生产性能,对于降低AmB的生产成本、提高市场竞争力具有重要的意义.
目前工业微生物的育种方法主要有两种:一种是传统诱变育种技术,另一种是现代基因工程技术,即通过定向改造菌种的特定基因来提升菌种的生产性能,但是由于链霉菌的抗生素合成基因呈簇状排列,很难通过改变单个基因或调控因子来达到预期目标[7].而传统的诱变育种技术可以在不明晰微生物的遗传背景的条件下,只需要重复进行诱变选育、发酵和分析就可以获得生产性能优良的菌株[8].因此,传统的诱变育种技术仍是链霉菌选育的重要手段.笔者以AmB产生菌结节链霉菌S.nodosus150802为出发菌株,对其进行紫外诱变,以期选育出一株具有遗传稳定性的高产突变菌株,并对其发酵条件进行优化,提高其产AmB的发酵水平.
1 材料与方法
1.1 材 料
1.1.1 实验菌株
S.nodosus150802,实验室保藏菌株.
1.1.2 培养基
GYM固体培养基:葡萄糖4.0 g/L,酵母粉4.0 g/L,麦芽浸粉10.0 g/L,碳酸钙2.0 g/L,琼脂16.0 g/L(注:加琼脂前调节培养基pH值至7.2).
种子培养基:蛋白胨15.0 g/L,葡萄糖10.0 g/L,酵母粉10.0 g/L,碳酸钙1.0 g/L,氯化钠5.0 g/L(注:以质量分数为4%的NaOH溶液调节培养基pH值至6.8~7.0).
发酵培养基:牛肉膏25.0 g/L,葡萄糖70.0 g/L,磷酸二氢钾0.1 g/L,碳酸钙9.0 g/L.
1.1.3 色谱条件
采用日立Primaide型高效液相色谱仪[9].色谱柱选择Unitary C18(4.6 mm×250 mm,5 μm);流动相由pH 5.0,30 mmol/L的乙二胺四乙酸二钠-乙酸钠缓冲液(冰醋酸调节)与乙腈和甲醇按照体积比40︰35︰20混合配制而成;流速1.0 mL/min;柱温25 ℃;检测器波长设置为405 nm;进样量20 μL.
1.2 方 法
1.2.1 培养方法
1) 孢子平板制备:取100 μL生长到对数期的种子液涂布GYM生孢子平板,置于28 ℃的培养箱中,培养3~5 d,依菌落生长状况而定.
2) 种子培养:将甘油管保藏的菌种接种到每250 mL添加50 mL的含种子培养基的三角瓶中,置于转速为200 r/min的摇床上,25 ℃培养48 h.
3) 发酵培养:以5%接种量将种子液接至发酵培养基的三角瓶中,置于转速为200 r/min的摇床上,25 ℃培养7 d.
1.2.2 单孢子悬液制备
取培养成熟的孢子平板,加入无菌水,用接种环轻轻刮下孢子,将含有孢子的孢子悬液接种到50 mL带塞三角瓶中,加入5~10 粒玻璃珠,在250 r/min摇床上打散孢子,经滤纸过滤后即可得到单孢子在98%以上的单孢子悬液[10].
1.2.3 紫外诱变方法
选取30 W紫外灯进行照射,诱变前先打开紫外灯预热20 min,然后将含有200 μL菌悬液的空平板置于距离紫外灯大约20 cm处照射,照射时间分别为10,20,30,60,90,120 s.照射结束后,每个培养皿中各取100 μL菌液,按一定浓度稀释涂布平板,于黑暗中25 ℃培养3~5 d后计数,以未经过诱变的单孢子悬液涂布平板的菌落数为空白对照,计算致死率M,确定最佳紫外照射时间.挑取生长良好的单菌落接种至种子培养基,培养48 h后接种于发酵培养基培养7 d,然后通过HPLC检测AmB的含量,得出菌株的正突变率MP.致死率M的计算式为
(1)
式中:N0为诱变前生物量密度,个/mL;N诱变后剩余生物量密度,个/mL.正突变率MP的计算式为
(2)
式中:Y0为诱变前AmB产量,g/L;Y为诱变后正突变体的AmB产量,g/L.
1.2.4 突变菌株筛选
取经紫外诱变后存活的孢子,适当稀释后涂布于GYM平板,同时将未经过诱变处理的孢子悬液适当稀释后涂布平板作为对照,待平板上孢子生长成熟后挑取单菌落接至种子培养基中培养48 h后,以5%接种量接种子液至发酵培养基中,25 ℃,200 r/min培养7 d,测定AmB含量.并挑选出高产菌株立即甘油管保存,同时进行复筛.
1.2.5 菌株稳定性测定
对挑选出的突变菌株连续传代5 次,并将每代菌株进行摇瓶发酵培养实验,测定AmB含量.
1.2.6 发酵条件优化
采用单因素实验方法分别考察菌株的发酵时间、接种量、培养温度及装液量等参数对AmB产量的影响.
1) 发酵时间的确定:以5%的接种量将种子液接种至发酵培养基中,置于200 r/min摇床上,25 ℃培养1,2,3,4,5,6,7,8,9 d,待发酵结束后测定菌体生物量和AmB发酵单位.
2) 培养温度的确定:以5%的接种量将种子液接种至发酵培养基中,置于200 r/min摇床上,分别在25,28,30,32 ℃条件下培养7 d,待发酵结束后测定菌体生物量和AmB发酵单位.
3) 接种量的确定:分别以2%,4%,6%,8%,10%的接种量将种子液接种至发酵培养基中,置于200 r/min摇床上,28 ℃培养7 d,待发酵结束后测定菌体生物量和AmB发酵单位.
4) 装液量的确定:以6%的接种量分别将种子液接种至装有30,40,50,60,70 mL/瓶的发酵培养基的250 mL摇瓶中,置于200 r/min摇床上,28 ℃培养7 d,待发酵结束后测定菌体生物量和AmB发酵单位.
1.2.7 发酵液AmB发酵单位检测
取1 mL发酵液于试管中,加入9 mL二甲基亚砜,室温条件下振荡5~8 min,然后静置30 min左右,取2 mL上清液于离心管中,12 000 r/min离心8 min去除链霉菌菌丝体.移取500 μL发酵液上清液与500 μL甲醇,置于EP管中充分混合,用0.22 μm微孔滤膜过滤,滤过液进行HPLC分析.
1.2.8 菌体生物量的测定
生物生物量测定采用干重法.移取1 mL发酵液至2 mL EP管中,12 000 r/min离心8 min,弃上清,沉淀用去离子水洗涤3 次,菌体置于80℃烘箱烘干至恒重后,称量菌体干重.
2 结果与分析
2.1 紫外照射时间对结节链霉菌的致死效应
将结节链霉菌的菌悬液在30 W紫外灯下进行照射处理,处理时间分别为10,20,30,60,90,120 s,培养结束后计算菌落数,致死率和正突变率数据如图1所示.

图1 紫外辐射时间对S.nodosus 150802的诱变效果Fig.1 Mutagenic effect of UV irradiation time on S.nodosus 150802
过高或过低的致死率都不利于正突变的发生,通常致死率70%~80%效果较好[11].由图1可见:随着照射时间的增加,菌株的致死率随之升高,当照射时间为60 s时,菌株的致死率达到了79.1%,诱变菌株的正突变率也为最大;继续增加照射时间,在照射时间为90 s时菌株的致死率已经达到了96.6%.因此选择60 s作为紫外照射处理时间.
2.2 AmB高产突变株的筛选
将经过紫外辐射60 s后的菌悬液稀释涂布GYM固体培养基,待生长成熟后挑取单菌落接至种子培养基中,25 ℃培养48 h.制备的种子液按照5%接种量接种到发酵培养基中,用HPLC测定AmB的产量,结果如表1所示.
表1摇瓶规模初步筛选紫外诱变阳性突变体
Table1Preliminaryscreeningforpositivemutantsonshakingflaskscale

编号AmB产量/(g·L-1)提高水平/%出发菌株2.05±0.02UV-12.43±0.0518.5±1.0UV-22.07±0.011.0±0.5UV-32.13±0.053.9±1.1UV-42.44±0.0319.0±0.8UV-52.32±0.0513.2±0.8UV-62.39±0.0416.6±1.0UV-72.07±0.011.0±0.6UV-82.07±0.011.0±0.5UV-92.11±0.042.9±1.5UV-102.09±0.032.0±0.5UV-112.09±0.022.0±0.6UV-122.29±0.0311.7±0.8UV-132.46±0.0420.0±1.0UV-142.09±0.032.0±0.6
从表1可以看出:在选出的14 株突变株中,有6 株AmB产量较出发菌株提高了10%以上,其中,AmB发酵单位最高的是突变体UV-13,其AmB产量达到了2.46 g/L,比出发菌株提高了20.0%,因此选择次该突变菌株进行遗传稳定性实验.
2.3 遗传稳定性的测定
将筛选出的优选突变体S.nodosusUV-13连续传代5 代后,进行摇瓶发酵培养实验.通过HPLC测定AmB产量分析表明:传代后的突变菌株发酵合成AmB的产量没有明显大幅下降,结果如表2所示,实验筛选到AmB高产突变菌株具有较好的遗传稳定性.

表2 S. nodosus UV-13遗传稳定性Table 2 Genetic stability of S. nodosus UV-13
2.4 摇瓶发酵条件的优化
2.4.1 不同发酵时间对AmB产量的影响
S.nodosusUV-13发酵合成AmB的进程曲线如图2所示.结节链霉菌不同于其他微生物,其生长非常缓慢,这个特点也是导致AmB产量较低的原因之一.所以,发酵时间对AmB的产量有很大影响.由图2可以看出:产AmB的最佳时间要落后于菌体达到最大生物量的时间.菌体在培养5 d时达到最大,干重为44.1 g/L.而AmB的合成在7 d时达到最大,达到了2.46 g/L,之后随着发酵的进行AmB产量逐渐下降.摇瓶发酵周期定为7 d.
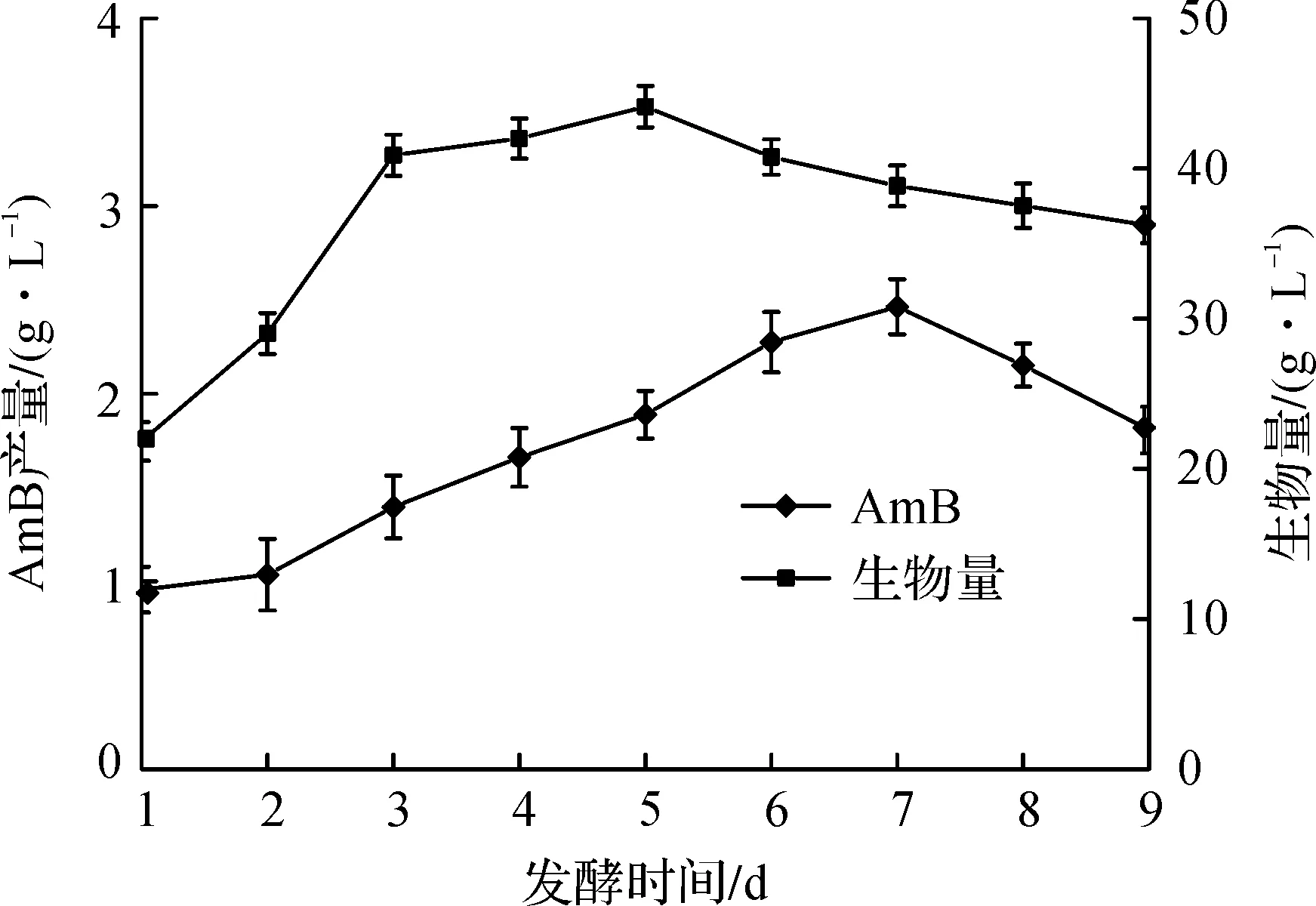
图2 S. nodosus UV-13发酵合成AmB的进程曲线Fig.2 Time course of S. nodosus UV-13 fermenting AmB
2.4.2 不同培养温度对AmB产量的影响
温度对AmB发酵单位的影响如图3所示.培养温度为28 ℃时,AmB产量达到为3.47 g/L;温度降低到25 ℃时,AmB产量略有降低,但变化不大;而当温度超过30 ℃时,AmB产量大幅度降低,这可能时由于温度过高,菌体细胞代谢活动加快,使得菌体细胞提前衰老,同时由于代谢活动加快,有害代谢产物积累使细胞中毒死亡,不利于抗生素的合成.

图3 温度对AmB发酵单位的影响Fig.3 Effect of temperature on AmB titer
2.4.3 不同接种量对AmB产量的影响
接种量对AmB发酵单位的影响如图4所示.当接种量为2%时,菌体生物量最低,相应的AmB产量也最低,仅1.26 g/L.随着接种量的增加,菌体生物量和AmB产量呈现先增后减趋势,当接种量为6%时,菌体生物量和AmB产量均达到最大,分别为40.9,3.54 g/L;而接种量增大到10%时,AmB发酵单位仅为2.86 g/L.因此,选择摇瓶发酵的最适接种量为6%.

图4 接种量对AmB发酵单位的影响Fig.4 Effect of inoculum size on AmB titer
2.4.4 不同装液量对AmB产量的影响
结节链霉菌是好氧微生物,氧对于结节链霉菌的生长和发酵来说都是至关重要的一个影响因素.氧是影响微生物代谢的重要因素之一,它主宰着细胞的呼吸、生长和代谢产物的生物合成等[12].装液量对AmB产量的影响如图5所示,实验采用250 mL的摇瓶.由图5可见:摇瓶装液量显著影响AmB发酵单位和生物量.当装液量为50 mL时,菌体生物量和AmB发酵单位均为最大,分别为44.5 g/L和3.80 g/L;而过大或过小的装液量均不利于AmB的合成.
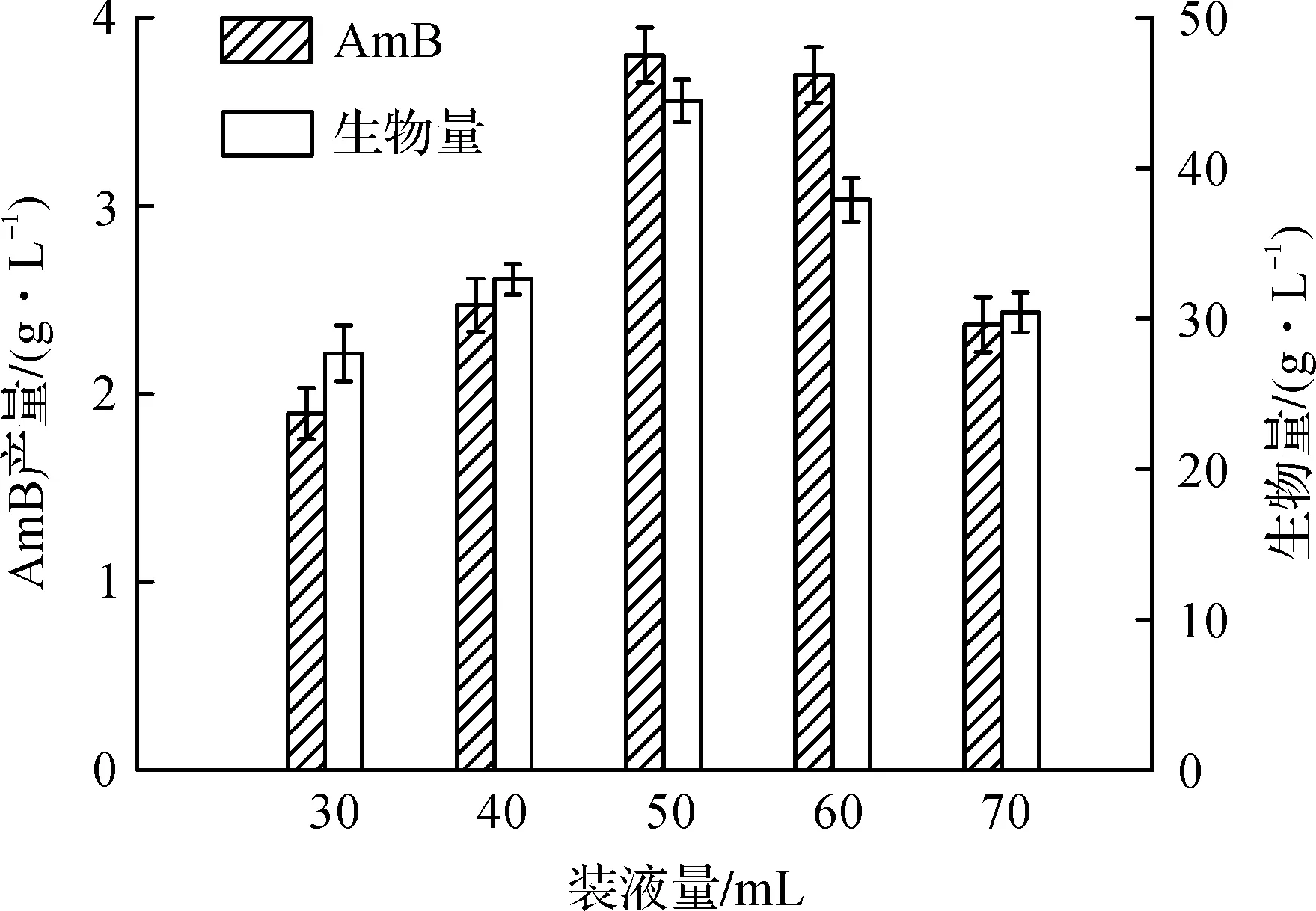
图5 装液量对AmB发酵单位的影响Fig.5 Effect of media loading size on AmB titer
2.4.5 采用正交试验设计优化突变株的发酵条件
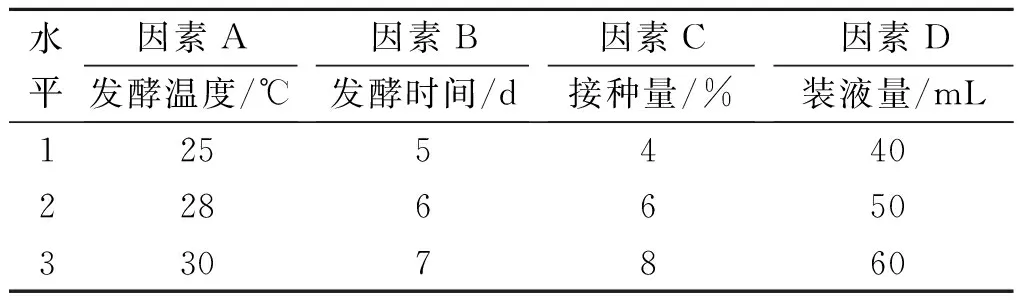
从影响AmB产量的因素中选取了发酵温度、发酵时间、接种量和装液量等4 个重要因素进行正交试验.设计了L9(34)正交试验方案[13],实验因素水平和实验结果如表3,4所示.
表3发酵条件优化L9(34)正交试验因素水平
Table3FactorsandlevelsofL9(34)orthogonaltestoffermentationconditionsoptimization
水平因素A发酵温度/℃因素B发酵时间/d因素C接种量/%因素D装液量/mL125544022866503307860
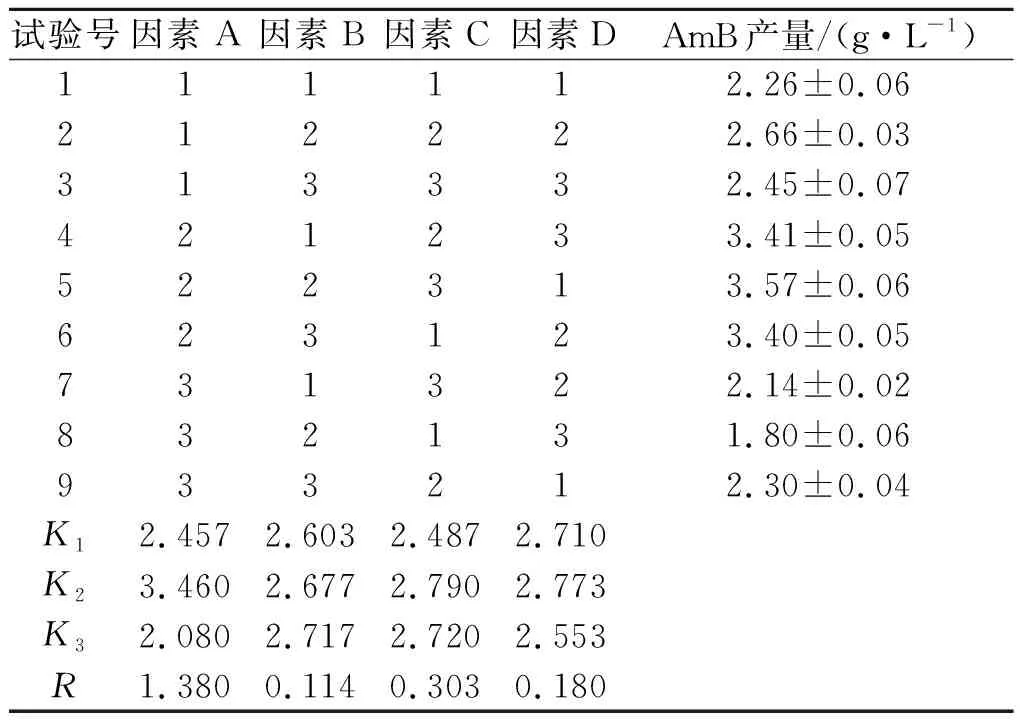
表4 正交试验结果与分析Table 4 Result and analysis of orthogonal test
由表4可见:发酵温度、发酵时间、接种量和装液量等4 个因素对AmB产量影响的主次顺序为因素A发酵温度>因素C接种量>因素D装液量>因素B发酵时间,这表明4 个因素中发酵温度对AmB产量的影响最大,且最佳组合为A2B3C2D2.在最佳发酵条件下发酵3 批,两性霉素平均发酵单位为4.14 g/L.
3 结 论
通过对结节链霉菌S.nodosus150802进行紫外诱变,选育出了具有遗传稳定性的正突变株UV-13.在诱变育种的基础上,采用了单因素实验设计对S.nodosusUV-13突变菌株的摇瓶发酵条件进行了初步优化,获得优选发酵条件为发酵温度为28 ℃,发酵接种量为6%,250 mL摇瓶装液量为50 mL,发酵时间为7 d.在最优条件下,AmB的产量达到了3.80 g/L,较原始菌株提高了85.4%.进一步采用正交试验对S.nodosusUV-13发酵条件进行优化研究,发现影响AmB产量的因素主次顺序为发酵温度>接种量>装液量>发酵时间,且发酵温度和接种量为显著性因素.虽然笔者在菌种选育和优化上做了一些工作,但只是单一地利用了紫外诱变方法,后续可以尝试组合多种诱变方式进行高产菌株选育,提高诱变效率.同时在发酵培养基和发酵条件优化等方面进一步完善以及将发酵体系放大到发酵罐体系,为下一步的发酵罐规模化生产试验提供技术支撑.
参考文献:
[1] DONOVICK R,GOLD W,PAGANO J F,et al. Amphotericins A and B,antifungal antibiotics produced by a streptomycete. I.invitrostudies[J]. Antibiotics annual,1955(3): 579-586.
[2] GOLENSER J,DOMB A. New formulations and derivatives of amphotericin b for treatment of leishmaniasis[J]. Mini reviews in medicinal chemistry,2006,6(2): 153.
[3] SINGH N,KUMAR M,SINGH R K. Leishmaniasis:current status of available drugs and new potential drug targets[J]. Asian pacific journal of tropical medicine,2012,5(6): 485-497.
[4] 邹树平,廖思行,牛坤,等.棘白菌素B脱酰基酶工程菌的构建及酶学性质研究[J].浙江工业大学学报,2016,44(1):99-103.
[5] SARAVOLATZL D,OSTROSKY-ZEICHNER L,MARR K A,et al. Amphotericin B: time for a new “gold standard”[J]. Clinical infectious diseases,2003,37(3): 415-425.
[6] 董贤慧,钱涛,高维娟.纳他霉素等多烯类抗生素作用机制及研究方法[J].中国现代应用药学,2010,27(10):878-882.
[7] CAFFREY P,LYNCH S,FLOOD E,et al. Amphotericin biosynthesis inStreptomycesnodosus: deductions from analysis of polyketide synthase and late genes[J]. Chemistry & biology,2003,8(7): 713-723.
[8] 陈立梅,汪旭,李启云,等.链霉菌诱变育种方法综述[J].吉林农业科学,2006,31(2):62-64.
[9] 国家药典委员会.中华人民共和国药典[M].2010年版.北京:中国医药科技出版社,2010:328.
[10] 黄永春,彭祎,谭悠久.链霉菌单孢子悬液制备方法:中国,CN101418278[P].2009-04-29.
[11] 卜美玲.纳他霉素高产菌株的诱变选育及发酵工艺的优化[D].洛阳:河南科技大学,2012.
[12] 章小洪,汪琨,朱廷恒,等.解淀粉芽孢杆菌BW-13培养基和培养条件优化[J].浙江工业大学学报,2013,41(1):35-39.
[13] 欧志敏,杨策,杨根生.度洛西汀中间体生物转化菌株研究[J].浙江工业大学学报,2016,44(3):340-345.
