远华蟾毒精对体外乳腺癌4T1细胞上皮 间质转化的影响*
2018-07-05高玉雪曹珍吕世军朱学涛李峰王茹燕徐金媛钟瑾怡史立宏
高玉雪 曹珍 吕世军 朱学涛 李峰 王茹燕 徐金媛 钟瑾怡 史立宏
(潍坊医学院, 山东 潍坊 261053)
乳腺癌是世界范围内导致女性死亡的常见恶性肿瘤[1-2]。尽管综合检查和各种治疗方法应用于乳腺癌患者,在侵袭与转移方面临床效果仍不理想[3]。上皮-间质转化(epithelial-mesenchymal transition, EMT)不仅参与胚胎生长[4],而且与恶性肿瘤的侵袭与迁移密切相关[5]。远华蟾毒精是传统中药,具有免疫调节、强心和抗肿瘤的作用[6-8]。前期研究发现,远华蟾毒精可抑制乳腺癌细胞的侵袭与转移。因此,本研究进一步观察远华蟾毒精对乳腺癌上皮间质转化的影响,并进一步探讨其作用机制,现将结果报告如下。
1 材料与方法
1.1 细胞与试剂 鼠乳腺癌4T1细胞购自美国ATCC公司,E-钙粘蛋白(E-cadherin)、波形蛋白(Vimentin)、纤维链接蛋百(Fibronectin)抗体购自英国Abcam公司,snail, Akt, P-Akt, m-TOR and P-mTOR购自美国CST公司。
1.2 方法
1.2.1 细胞培养 4T1细胞培养于含10%胎牛血清的培养基中进行培养,置于37℃、5% CO2培养箱中进行培养。细胞长至75%时,胰蛋白酶消化传代。
1.2.2 MTT法检测细胞活性 收集处于对数期4T1细胞,制成4×104个/ml细胞悬液, 100μl接种于96孔细胞培养板中,置于37℃、5% CO2培养箱中过夜培养。设置对照组与实验组,每组3个复孔。实验组每孔加175μl浓度分别为0.05、0.1、0.5、1和1.25μg/ml的远华蟾毒精,对照组不加药;空白对照组只加入培养基。培养24 h后,每孔加入10μl的MTT溶液,继续培养4 h。小心吸去培养液,每孔加入100μl二甲基亚砜,置于摇床上低速震荡10min。在酶联免疫检测仪OD490nm处测量各孔的吸光值。
1.2.3 细胞划痕实验 收集处于对数期4T1细胞,5×105个/孔接种6孔细胞培养板,置于37℃、5% CO2培养箱中过夜培养。用灭菌的10μl枪头均匀划痕,PBS洗3次。设对照组和实验组,实验组培养液含远华蟾毒精浓度分别0.05和0.5μg/ml,各设3个复孔。分别0和24h后用显微镜( ×40) 观察并拍照,比较对照组与实验组的迁移程度,测量迁移距离,并计算迁移率。
1.2.4 Transwell侵袭及迁移实验 将Matrigel胶融化后用预冷的无血清1640按1:19稀释,每个小室加入50μl稀释后的Matrigel,37℃、5% CO2培养箱孵育1h。以5×105/ml的密度将细胞重悬于无血清的1640培养液中,上室接种200μl细胞悬液,实验组药物浓度为0.05和0.5μg/ml,对照组不加药;下室加入600μl含10%胎牛血清的1640,37℃、5% CO2培养箱孵育24h。吸出上室液体,PBS洗涤3次,棉签擦净滤膜上室面细胞,将迁移到膜下室面细胞用4%多聚甲醛固定30min,1%结晶紫染色10min。对于迁移实验,除小室内不铺Matrigel,其他步骤与侵袭实验相同。
1.2.5 免疫荧光 取出24孔板,放入已灭菌的爬片,收集处于对数期4T1细胞,2×104个/孔接种于爬片上,37℃、5% CO2培养箱孵育过夜。实验组药物浓度为0.5μg/ml,对照组不加药,37℃、5% CO2培养箱孵育24h。4%多聚甲醛固定爬片30min;0.5%TritonX-100室温通透20min;山羊血清室温封闭1h。滴加相应一抗60μl,放入湿盒,4℃冰箱孵育过夜。避光滴加荧光二抗,在湿盒中37℃孵育1h。复染核,避光滴加DAPI,在湿盒中室温孵育10min。吸干爬片上的液体,用荧光防淬灭剂将爬片粘到载玻片上,荧光显微镜下观察。
1.2.6 蛋白质提取及蛋白质印迹检测 收集对照组与实验组(0.05和0.5μg/ml)远华蟾毒精处理的4T1细胞,加入预冷裂解液,冰上裂解后,4℃12000rpm离心5min,BCA法测浓度,蛋白质样品与上样缓冲液混合,100℃沸水中煮5min,置于-20℃保存。然后在SDS-PAGE胶中进行电泳,电泳结束后将胶上的蛋白转移到PVDF膜上,用5%的脱脂奶粉37℃封闭1h后, 孵育相应一抗4℃过夜。TBST洗膜3次,10min/次,加入二抗,室温孵育1h。TBST洗膜3次,10min/次,ECL化学显色。

2 结果
2.1 远华蟾毒精对4T1细胞增殖影响 MTT试验结果,抑制率= [(对照组平均OD值一实验组平均OD值)/(对照组平均OD值一空白对照组平均OD值)]×100%,观察组不同浓度(0.05、0.1、0.5和1μg/ml)远华蟾毒精对细胞增殖的抑制率分别为(5.4±3.4)%、( 8.0±3.5)%、(10.2±3.5)% 和(13.0±6.8)%,与对照组比较差异无统计学意义(P>0.05);浓度分别为1.25和1.5μg/ml的远华蟾毒精对细胞增殖的抑制率分别( 38.8±8.8)%和(64.3±14.0)%,与对照组比较差异有统计学意义(P<0.05)。低浓度远华蟾毒精对细胞增殖影响不明显,因此采用0.05和0.5μg/ml的远华蟾毒精进行实验。
2.2 远华蟾毒精对4T1细胞迁移影响 划痕实验结果,24h后,对照组、0.05和0.5μg/ml实验组细胞划痕迁移率分别为(85.8±5.2)%、(49.3±4.5)%和(30.3±4.5)%,与对照组相比差异有统计学意义(P<0.05);且两两比较差异均有统计学意义(P<0.05)。远华蟾毒精抑制4T1细胞迁移,且呈浓度依赖性。
2.3 Transwell迁移与侵袭实验 Transwell迁移实验结果,24h后,对照组、0.05和0.5μg/ml实验组穿至下室的细胞数分别为(181.7±16.7)、(88.0±11.6)和(32.7±5.2),差异具有统计学意义(P<0.05);且两两比较差异均有统计学意义(P<0.05)。
Transwell侵袭实验结果,24h后,对照组、0.05和0.5μg/ml实验组穿至下室的细胞数分别为(142.2±14.9)、(55.2±9.3)和(27.5±7.1),差异均有统计学意义(P<0.05);且两两比较差异具有统计学意义(P<0.05)。Transwell迁移与侵袭实验表明,远华蟾毒精对4T1细胞迁移与迁移具有抑制作用,且呈浓度依赖性。
2.4 远华蟾毒精抑制4T1细胞EMT标志物及相关信号通路蛋白的表达 免疫荧光结果显示,24h后,0.5μg/ml远华蟾毒精与对照组相比,上皮标志物E-cadherin表达增强,间质标志物Vimentin和Fibronectin表达减弱,见图1。
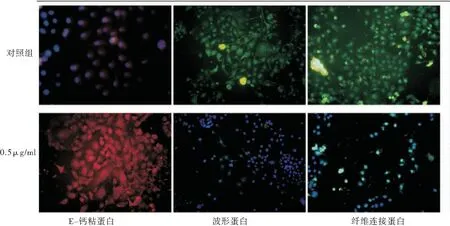
图1 远华蟾毒精对EMT相关标志物的影响 Figure 1 The effects of telocinobufagin on EMT related markers注:红色代表E-钙粘蛋白;绿色代表波形蛋白和纤维连接蛋白
蛋白质印迹法结果,E-钙粘蛋白在对照组(0μg/ml)与实验组(0.05和0.5μg/ml)的相对表达量分别为(1.65±0.27)、(2.65±0.30)、(3.55±0.36),差异具有统计学意义(P<0.05),实验组与对照组相比,上皮标志物E-cadherin表达增强;波形蛋白在对照组(0μg/ml)与实验组(0.05和0.5μg/ml)的相对表达量分别为(1.81±0.18)、(1.20±0.13)、(0.56±0.07),差异均有统计学意义(P<0.05);纤维链接蛋白在对照组(0μg/ml)与实验组(0.05和0.5μg/ml)的相对表达量分别为(6.96±1.75)、(3.78±0.87)、(1.52±0.69),差异均有统计学意义(P<0.05);转录因子Snail在对照组(0μg/ml)与实验组(0.05和0.5μg/ml)的相对表达量分别为(0.67±0.12)、(0.34±0.07)、(0.21±0.04),差异均有统计学意义(P<0.05);间质质标志物波形蛋白和纤维连接蛋白以及转录因子Snail表达减弱。P-AKT在对照组(0μg/ml)与实验组(0.05和0.5μg/ml)的相对表达量分别为(1.15±0.07)、(0.56±0.06)、(0.32±0.03),差异具有统计学意义(P<0.05);p-mTOR在对照组(0μg/ml)与实验组(0.05和0.5μg/ml)的相对表达量分别为(1.27±0.09)、(0.65±0.10)、(0.27±0.05),差异均有统计学意义(P<0.05),磷酸化Akt和mTOR表达减弱。
3 讨论
乳腺癌是危害女性健康最常见的恶性肿瘤, 也是引起妇女死亡的主要原因, 且发病率呈逐年递增趋势[9]。然而,大多数患者的主要致死因素不是原发肿瘤,而是乳腺癌的远处转移。
上皮间质转化是指上皮细胞在特定生理与病理条件下转变成为具有迁移能力的间质表型细胞的过程。EMT不仅参与人体正常的生物学过程,如胚胎的发生和发育、组织重建以及纤维化,而且与肿瘤转移过程有密切关系[10,11]。EMT在乳腺癌的发生、发展中起最重要的作用,同时也参与了转移、侵袭过程,并影响患者对治疗的反应性,也可降低患者生存率[12]。E-cadherin、Vimentin和Fibronectin是EMT典型的标志物[13-14]。转录因子Snail与EMT相关,调节乳腺癌细胞的侵袭与转移[15-16]。当肿瘤发生EMT时, 细胞与细胞间的黏附能力降低,E-cadherin表达下降,Vimentin和Fibronectin表达增强,肿瘤的侵袭与转移能力增加[17-18]。
PI3K-Akt 信号通路诱导肿瘤EMT的发生,参与侵袭转移等多种生物学过程[19]。PI3K/AKT信号可上调细胞内 Snail转录因子的表达,下调E钙黏蛋白的表达,诱导乳腺癌发生EMT[20]。
近年来,中药单体对肿瘤的治疗效果越来越显著,关注程度逐渐增加。远华蟾毒精是从蟾酥中提取的单体化合物,具有抗肿瘤和免疫调节等作用。为了研究远华蟾毒精对乳腺癌侵袭、转移和EMT的影响,该实验选择具有高侵袭能力的鼠乳腺癌4T1细胞,进一步揭示远华蟾毒精对乳腺癌侵袭转移的体外抑制作用。MTT实验结果显示,低浓度远华蟾毒精对4T1细胞增殖有抑制作用,但效果不明显;高浓度远华蟾毒精能明显抑制4T1细胞增殖。划痕实验、Transwell迁移与侵袭实验结果表明,与对照组相比,远华蟾毒精抑制4T1细胞的侵袭与转移;且抑制作用具有浓度依赖性。免疫荧光与蛋白质印迹法结果共同揭示,与对照组相比,远华蟾毒精上调上皮表型E-cadherin,下调间质表型Vimentin和Fibronectin。远华蟾毒精也抑制了转录因子Snail、p-Akt和p-mTOR的表达。从分子水平说明远华蟾毒精抑制4T1细胞EMT,通过Akt/mTOR信号通路,下调转录因子Snail,进而降低下游靶蛋白Vimentin和Fibronectin的表达以及增加E-cadherin的表达,抑制4T1细胞的迁移与转移能力,从而达到抑制肿瘤侵袭与转移的作用。
4 结论
远华蟾毒精通过Akt/mTOR/Snail信号通路抑制乳腺癌的迁移、侵袭及EMT,为远华蟾毒精的临床应用提供了理论依据。
【参考文献】
[1]Cai F F, Chen S, Wang M H,etal. Pyrosequencing quantified methylation level of BRCA1 promoter as prognostic factor for survival in breast cancer patient[J]. Oncotarget,2016, 7(19):27499-27510.
[2]Taherkhani M, Mahjoub S, Moslemi D,etal. Three cycles of AC chemotherapy regimen increased oxidative stress in breast cancer patients: A clinical hint[J]. Caspian Journal of Internal Medicine, 2017, 8(4):264-268.
[3]Van d W M, Dockx Y, Van d W T,etal. Neoadjuvant systemic therapy in breast cancer: Challenges and uncertainties[J]. European Journal of Obstetrics & Gynecology & Reproductive Biology, 2017, 210:144-156.
[4]Baum B, Settleman J, Quinlan M P. Transitions between epithelial and mesenchymal states in development and disease[J]. Seminars in Cell & Developmental Biology, 2008, 19(3):294.
[5]Nieto M A. Epithelial-Mesenchymal Transitions in development and disease: old views and new perspectives[J]. International Journal of Developmental Biology, 2009, 53(8-10):1541.
[6]Cao Y, Song Y, An N,etal. The effects of telocinobufagin isolated from Chan Su on the activation and cytokine secretion of immunocytes in vitro[J]. Fundamental & Clinical Pharmacology, 2009, 23(4):457-464.
[7]Qi F, Li A, Inagaki Y,etal. Antitumor activity of extracts and compounds from the skin of the toad Bufo bufo gargarizans Cantor[J]. International Immunopharmacology, 2011, 11(3):342-349.
[8]Touza N A, P as E S, Quintas L E,etal. Inhibitory effect of combinations of digoxin and endogenous cardiotonic steroids on Na+/K+-ATPase activity in human kidney membrane preparation.[J]. Life Sciences, 2011, 88(1-2):39-42.
[9]Ilgun S, Sarsenov D, Erdogan Z,etal. Receptor discordance rate and its effects on survival in primary and recurrent breast cancer patients[J]. Journal of B.u.on. Official Journal of the Balkan Union of Oncology, 2016, 21(6):1425.
[10] Tian M, Schiemann W P. TGF-β stimulation of EMT programs elicits non-genomic ER-α activity and anti-estrogen resistance in breast cancer cells[J]. Journal of cancer metastasis and treatment, 2017, 3(8):150.
[11] Chowdhury K, Sharma A, Kumar S,etal. Colocynth Extracts Prevent Epithelial to Mesenchymal Transition and Stemness of Breast Cancer Cells[J]. Frontiers in Pharmacology, 2017, 8:593.
[12] Hu S H, Wang C H, Huang Z J,etal. miR-760 mediates chemoresistance through inhibition of epithelial mesenchymal transition in breast cancer cells[J]. European Review for Medical & Pharmacological Sciences, 2016, 20(23):5002.
[13] Liu F, Gu L, Shan B,etal. Biomarkers for EMT and MET in breast cancer: An update[J]. Oncology Letters, 2016, 12(6):4869.
[14] McCart Reed A E, Kutasovic J R, Vargas A C,etal. An Epithelial to Mesenchymal Transition programme does not usually drive the phenotype of Invasive Lobular Carcinomas[J]. Journal of Pathology, 2016, 238(4):489.
[15] Qin G, Xu F, Qin T,etal. Palbociclib inhibits epithelial-mesenchymal transition and metastasis in breast cancer via c-Jun/COX-2 signaling pathway[J]. Oncotarget, 2015, 6(39):41794-41808.
[16] Roman M, Matyunina L V, Neda J,etal. Snail-induced epithelial-to-mesenchymal transition ofMCF-7breast cancer cells: systems analysis of molecular changes and their effect on radiation and drug sensitivity[J]. Bmc Cancer, 2016, 16(1):236.
[17] Noman M Z, Janji B, Abdou A,etal. The immune checkpoint ligand PD-L1 is upregulated in EMT-activated human breast cancer cells by a mechanism involving ZEB-1 and miR-200[J]. Oncoimmunology, 2017, 6(1):1263412.
[18] Lima J F, Nofechmozes S, Bayani J,etal. EMT in Breast Carcinoma—A Review[J]. Journal of Clinical Medicine, 2016, 5(7):65.
[19] Zhao Q Y, Ju F, Wang Z H,etal. ING5 inhibits epithelial-mesenchymal transition in breast cancer by suppressing PI3K/Akt pathway[J]. Int J Clin Exp Med, 2015, 8(9):15498-505.
[20] Xiao L, Zhou J, Ning Z,etal. SYNJ2BP inhibits tumor growth and metastasis by activating DLL4 pathway in hepatocellular carcinoma[J]. Journal of Experimental & Clinical Cancer Research, 2016, 35(1):115.
