猪毛尾线虫的检测及其ITS序列分析
2018-07-04郭楠楠张帆帆唐玉新吴家斌宋德平
郭楠楠,张帆帆,唐玉新,张 敏,吴家斌,吴 琼,叶 昱*,宋德平*
(1.江西农业大学动物科学技术学院,江西南昌 330045;2.江西省畜禽疫病诊断和防控重点实验室,江西南昌 330045)
毛尾线虫俗称鞭虫,属于无尾感器纲(Aphasmidea)、毛尾目(Trichurata)、毛尾科(Trichuridae)、毛尾属(Trichuris),寄生在人体和动物肠道,可引起人畜共患的寄生虫病。猪毛尾线虫(T.suis)又称猪鞭虫,寄生于猪盲肠和结肠内,是导致仔猪和育肥猪腹泻的常见猪寄生虫。猪毛尾线虫虫体呈乳白色,虫体前段细长,呈丝状,后部粗短;是一种具有直接型生活史的蠕虫,在流行病学上被称为土源性蠕虫,可在土壤中存活5年,且感染能力较强[1]。哺乳及保育、育肥猪等易感,主要是通过食入被感染性虫卵污染的饮水或者饲料而感染。被食入的感染性虫卵到达小肠后,幼虫从虫卵中逸出,进入小肠绒毛,经过一段时间的发育后逐渐移行至盲肠和结肠内,且可在肠系膜上固着并发育为成虫。仔猪和育肥猪感染后主要表现为间歇性或顽固性腹泻,粪便中可见黏液或血液;随着病程发展,猪只食欲不振、被毛粗乱、消瘦,进而引起死亡或其他疾病,如链球菌病、支原体肺炎等。该病发病率可达20%~60%,传播迅速,死亡率较高,而且偶尔也会感染人[2],是危害猪群和人类的重要公共卫生疾病。病猪主要在肠道、肝脏和肺脏等部位发生病理变化,表现为盲肠和结肠内充满虫体,肠系膜胶冻样,肝脏出现灰白色寄生虫结节包囊[2]。目前对该病的诊断方法主要有虫体、虫卵观察法和分子生物学诊断方法等,前者主要通过形态学比较进行诊断,但是对形态相近的虫体、虫卵以及幼虫,形态学鉴定具有一定的局限性[3];后者可在分子水平上进行诊断,通过扩增种内高度保守性的内转录间隔区(internal transcribed spacer,ITS)序列[4]并与数据库比对,可实现对该虫的快速检测。
2015年11月,江西某猪场3月龄~5月龄育肥猪出现顽固性腹泻,且腹泻粪便可见黏液,有约10%的猪只出现便血;随后发病猪只出现消瘦、苍白、精神不振等症状,大约5%的发病猪只死亡。通过对典型发病死亡病例的剖检,发现盲肠和结肠内容物恶臭,且肠道内存在大量乳白色的线状虫体;利用饱和盐水漂浮法从肠道内容物中检出大量该虫虫卵,结合成虫与虫卵的形态,初步判断该线虫为猪毛尾线虫。为了对分离的线虫进行进一步的种属鉴定,本研究通过针对寄生虫ITS序列的通用引物,经过PCR扩增ITS片段并测序,鉴定该线虫的种类,为进一步开展分子遗传学和诊断研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 将江西某猪场发病育肥猪部分肠道收集后分装并分别置于4℃和-20℃保存,虫体从发病猪肠道内分离,并用福尔马林溶液保存备用。
1.1.2 主要试剂 蛋白酶K、10×buffer、dNTP Mixture、DNA聚合酶(rTaq)、DNA Marker DL-2000、pMD18-T载体、DNA胶回收试剂盒等为宝生物工程(大连)有限公司产品;TOP 10感受态细胞为北京天根生化科技有限公司产品。
1.2 方法
1.2.1 显微镜检查 挑取约1 g肠道内容物于装有少量饱和氯化钠溶液的100 mL锥形瓶中,搅拌均匀,续加饱和氯化钠溶液至瓶口形成凸面,静置15 min,载玻片中央触及凸面迅速翻转,置显微镜(100×)下观察虫卵并拍照。
1.2.2 虫体DNA的提取 参照万新龙[5]、何旭锋[6]和付美英[7]等对不同线虫DNA的提取,进行虫体DNA的抽提。具体方法如下:挑取1~2条供试虫体放入200 μL的EP管中,向EP管中加入16 μL ddH2O和2 μL 10×buffer,置于-80℃ 4 h;从-80℃取出EP管放入85℃水浴锅中温浴2 min,取出后加入2 μL 蛋白酶K,56℃水浴保温3 h,95℃条件下将蛋白酶K灭活10 min,最后将EP管放入离心机10 000 r/min离心2 min,取上清;将提取的虫体DNA置-20℃保存备用。
1.2.3 PCR扩增 该引物参考彭仕明等[8]针对线虫ITS基因的保守序列设计,其核苷酸序列组成如下:上游引物为:5′-GTAGGTGAACCTGCGGAAGGATCATT-3′,下游引物为:5′-TTAGTTTCTTTTCCTCCGCT-3′。
PCR扩增反应体系为:2.5 μL DNA模板,1 μL dNTPs (2.5 mmol/L),2.5 μL10×PCR buffer,1 μL上游引物(10 μmol/L),1 μL下游引物(10 μmol/L),0.3 μL rTaq(5U/μL),加入ddH2O至25 μL。反应程序为:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 2 min,36个循环;最后72℃延伸10 min。扩增产物经含有溴化乙锭的琼脂糖凝胶电泳,并通过凝胶成像系统拍摄记录结果。
1.2.4 扩增片段的克隆、筛选及测序 在紫外灯下将目的条带切下,用DNA胶回收试剂盒对PCR扩增产物进行纯化,纯化之后将其与pMD18-T载体4℃过夜连接,后将产物转入TOP10感受态细胞中,在LB平板(Amp+)涂板过夜培养,挑取单一菌落摇菌扩增后进行菌液PCR检测,筛选阳性克隆送上海生工生物工程技术服务有限公司进行测序。
1.2.5 猪毛尾线虫ITS核苷酸同源性及进化树分析 将测序结果录入NCBI进行比对,根据BLAST结果初步判断其种类。参照GenBank中的18条毛尾线虫ITS基因序列,利用DNAStar 7.10和MEGA 6.0软件进行分析核苷酸序列的同源性,并绘制系统发育进化树。
2 结果
2.1 虫卵检查结果
利用饱和氯化钠漂浮法,在光学显微镜下可观察到新鲜虫卵呈棕黄色,形似腰鼓,两端有塞,且卵壳较厚,大小约为(52~61)μm×(27~30)μm(图1)。根据虫卵形态初步确定为猪毛尾线虫卵。
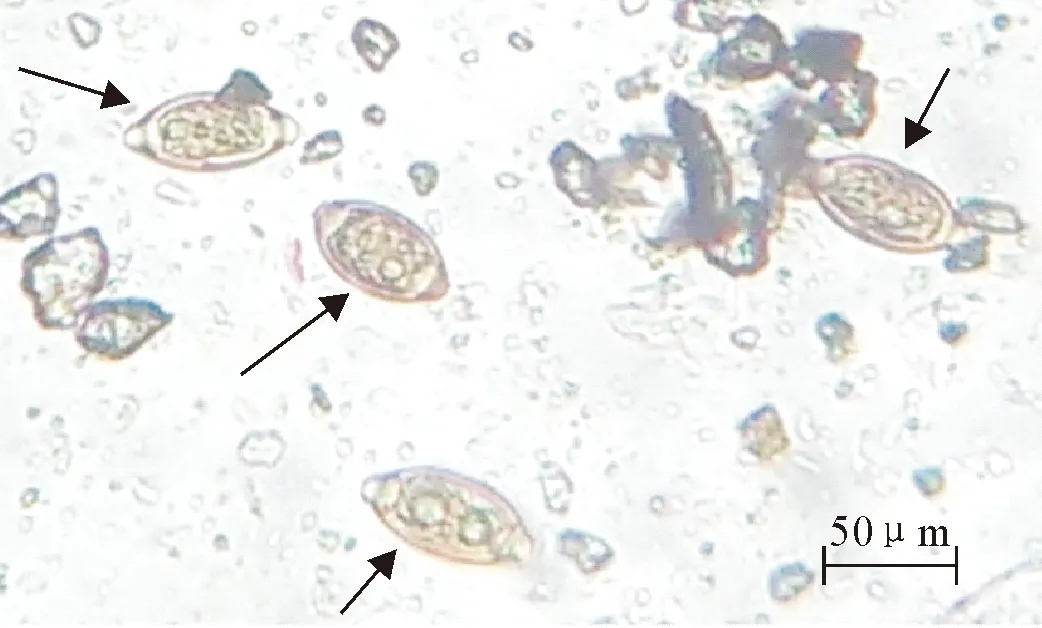
图1 猪毛尾线虫卵(100×)
2.2 虫体ITS序列扩增与测序
提取的虫体DNA经PCR扩增,可见一条约1 345 bp的特异性片段(图2)。序列测定结果与GenBank中登录的序列进行Blast比对,发现该序列与猪毛尾线虫参考序列的同源性高达99.8%,进一步确定该线虫为猪毛尾线虫。

M.DNA 标准DL 2 000; 1.PCR产物; 2.阴性对照
M.DNA Marker DL 2 000; 1.PCR product; 2.Negative control
图2猪毛尾线虫DNA ITS片段的PCR扩增结果
Fig.2 PCR results of ITS gene ofTrichurissuis
2.3 ITS序列系统发育进化树分析
将测序所得序列与GenBank中的18条毛尾线虫序列进行比较,核苷酸同源性分析表明分离虫体的ITS序列与猪毛尾线虫的核苷酸同源性高达99.8%,从遗传学角度确定其为猪毛尾线虫。进化树分析表明,本研究分离的江西地区的猪毛尾线虫与湖南益阳分离的毛尾线虫(AM993005)亲缘关系最近,与广东湛江3型、湖南长沙2型和广东江阳地区的猪毛尾线虫ITS区存在一定的种内差异,但是核苷酸同源性仍>93.5%(图3)。
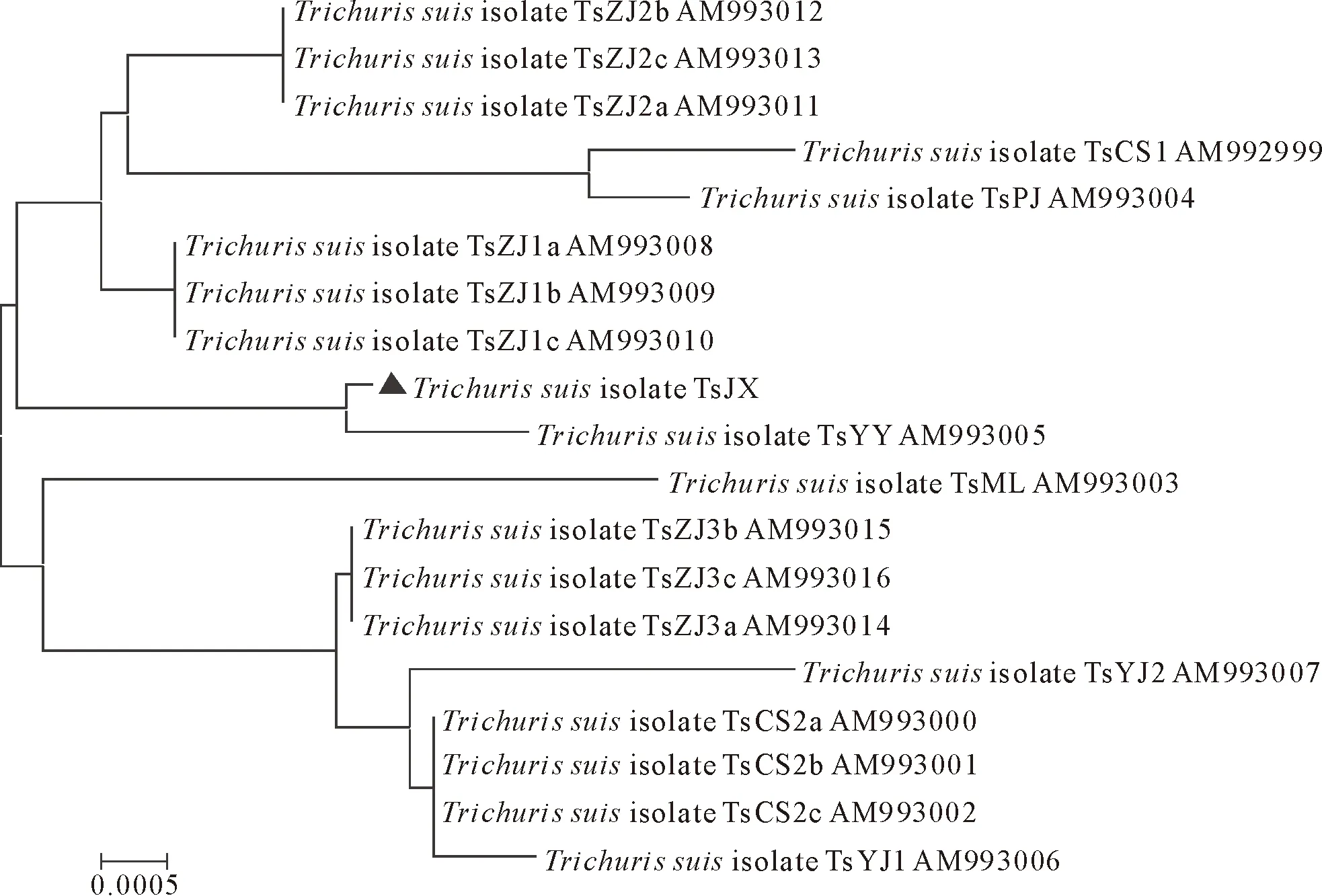
“▲”表示本试验测序线虫“▲” indicates the isolate sequenced in the study
3 讨论
随着生物种群的不断进化,对一些相似种或近缘种的鉴定单纯靠寄生虫的形态学越来越困难,亟需新技术的引入和运用。近年来,寄生虫分子分类学、分子鉴定和分子遗传学等技术在寄生虫种(株)鉴定方面取得了很大的进展,如以PCR技术为基础的限制性片段长度多态性(PCR-RFLP)、内转录间隔区(internal transcribed spacer,ITS)、随机扩增多态性DNA(RAPD)及单链构象多态性(SSCP)分析等[9]。由于核糖体DNA的内转录间隔区序列位于18S和28S之间,在生物进化过程中显示种的特性,在种内具有高度保守性,在不同种间又有不同程度的变异,故被作为遗传标记广泛用于寄生线虫种类鉴定与分类工作[10],尤其是种间分类研究[11]。本研究根据病猪体内分离虫体及虫卵的形态对发病猪进行初步诊断,而后对分离虫体的内转录间隔区扩增并测序以及BLAST比对,进一步从分子水平上确认分离的寄生虫为猪毛尾线虫。将测定的ITS序列与18条参考序列进行比对分析,发现其核苷酸同源性高达99.8%,与湖南益阳地区的猪毛尾线虫亲缘关系最近,与其他地区的猪毛尾线虫ITS存在一定的种内差异,为进一步研究猪毛尾线虫的分类鉴定、遗传变异以及其他相关方面的研究奠定了基础。
猪毛尾线虫是一种常见寄生虫,可引起猪毛尾线虫病,感染强度较高,四季均可发生[12],且夏季发病率相对较高[1],可通过水、食物或者土壤等途径传播,发病猪主要表现为贫血、腹泻以及渐进性消瘦等临床症状,且多发于保育阶段,育肥阶段存在散发现象[13]。少量毛尾线虫寄生不会引起明显的临床症状,但感染猪体内若有大量虫体寄生时则会出现明显的临床症状,严重者引起死亡,给养猪业造成较大的损失。羟嘧啶是治疗毛尾线虫的特效药,本病例确诊后立即用羟嘧啶进行了全面投药,治疗效果确切。猪毛尾线虫卵具有非常强的抵抗力,成虫的药物耐受性较高,通过一次用药并不能彻底清除虫体和虫卵,需要结合驱虫和改善环境卫生等综合性措施控制本病。因此,每年定期对猪群驱虫是必要措施,通常种猪每年驱虫3次~4次,商品猪驱虫2次~3次;在做好驱虫的基础上,采取改善养殖场及周边的环境卫生、定期消毒等预防措施的实施,可以较大程度上减少猪毛尾线虫病的发生。
参考文献:
[1] 晁利刚,姚玉兰,臧 猛,等.猪鞭虫病的防控[J].中国动物保健,2015,17(8):55-56.
[2] 李占霞.猪毛尾线虫病的传播途径、临床表现和防治措施[J].现代畜牧科技,2016,37(8):133.
[3] 李 欣,田守龙,何柳芬,等.鹅蛔虫ITS rDNA的分子特征及种类分析[J].动物医学进展,2017,38(4):19-23.
[4] 宋慧群,李 宾,林瑞庆,等.我国犬钩虫ITS及5.8S rDNA的克隆与序列分析[J].中国兽医科学,2007(9):756-759.
[5] 万新龙,李建洪,彭德良.根结线虫rDNA-ITS片段的克隆与序列分析[J].华中农业大学学报,2007(5):624-628.
[6] 何旭峰,彭 焕,丁 中,等.植物罹病组织中象耳豆根结线虫的LAMP快速检测方法[J].中国农业科学,2013,46(3):534-544.
[7] 符美英,芮 凯,肖彤斌,等.海南岛象耳豆根结线虫的种类鉴定及其rDNA-ITS序列分析[J].生物安全学报,2012,21(1):79-84.
[8] 彭仕明,黄 勉,陈 武,等.棕熊蛔虫ITS rDNA的PCR扩增与序列分析[J].中国兽医寄生虫病,2008(3):1-5.
[9] Chilton N B,Gasser R B,Beveridge I.Phylogenetic relationships of Australian strongyloid nematodes inferred from ribosomal DNA sequence data.[J].Int J Parasitol,1997,27(12):1481-1494.
[10] 牛庆丽,罗建勋,殷 宏.转录间隔区(ITS)在寄生虫分子生物学分类中的应用及其进展[J].中国兽医寄生虫病,2008(4):41-47.
[11] 任 娣,陈 武,宋亚芬,等.斑鼻羚毛首线虫ITS序列的PCR扩增及分析[J].动物医学进展,2011,32(3):47-50.
[12] Kringel H,Roepstorff A.Trichurissuispopulation dynamics following a primary experimental infection[J].Vet Parasitol,2006,139(1-3):132-139.
[13] 武守林.猪鞭虫病的诊断与防治[J].现代畜牧科技,2016(9):156.
