1株红树林来源枝孢属真菌的分离鉴定及纤维素酶性质分析
2018-07-04曾思泉林丽云ManzoorAhmad张燕英董俊德
曾思泉, 凌 娟, 林丽云,4, Manzoor Ahmad, 张燕英,2, 张 颖, 董俊德,2*
(1.中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室 广东省应用海洋生物学重点实验室,广东 广州 510301;2.中国科学院 海南热带海洋生物实验站,海南 三亚 572000;3.中国科学院大学,北京 1100049;4.韩山师范学院 食品工程与生命科技学院,广东 潮州 521041;5.吉首大学 生物资源与环境科学学院,湖南 吉首 416000)
纤维素是地球上含量最丰富的可再生资源(数千亿吨/年),也是光合作用的初级产物,它是葡萄糖单体以β-1,4-糖苷键相连形成的线性多糖。纤维素酶水解纤维素并最终产生葡萄糖,其被广泛应用于食品、饲料、纺织工业等,具有巨大的应用潜力[1-2]。红树林以其独特的生境特征蕴含着丰富的微生物资源,这些微生物包括放线菌、微型藻类、真菌和细菌等,目前分离自红树林的真菌已有一百多种,是海洋真菌的重要来源[3]。细菌和真菌等微生物能够产生完整的纤维素酶系或单体酶,并已投入工业生产,绝大多数商品化纤维素酶都是由可培养真菌分泌的,这些真菌主要为木霉属、曲霉属、青霉属和镰孢属[4-7]。当前,对红树林纤维素降解真菌的研究主要集中在真菌的分离及纤维素降解酶上[8-9]。其中,Arfi等[10]利用转录组学和蛋白组学的方法对一株耐盐红树林木质纤维素降解真菌Pestalotiopsissp.NCi6进行了研究,发现该菌株包含400多种木质纤维素酶,而且红树林中盐分的存在促进了纤维素酶的分泌。在新加坡,Ravindran等[11]在红树林朽木中分离鉴定了一株新的纤维素降解真菌,利用玉米秸秆培养该菌株时,发现了100多种潜在的纤维素酶。此外,其他一些研究聚焦利用不同的底物和理化条件来优化纤维素降解真菌的产酶量。例如Gilna和Khaleel[12]对分离自印度红树林的烟曲霉行了产酶条件优化,发现该菌株最适产酶条件为温度32 ℃,pH 6.5,酵母作为氮源,木屑作为底物。在国内,麦国琴等[13]和高阳等[14]分别以深圳福田和海南东寨港的红树林土壤为样本,对分离得到的纤维素降解真菌进行了分子鉴定并对酶活性进行了分析。近年来国内外对于红树林来源的纤维素降解真菌的研究并不多见。本研究以采集自海南三亚红沙河红树林区域的红海榄根际沉积物为样本,分离获得了多株纤维素降解真菌,并对其中一株酶活性较高的枝孢属真菌进行了形态学、分子生物学研究及纤维素酶酶学性质分析,丰富了我国红树林生态系统纤维素降解真菌的研究成果,在一定程度上为红树林真菌资源的开发利用提供参考。
1 材料与方法
1.1 材料
1.1.1 样品采集 2014年5月在海南省三亚市红沙河沿岸(18.262928N,109.577253E)红树林区,采用五点取样法在10 m×10 m的样方内选取5株红海榄植株,采集根际0~30 cm深度的土样,混匀后放入采样袋中,低温保存。立即送实验室涂布分离样品。
1.1.2 培养基 ①真菌分离培养基:去皮马铃薯200 g切块放入1 000 mL去离子中,沸水煮30 min左右,冷却后4层纱布过滤取汁。土壤浸提液200 mL,葡萄糖20.0 g,琼脂15 g,补足海水至1 000 mL,121 ℃灭菌后加入氨苄青霉素和硫酸链霉素至终浓度100 μg/mL;②PDA培养基;③发酵培养基:酵母粉1.0 g,蛋白胨1.0 g,CMC-Na 5.0 g,蔗糖1.0 g,NaCl 1.5 g,KNO31.0 g,MgSO4·7H2O 0.5 g,K2HPO40.5 g,去离子水1 000 mL;④纤维素酶活鉴定培养基:羧甲基纤维素钠10.0 g,NaCl 1.5 g,MgSO4·7H2O,0.5 g,K2HPO40.5 g,KNO31.0 g,刚果红染料0.2 g,琼脂粉15 g;去离子水1 000 mL。
1.2 方法
1.2.1 真菌的分离筛选[15]沉积物搅拌均匀,取20 g于含有50 mL灭菌海水的三角瓶中,28 ℃、180 r/min震荡30 min,静置2 min后取上清液等比稀释至1/2、1/4、1/8浓度,取0.5 mL菌液,涂布于分离培养基上,每个浓度设置10个重复。28 ℃培养5~7 d,挑取形态差异明显的单菌落进行纯化接种,转接1~2次后得到纯培养物。将纯培养物接种到纤维素酶活鉴定培养基上,28 ℃培养3~5 d,最终获得1株有明显透明水解圈的真菌,命名为SCSIO43503。
1.2.2 菌种鉴定 形态学鉴定:形态学鉴定依据《真菌鉴定手册》及《中国真菌志》第十四卷[16-17]。分子生物学鉴定:利用Omega真菌基因组抽提试剂盒提取真菌总DNA,用于ITS、β-微管蛋白(β-tubulin)、钙调节蛋白(calmodulin)序列的扩增。分别采用如下通用引物ITS1/ITS4[18]、Bt2a/Bt2b[19]、cmd5/cmd6[20]。PCR反应条件:95 ℃ 2 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 7 min。PCR结果琼脂糖凝胶电泳验证。PCR原液送交华大基因测序,测序结果在NCBI数据库中进行比对分析,使用MEGA 5.0软件,以邻接法(Neighbor-Joining)建立系统发育树[21]。
1.2.3 纤维素酶活性的测定 菌株接种于PDA平板上培养3 d,用灭菌枪头打孔,10块打孔获得的菌块接种于200 mL发酵培养基中,28 ℃、180 r/min摇床培养。取5 mL发酵液,6 000 r/min离心5 min,上清液备用。于18 cm×18 mm的玻璃试管中加入1 cm×1 cm的定量滤纸和1.5 mL pH 5.0的柠檬酸缓冲液,50 ℃预热5 min,加入0.5 mL上清液,50 ℃反应30 min,再加入2 mL的DNS溶液,沸水浴5 min,冷却后在OD540下测定吸光值,根据标准曲线计算酶活力。酶活力定义:每分钟纤维素被催化水解生成1 μmol葡萄糖所需酶量为1个酶活力单位U。
2 结果与分析
2.1 真菌形态学特征
菌落平展,偶呈实点状,灰色,绒状(图1A)。分生孢子梗为枝孢型,产孢细胞合轴式延伸,分生孢子梗生长到一定长度,顶端膨大,在膨大顶端的侧面,孢子再生长,在新的顶端又产生孢子,孢子梗继续延伸,这样重复多次,孢子梗呈屈膝状膨大,孢子脱落后膨大处留下明显孢痕(图1B)。菌丝纤细,宽5.0~10 μm,具有分隔。产孢细胞直接生于菌丝上,无特化分生孢子梗,长8~35 μm,基部宽1.5~3.5 μm,顶部不足1.0 μm;分生孢子椭圆形,少见近柱状,面积1.5~3.5 μm×1.0~2.0 μm(图1C)。28 ℃黑暗条件下培养5 d菌落直径30 mm左右。将该菌株接种到纤维素酶活鉴定培养基上,28 ℃黑暗培养3~5 d后,可形成直径为20 mm左右的透明水解圈(图1D),表明该菌株分泌的纤维素酶具有较高活性。参考《中国真菌志》第十四卷和《真菌鉴定手册》,菌株SCSIO 43503初步鉴定为枝孢属(Gladaxporism)。

图1 菌株SCSIO 43503形态学特征Fig.1 Morphology of SCSIO 43503 strainA:PDA培养基上的生长状态;B:菌丝的扫描电镜图片;C:孢子的扫描电镜图片;D:菌株的纤维素水解活性测定A:Growth state on PDA medium; B:SEM of hyphae; C:SEM of spores; D:Cellulose hydrolysis activity of strain
2.2 真菌基因序列分析
利用分子生物学方法,进一步明确该菌株的分类学地位。扩增其ITS、β-微管蛋白、钙调节蛋白基因并进行测序分析。通过GenBank中的BLAST软件将目的基因序列与GenBank数据库中的序列进行比对。根据比对结果利用Mega 5.0构建系统进化树。结果显示,与其ITS序列相似性最高的菌株为Ochrocladosporiumsp.AK9/09(FJ75525)与OchrocladosporiumfrigidariiCZ549(LN714576),均有96%的相似性。与其β-微管蛋白序列相似性最高的菌株为Shiraiabambusicola(AB355003),相似性仅为86%。与其钙调节蛋白序列相似性最高的菌株为ParamyrotheciumviridisporumCBS 873.85(KU846278),序列相似性只有89%。综合其形态学特征,确定该菌株为枝孢属(Gladaxporism)真菌,命名为枝孢菌(Gladaxporismsp.)SCSIO43503,于2016年11月3日保藏于中国典型培养物保藏中心(CCTCC),保藏编号:CCTCC No:2016613。该菌株ITS序列已提交NCBI,登陆号为KY224732。

图2 菌株SCSIO 43503 ITS基因的系统进化树Fig.2 Phylogenetic tree of SCSIO 43503 based on the ITS gene
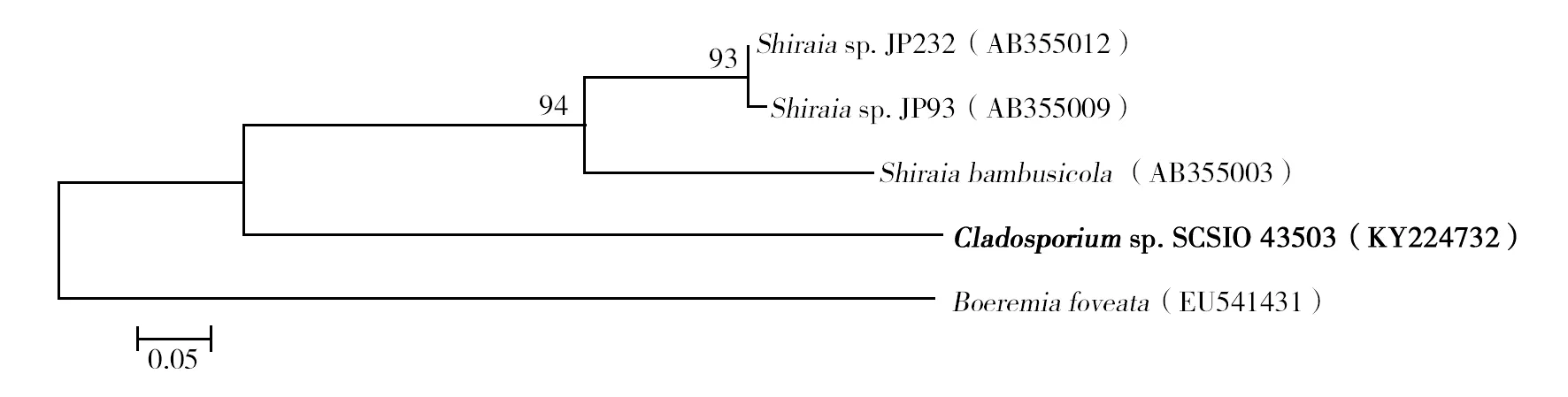
图3 菌株SCSIO 43503β-tubulin基因系统进化树Fig.3 Phylogenetic tree of SCSIO 43503 based on the β-tubulin gene

图4 菌株SCSIO 43503 钙调蛋白基因系统进化树Fig.4 Phylogenetic tree of SCSIO 43503 based on the calmodulin genes
2.3 菌株SCSIO 43503纤维素酶酶学性质分析
2.3.1 发酵时间对酶活力的影响 将菌株SCSIO 43503于28 ℃、180 r/min条件下摇床培养,分别在第1、2、3、4、5、6天时取发酵液在50 ℃、pH 5.0条件下测定酶活。由图5可以看出,从第2天开始该菌株酶活性明显提高,第3天达到最高值23.46 U,之后活性逐渐降低。
2.3.2 温度对酶活性的影响 将菌株SCSUO 43503于28 ℃、180 r/min摇床培养,发酵第3天时取样测试,调节pH值为5.0,在不同温度(35、40、45、50、55、60、65 ℃)下测定酶活力。以最大值为100%,用相对酶活力对温度作图(图6)。图6显示,菌株SCSIO 43503所分泌的纤维素酶在45~55 ℃区间内保持较高的相对酶活力。该菌株纤维素酶的最适反应温度为50 ℃。

图5 发酵时间对菌株SCSIO 43503纤维素酶活力的影响Fig.5 Effect of fermentation time on cellulase activity of SCSIO 43503 strain
2.3.3 pH对酶活力的影响 将菌株SCSIO 43503于菌株28 ℃、180 r/min条件下摇床培养,发酵第3天时取样测试,在pH值分别为3.0、4.0、5.0、6.0、7.0、8.0的缓冲溶液中,50 ℃测定不同pH值下的纤维素酶活力。以最高值为100%,用相对酶活力对温度作图(图7)。从图7中可以看出,菌株SCSIO 43503所分泌的纤维素酶在pH 3.0~7.0范围内活性较高,均超过70%,其中最适pH值为5.0。

图6 温度对菌株SCSIO 43503纤维素酶活力的影响Fig.6 Effect of temperature on cellulase activity of SCSIO 43503 strain

图7 pH对菌株SCSIO 43503纤维素酶活力的影响Fig.7 Effect of pH on cellulase activity of SCSIO 43503 strain
3 讨 论
红树林生态系统中蕴含着丰富的微生物资源,包括细菌、真菌、放线菌和蓝藻等。大部分微生物都能够分泌纤维素酶降解有机质。真菌纤维素酶通常是分泌到胞外的且纤维素酶系较全,活性一般比细菌等微生物要高,因此绝大部分商品化纤维素酶来自真菌,而商品化的纤维素酶中有20%来自木霉属和曲霉属真菌[22]。
本研究筛选分离得到1株纤维素降解真菌,命名为SCSIO 43503。形态学分析显示,该菌株具有枝孢属(Gladaxporism)的明显特征。该菌株ITS、β-微管蛋白、钙调节蛋白基因系统进化树表明,与其亲缘关系最近的菌株分别为Ochrocladosporiumsp.AK9/09与OchrocladosporiumfrigidariiCZ549、Shiraiabambusicola、ParamyrotheciumviridisporumCBS873.85,相似性分别为96%、86%和89%。综合形态学和分子生物学鉴定结果,推测该菌株为枝孢属真菌。该菌株所产纤维素酶的最适发酵时间为3 d,最适反应温度为50 ℃,最适pH为5.0,酶活力最高达到23.46 U。该枝孢属真菌分泌的纤维素酶具有较好的温度适应性以及pH稳定性,具有一定的商业利用价值。
参考文献:
[1] Behera BC, Parida S, Thatoi HN, et al. Isolation and Identification of Cellulose Degrading Bacteria from Mangrove Soil of Mahanadi River Delta and Their Cellulase Production Ability[J]. American Journal of Microbiological Research, 2014, 2(1):41-46.
[2] Behera BC, Sethi BK, Mishra RR, et al. Microbial cellulases-Diversity & biotechnology with reference to mangrove environment: A review[EB/OL]. http://dx.doi.org/10.1016/j.jgeb.2016.12.001, 2016-12-01.
[3] 龙寒,向伟,林鹏,等.红树林区微生物资源[J].生态学杂志,2005,24(6):696-702.
[4] Panagiotou G, Kekos D, Macris BJ, et al. Production of cellulolytic and xylanolytic enzymes byFusariumoxysporumgrown on corn stover in solid state fermentation[J]. Industrial Crops and Products, 2003, 18:37-45.
[5] Kang S, Park Y, Lee J, et al. Production of cellulases and hemicellulases byAspergillusnigerKK2 from lignocellulosic biomass[J]. Bioresource Technology, 2004, 91:153-156.
[6] Jφrgensen H, Mφrkeberg A, Krogh KB, et al. Production of cellulases and hemicellulases by threePenicilliumspecies: effect of substrate and evaluation of cellulose adsorption by capillary electrophoresis[J]. Enzyme and Microbial Technology, 2005, 36:42-48.
[7] Ahamed A, Vermette P. Culture-based strategies to enhance cellulase enzyme production fromTrichodermareeseiRUT-C30 in bioreactor culture conditions[J]. Biochemical Engineering Journal, 2008, 40:399-407.
[8] Gilna V, Khaleel K. Cellulase Enzyme Activity ofAspergillusfumigatusfrom Mangrove Soil on Lignocellulosic Substrate[J]. Recent Research in Science and Technology, 2011, 3:132-134.
[9] Sasi A, Ravikumar M, ManthiriKani S. Optimization, production and purification of cellulase enzyme from marineAspergillusflavus[J]. African Journal of Microbiology Research, 2012, 6(20):4214-4218.
[10] Arfi Y, Chevret D, Henrissat B, et al. Characterization of saltadapted secreted lignocellulolytic enzymes from the mangrove fungusPestalotiopsissp.[J]. Nature Communications, 2013, 4:1810.
[11] Ravindran A, Adav SS, Sze SK. Characterization of extracellular lignocellulolytic enzymes ofConiochaetasp. during corn stover bioconversion[J]. Process Biochem, 2012, 47:2440-2448.
[12] Gilna V, Khaleel K. Cellulase Enzyme Activity ofAspergillusfumigatusfrom Mangrove Soil on Lignocellulosic Substrate[J]. Recent Research in Science and Technology, 2011, 3:132-134.
[13] 麦国琴,许晓萍,余翠媚,等.产木聚糖酶和纤维素酶真菌的酶学性质分析[J].食品研究与开发,2011,32(9):179-182.
[14] 高阳,刘四新,王春燕.红树林土壤中高产纤维素酶菌株的筛选[J].热带农业工程,2009,33(4):9-12.
[15] 潘虎,卢向阳,董俊德,等.一株红海榄根际纤维素降解真菌的分离鉴定及其酶学性质[J].微生物学杂志,2012,32(1):1-5.
[16] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:129-132.
[17] 张忠义.中国真菌志第十四卷[M].北京:科学技术出版社,2003:14-18.
[18] White TJ, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[C].San Diego: Academic Press, 1990:315-322.
[19] Donaldson GC, Ball LA, Axelrood PE, et al. Primer sets developed to amplify conserved genes from filamentous ascomycetes are useful in differentiatingFusariumspecies associated with conifers[J]. Appl Environ Microbiol, 1995, 61(4):1331-1340.
[20] Hong SB, Cho HS, Shin H D, et al. NovelNeosartoryaspecies isolated from soil in Korea[J]. IJSEM, 2006, 56(2):477-486.
[21] Kumar S, Tamura K, Nei M. MEGA3: Integrated software or molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics, 2004,(5):150-163.
[22] Hussain AA, Altenaiji EM, Yousef LF. Fungal cellulases from mangrove forests-a short review[J]. J Biochem Tech, 2014, 5(3):765-774.
·写作常识·
