秸秆还田对土壤硝化特性和氨化特性及其相关菌群数量的影响
2018-07-04吴红艳王志学
冯 敏, 吴红艳, 王志学
(辽宁省微生物科学研究院,辽宁 朝阳 122000)
秸秆是农作物的主要副产品, 也是一种重要的生物资源, 含有作物生长所需的主要元素。秸秆还田不仅能改善土壤理化性状,显著增加土壤有机质和养分含量,同时还可以改善土壤结构和耕性,有利于植株对土壤营养的吸收利用;另一个更为重要的作用是秸秆含有大量的化学能, 是土壤微生物生命活动的能源,可以增强各种微生物的活性, 即加强呼吸、纤维分解、硝化及反硝化作用等[1]。土壤微生物是生态系统中的分解者,最显著的成效就是分解有机质、释放养分,供植物利用。我国是农业大国, 作物秸秆产量大, 秸秆还田技术具有很大的发展潜力。目前,国内关于秸秆还田的研究多集中在秸秆还田可增加土壤有机质、改善土壤理化性质、改良土壤耕性、作物产量与品质、土壤肥力、土壤水分状况等方面,有关秸秆还田后氮素平衡的研究报道较少[2-3],而氮元素是土壤微生物和植物生长的最重要的限制因子之一,氮素是否平衡是整个植物生长过程关键因素之一,土壤的硝化特性和氨化特性是整个氮素循环中基本环节,而土壤微生物中的硝化细菌、氨化细菌和固氮菌的数量变化对于土壤的硝化特性和氨化特性起着至关重要的作用。本研究通过对秸秆还田后植株生长过程中不同时间土壤硝化特性和氨化特性的研究,结合相应的硝化细菌、氨化细菌、固氮菌数量的检测,探讨秸秆还田对土壤硝化特性和氨化特性的影响,并探求这种影响与相关菌群数量变化的关系,为进一步研究秸秆还田对土壤整个氮素循环的影响提供参考。
1 材料与方法
1.1 材料
1.1.1 试验区 试验时间为2017年5月至10月,试验地点为辽宁省朝阳市北票市马友营乡农户大棚。设计两个处理:添加玉米秸秆(处理区)和不添加玉米秸秆(空白对照区)。
1.1.2 供试样品 实验样品为秸秆生物降解专用菌种,施用后定期采取土壤样品(施用后每15 d取样1次)。取样方法:用无菌小钢铲取秸秆上0~10 cm土壤作为样品,过20目筛后备用。
1.1.3 试剂及培养基 改良斯蒂芬逊培养基(氨化菌培养基);阿须贝培养基(固氮菌培养基);硝化菌培养基(硫酸铵2.0 g,磷酸氢二钾1.0 g,硫酸镁0.5 g,硫酸亚铁0.4 g,碳酸钙5.0 g,蒸馏水1 000 mL,pH 7.2);氧化镁、硼酸、醋酸钠、液体石蜡油、盐酸、对氨基苯磺酸、α-萘胺、亚硝酸钠、醋酸钠等均为分析纯,购自北京科海军舟有限公司。
1.1.4 仪器与设备 T6新悦-可见分光光度计(北京普析通用仪器有限责任公司);HZQ-Q全温振荡器(东联电子技术开发有限公司);恒温培养箱(ZQ 中器);半微量定氮装置。
1.2 方法
1.2.1 不同取样时间土壤样品氨化作用强度测定(土壤悬液法) 基本原理:将一定量土壤接种于含有机氮的液体培养基中,经培养过程中氨化菌的作用,有机氮转化为氨,用半微量蒸馏法测定培养液中增加的氨量,作为土壤氨化作用强度的指标。①溶液:120 g/L的MgO悬浊液,20 g/L的硼酸-混合指示剂,0.01 mol/L标准盐酸溶液,氨化菌培养液等。②样品测定:a.在10 mL氨化菌培养液中接入土壤样品悬液(取1 g土壤样品加入1 mL带有玻璃珠的无菌水中恒温振荡器振荡30 min)1 mL,28 ℃、120 r/min培养48 h,取出过滤。b.取滤液5 mL,从半微量定氮蒸馏装置的小漏斗处注入装置的蒸馏瓶中,再用注射器加入MgO悬浊液10 mL,液状石蜡油1 mL,用水洗漏斗,使蒸馏瓶内体积达40 mL左右。③将盛有5 mL硼酸-混合指示剂溶液的100 mL三角瓶置于冷凝器的承接管下端,通蒸汽蒸馏5 min后,取下硼酸吸收液的三角瓶,用0.01 mol/L标准盐酸溶液滴定至由绿色变成粉红色。计算公式如下:
NH+-N(mg/L)=(消耗标准盐酸体积×标准盐酸摩尔浓度×14)/取液量

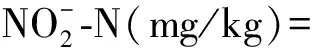

1.2.3 不同取样时间土壤样品相关菌群数量的测定(平板计数法) ①将土壤样品制成土壤悬液(同1.2.2 ③ a),稀释成不同浓度梯度的土壤稀释液。②依次于氨化菌培养基、硝化菌培养基和固氮菌培养基混合均匀,28 ℃恒温培养箱中培养72 h,计数。
2 结果与分析
2.1 秸秆还田后对不同取样时间土壤样品相关菌群数量的影响
2.1.1 秸秆还田后对土壤中氨化细菌数量的影响 从图1可见,整个生长过程中秸秆还田处理区的土壤样品中氨化菌数量各个取样时间均高于空白对照区,最高点在定殖后约60 d,处理区数量为5×108cfu/g,而空白对照区为3.6×108cfu/g。
2.1.2 秸秆还田后对土壤中硝化细菌数量的影响 从图2可见,整个生长过程中秸秆还田处理区的土壤样品中硝化菌数量各个取样时间都高于空白对照区,最高点在定殖后约60 d,处理区数量为2.1×109cfu/g,而空白对照区为1.3×109cfu/g。
2.1.3 秸秆还田后对土壤中固氮菌数量的影响 从图3可见,整个生长过程中秸秆还田处理区的土壤样品中固氮菌数量各个取样时间均高于空白对照区,最高点在定殖后约60 d,处理区数量为1.8×109cfu/g,而空白对照区为1.3×109cfu/g。

图1 秸秆还田后对不同取样时间土壤样品中氨化细菌数量的影响Fig.1 Effect of straw return on the number of ammonia bacteria in soil samples at different sampling times

图2 秸秆还田后对不同取样时间土壤样品中硝化细菌数量的影响Fig.2 Effects of straw return on the number of nitrifying bacteria in soil samples at different sampling times

图3 秸秆还田后对不同取样时间土壤样品中固氮菌数量的影响Fig.3 Effects of straw return on nitrogen fixing bacteria in soil samples at different sampling times
2.2 秸秆还田后对土壤氨化特性的影响
从图4可见,在植株生长的整个时期,秸秆还田处理区土壤样品的氨化作用强度均明显高于空白对照,在植株定殖后约60 d作用最强,处理区为40.6 mg/g(空白对照区为22.8 mg/g),整个过程变化趋势是相同的,先是较小,处理区仅为9.5 mg/g(空白对照区为8.8 mg/g),然后快速上升到最高,然后又缓慢下降,最后处理区降至7.0 mg/g(空白对照区为4.2 mg/g)。
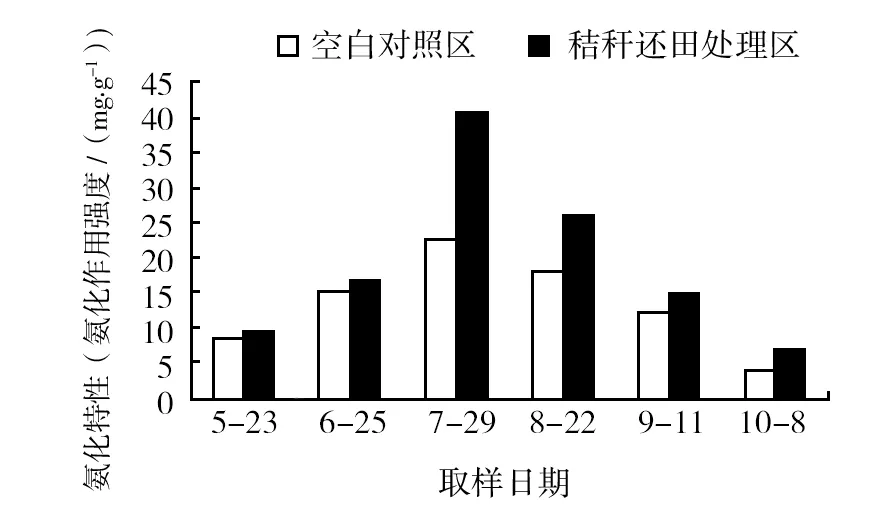
图4 秸秆还田后对不同取样时间土壤样品氨化特性的影响Fig.4 Effect of straw returning to field on ammonia characteristics of soil samples at different sampling times
2.3 秸秆还田后对土壤硝化特性的影响
2.3.1 亚硝酸根标准曲线制备结果 亚硝酸根标准曲线制备结果见图5。回归方程为y=0.210 4x+0.039(R2=0.994 9,R=0.997 5),线性关系较好,符合试验要求。

图5 亚硝酸根标准曲线制备结果Fig.5 Preparation of the Standard Curve of Nitrite Root
2.3.2 秸秆还田后对土壤硝化特性的影响 从图6可以看出,在植株生长的整个时期,秸秆还田处理区土壤样品的硝化作用强度(硝化率)均高于空白对照,在植株定殖后约60 d作用最强,处理区为98.8%,空白对照区为86%,整个过程变化趋势是相同的,先是很小,处理区仅为10.99%(空白对照区为4.86%),然后迅速上升到最高,然后又缓慢下降,最后处理区降至27.1%(空白对照区为23.6%)。
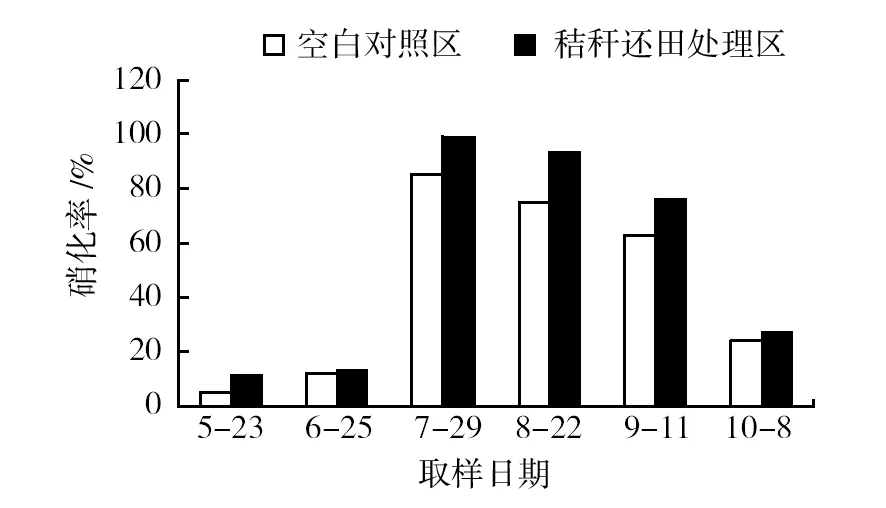
图6 秸秆还田后对不同取样时间土壤样品硝化特性的影响Fig.6 Effect of straw return on nitrification characteristics of soil samples at different sampling times
3 讨 论
农作物秸秆由大量的有机物和少量的无机物及水组成,其有机物的主要成分是纤维素类的碳水化合物,还有少量的粗蛋白质和粗脂肪,秸秆还田后增加了土壤中氮素的含量;而土壤微生物是氮素等养分元素循环的引擎,其群落结构控制了不同生态系统的氮素转化[11],土壤微生物不仅是土壤氮素的微生物矿化和固持的执行者,而且是提供植物营养元素的活性库[12]。另外,秸秆本身也附着大量的微生物,随着秸秆还田,这些微生物与土壤微生物共同成为土壤生态系统的重要组成部分, 在土壤有机物质分解和养分释放、能量转移等生物地化循环中起着重要作用,而其中的氨化细菌、硝化细菌和固氮菌在整个循环特别是氮素循环中起着至关重要的作用[13-14]。氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一。构成陆地生态系统氮循环的主要环节是生物体内有机氮的合成、氨化作用、硝化作用、反硝化作用和固氮作用[15]。本研究通过对秸秆还田后土壤硝化特性和氨化特性的改变,以及其与相关菌群数量变化关系的研究,结果表明,秸秆还田能有效增加土壤中氨化细菌、硝化细菌和固氮菌的数量并使其活性增强,进而提高土壤氨化活性和硝化活性,而相关菌群数量的变化与土壤氨化活性和硝化活性呈正相关,这一结果为进一步研究秸秆还田对土壤整个氮素循环的影响提供参考。
参考文献:
[1] 李万良, 刘武仁.玉米秸秆还田技术研究现状及发展趋势[J].吉林农业科学,2007,32(3):32-34.
[2] 赵伟,陈雅君,王宏燕,等.不同秸秆还田方式对黑土土壤氮素和物理性状的影响[J].玉米科学,2012,20(6):98-102.
[3] 杨宪龙,路永莉,同延安,等.长期施氮和秸秆还田对小麦——玉米轮作体系土壤氮素平衡的影响[J].植物营养与肥料学报,2013,19(1): 65-73.
[4] 谢云,王延华,杨浩.土壤氮素迁移转化研究进展[J].安徽农业科学,2013,41( 8):3442-3444,3462.
[5] 郎漫,李平,张小川.土地利用方式和培养温度对土壤氮转化及温室气体排放的影响[J].应用生态学报,2012,23(10):2670-2676.
[6] 熊淑萍,车芳芳,马新明,等.氮肥形态对冬小麦根际土壤氮素生理群活性及无机氮含量的影响[J].生态学报,2012,32(16):5138-5145.
[7] 李艳,张睿昊,刘海军,等.优化喷灌水量下不同施氮量对土壤氮素累积和作物产量的影响[J].北京师范大学学报(自然科学版),2013,49(2/3):214-220.
[8] 张淑红,高巍,张恩平,等.长期定位施氮对连作番茄土壤可培养微生物数量的影响[J].土壤通报,2012,43(1):60-65.
[9] 王静,张天佑.免耕对土壤微生物生理类群的群落结构与生态特征的影响[J].安徽农业科学,2010,38(8):4153-4155.
[10] 葛晓敏,陈晓东,唐罗忠,等.添加凋落物对杨树人工林土壤氮、磷矿化的影响初探[J].水土保持学报,2013,27(3):189-193.
[11] 汪峰,ZHOU Ji-Zhong,孙波.我国东部土壤氮转化微生物的功能分子生态网络结构及其对作物的响应[J].科学通报,2014,59(4-5):387-396.
[12] 仇少君,彭佩钦,刘强,等.土壤微生物生物量氮及其在氮素循环中作用[J].生态学杂志,2006,25(4):443-448.
[13] 张晶,林先贵,尹睿,等.参与土壤氮素循环的微生物功能基因多样性研究进展[J].中国生态农业学报,2009,17(5):1029-1034.
[14] Yergeau E,Kang S,HeZ L,et al.Functional microarray analysis ofnitrogen and carboncycling genesacrossan Antarctic latitudinal transect[J].The ISME Journal,2007,1:163-179.
[15] ChuH Y,FujiiT,MorimotoS,et al.Population size and specific nitrification potential of soil ammonia oxidizing bacteria under long term fertilizer management[J].Soil Biology& Biochemistry,2008,40(7):1960-1963.
