基质相互作用蛋白分子1在肿瘤发生发展和临床应用中的研究进展
2018-07-04胡金萌王健
胡金萌,王健
肿瘤的发生、发展不是一个单一的过程,而是多因素、多步骤共同作用的结果。已有研究结果表明基质相互作用蛋白分子1(STIM1)参与肿瘤的发生及转移过程[1]。STIM1是位于内质网(ER)上的钙离子(Ca2+)传感器,是调控钙池操纵性钙内流(storeoperated calcium entry,SOCE)的重要组成部分[2-3]。而Ca2+信号是细胞代谢中重要的第二信使[4],参与肿瘤细胞的增殖、凋亡和迁移[4-7]。抑制肿瘤细胞中STIM1的活化,可以抑制STIM1依赖性Ca2+信号的传导,进而抑制多种肿瘤的发生发展,如乳腺癌[8]、宫颈癌[9]、结直肠癌[10-11]、前列腺癌[12]、肝癌[13]、头颈部鳞癌[14]、肺癌[15]和子宫内膜癌[16]。本文就STIM1结构、其与Ca2+的相互作用机制及促进肿瘤侵袭转移机制作一综述。
1 STIM1蛋白结构
STIM1是一种分子质量为90 ku的Ⅰ型跨膜蛋白,其基因定位于人染色体11p15.5[17]。STIM1包含3个区域,内质网区域、跨膜区域(TM)和胞浆区域。内质网区域包含信号肽、N-末端、EF-手形结构(EF-hand)和SAM(Sterile α Motif)结构域,其中EF-hand和SAM区(EF-SAM)是Ca2+结合域。跨膜区域则主要将内质网内钙库清空的信号以构象变化方式传导到STIM1蛋白的胞质部分。胞浆区域含有多个螺旋卷曲结构域(Coiled-coil 1~3,CC1~3),参与STIM1构象变化,并介导依赖性失活的ID区、富含丝氨酸和脯氨酸的S/P结构域以及C-末端赖氨酸富集的K区,见图1[6,18-19]。EF-SAM主要由10个α螺旋和2个β折叠组成(图2a);EF-SAM与Ca2+结合后形成一个紧凑的实体(图2b);EF-hand与疏水性SAM残基(F108、L199、L195)相互作用,该位点突变可致Ca2+与EF-hand脱离(图2c);Ca2+耗尽的EF-SAM呈分散的低聚物(图2d)[18]。

Fig.1 Schematic representation of structures of STIM1[18]图1 STIM1结构示意图[18]
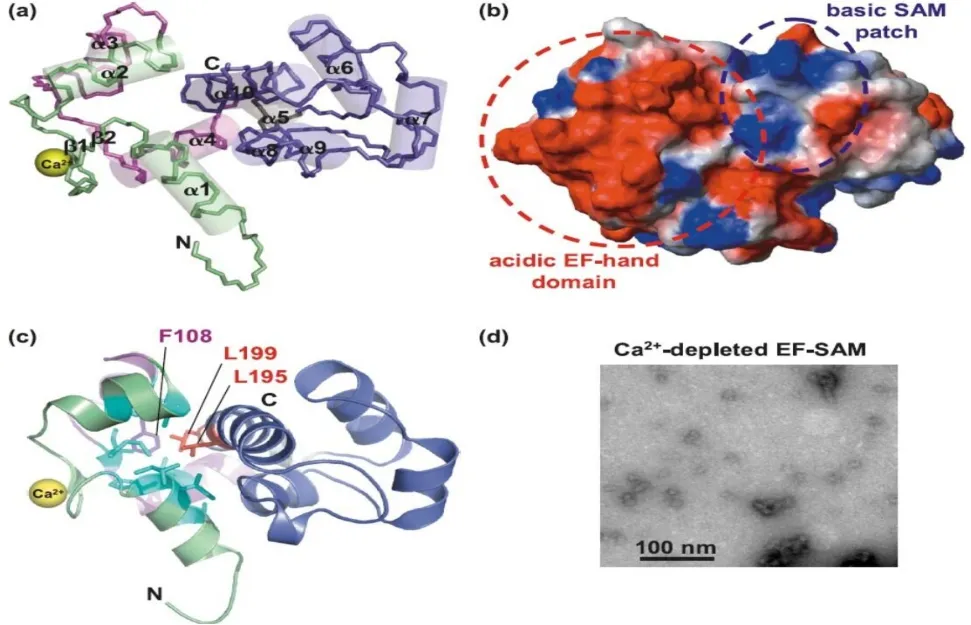
Fig.2 Structural characteristics of EF-SAM[18]图2 EF-SAM结构示意图[18]
2 STIM1对Ca2+的调控机制
Ca2+是细胞增殖、分化、基因转录等生命活动的重要信使分子,ER钙池排空会激活细胞膜表面的钙池操纵性钙通道(SOCs)开放,所形成的SOCE是非兴奋细胞调节Ca2+稳态平衡的重要途径[20]。SOCE即细胞内Ca2+损耗后引发的细胞外Ca2+内流的过程。SOCE由SOCs介导完成,存在于各种类型的细胞中,在肿瘤的生长、抗凋亡、迁移及免疫逃逸中起到重要作用[21-23]。当ER腔内Ca2+存储充盈时,STIM1分子以单聚体形式均匀分布于ER;随着ER腔内Ca2+的耗尽,EF-SAM结构域构象发生变化,疏水性增加,EF-SAM由单聚体转变为不稳定的低聚物,导致STIM1分解,SOCE停止[17]。其大致过程为:细胞外信号分子激活细胞膜表面受体,活化磷脂酶C(PLC),使2,4,5-二磷酸磷脂酰肌醇(PIP2)裂解为1,4,5-三磷酸肌醇(IP3)和二酰基甘油(DAG)。IP3与ER上的IP3-受体结合,激活ER钙池释放Ca2+,ER中Ca2+浓度降低致使Ca2+从EF-hand脱离,Ca2+排空信号激活STIM1,有活性的STIM1二聚体激活钙释放激活钙通道(CRAC),细胞外的Ca2+进入细胞内。当ER再充满Ca2+,Ca2+重新结合EF-hand,STIM1失活,Ca2+内流停止[9]。STIM1作为SOCE重要的组成分子,是细胞主动吸收Ca2+的重要分子[24]。
3 STIM1与肿瘤
3.1 STIM1与肝癌 缺氧和细胞内Ca2+瞬变是癌症的基本特征。STIM1与缺氧诱导因子(HIF)-1α相互作用促进肝癌细胞的形成[13]。Yang等[13]研究发现,肝癌细胞中HIF-1α和STIM1的表达水平明显高于正常肝细胞:将人类肝癌HepG2和Huh7细胞暴露于不同浓度氧气中24 h后观察发现,缺氧暴露会导致HIF-1α和STIM1表达上调,肿瘤细胞增殖增加,且HIF-1α和STIM1的表达呈正相关。HIF-1α通过与STIM1启动子直接结合,促进肝癌细胞中STIM1的转录和表达,并促进SOCE发生[25],而SOCE是人类肝癌细胞系增殖过程中Ca2+内流的主要类型[26]。可见STIM1在肝癌细胞形成中起到重要作用。
3.2 STIM1与前列腺癌 STIM1在前列腺癌进展中起双重作用。一方面,STIM1过表达可促进上皮-间质转化(EMT),从而增强肿瘤细胞侵袭转移;另一方面,STIM1过表达会加速肿瘤细胞衰老[27]。EMT是肿瘤细胞侵袭转移的重要机制,在EMT过程中,肿瘤细胞失去上皮特征并获得间质表型特征,上皮标记蛋白如E-钙黏蛋白表达下降,间质标记蛋白如波形蛋白和N-钙黏蛋白的表达增加,促进EMT现象发生[28-31]。Xu 等[27]研究了 BPH-1、LNCaP、DU145 和PC3这4种细胞系,BPH-1是一种增生细胞,后3种均为前列腺癌细胞。该研究发现,STIM1在前列腺癌细胞中的表达明显高于BPH-1;且在过表达STIM1的DU145细胞中,E-钙黏蛋白表达降低,N-钙黏蛋白等表达显著增加,提示EMT发生,细胞发生侵袭转移;该研究还发现在过表达STIM1的前列腺癌DU145-STIM1-YFP、PC3-STIM1-YFP细胞中,大而长的低密度纺锤体(细胞衰老的重要标志)增加,癌细胞凋亡增加;而当敲低STIM1基因表达时,DU145和PC3细胞系中的衰老细胞显著减少。
3.3 STIM1与结直肠癌 微小RNA(miRNAs)是一类非编码的小RNA,与癌细胞的转移密切相关[32-33]。研究表明,STIM1是miR-185的直接靶点,miR-185可上调结直肠癌细胞中STIM1的表达;STIM1过表达会促进结直肠癌细胞的转移增加,而沉默STIM1基因表达后,直肠癌细胞的转移减少[1]。Zhang等[1]研究了SW480、SW620等4种结直肠癌细胞系中miR-185与STIM1表达的关系,发现SW620中miR-185表达上调可增加E-钙黏蛋白和β-连环蛋白的表达,降低波形蛋白和纤连蛋白的表达,且癌细胞的侵袭转移减少;证实miR-185是调控STIM1的上游分子,且两者之间呈负调控关系。
3.4 STIM1与宫颈癌 Chen等[9]研究发现,在宫颈癌SiHa细胞系,STIM1敲低可显著抑制细胞增殖;同时流式细胞术(FACS)检测发现STIM1敲低可显著增加细胞周期中G1/S和G2/M期的细胞比例。研究发现,STIM1可调节血管内皮生长因子(VEGF)在宫颈癌细胞中的表达,在SCID小鼠皮下成瘤模型中,通过酶联免疫吸附测定(ELISA)定量分析VEGF-A的表达水平,结果显示STIM1与VEGF-A表达水平成正比;上调STIM1表达可促进宫颈肿瘤细胞生长、局部传播和血管生成,并促进宫颈癌细胞迁移[9]。
3.5 STIM1与头颈部癌 STIM1在口腔癌细胞系TSCCA和喉癌细胞系Hep2中呈高表达,在该两种细胞系中沉默STIM1,会导致细胞周期阻滞于G0/G1期,显著抑制口腔癌细胞的增殖及转移[14]。STIM1亦可促进人类舌鳞状细胞癌细胞的生成,Cui等[34]研究发现在舌鳞癌细胞系Tca-8113中,STIM1敲低可明显减少Tca-8113细胞总数,且细胞生长速率下降约60%,细胞凋亡数量也显著增加。
3.6 STIM1与其他肿瘤 STIM1促进乳腺癌的发生发展,且与乳腺癌患者总体生存率(OS)呈负相关;STIM1过表达致SOCs通路Ca2+内流增加,诱导EMT发生,促进乳腺癌细胞的侵袭和转移[35]。Casas-Rua等[16]研究也证实STIM1过表达会诱导子宫内膜腺癌细胞EMT发生和细胞迁移增加。在胃癌细胞中,STIM1敲低可促进细胞黏附,抑制侵袭迁移,但对胃癌细胞的增殖和凋亡无明显影响[36]。
4 STIM1在临床中的应用
STIM1在胰腺癌细胞系中发挥促生存抗凋亡作用,吉西他滨可抑制STIM1表达,进而促使胰腺癌细胞凋亡增加[37]。此外,五氟尿嘧啶(5-FU)作为治疗胰腺癌的化疗药物之一,也是通过抑制STIM1表达来促进胰腺癌Panc1细胞凋亡[37]。顺铂通过诱导STIM1凋亡,对晚期非小细胞肺癌的治疗效果显著;顺铂会形成交联的DNA复合物,其细胞毒性通过DNA损伤识别信号的逐级下传来诱导STIM1凋亡的发生[38]。STIM1凋亡增加,使染色体在有丝分裂和微管细胞骨架极化期间分离的准确性降低,进而导致肺癌细胞死亡增加[38]。白藜芦醇可诱导细胞周期阻滞,导致癌细胞死亡;在雄激素依赖性前列腺癌中,白藜芦醇可抑制STIM1的表达,阻断SOCE激活,致使细胞中Ca2+内流减少,进而抑制前列腺癌细胞增殖和存活[9]。2-氨基乙氧基二苯基硼酸盐(2-APB)可导致STIM1与Ca2+的结合功能丧失,抑制Ca2+进入Orai1通道,阻断SOCE激活,进而抑制前列腺癌细胞增殖[39]。STIM1敲低还可以直接抑制人表皮样癌A431细胞DNA的合成,控制癌细胞增殖[40];亦可通过下调SOCE及特异性细胞周期蛋白G1、D1的表达,抑制肝癌细胞的生长[41]。因此,STIM1将为肿瘤的治疗提供了新的靶点及临床药物研究方向。
STIM1的临床诊断和预后意义已在多种癌症中得到证实[42],是肿瘤领域研究的热点。进一步深入研究STIM1在肿瘤细胞中的作用机制,将为其在肿瘤治疗中的应用提供更为广阔的前景。
[1]Zhang Z,Liu X,Feng B,et al.STIM1,a direct target of microRNA-185,promotes tumor metastasis and is associated with poor prognosis in colorectal cancer[J].Oncogene,2016,35(46):6043.doi:10.1038/onc.2016.140.
[2]Roos J,Digregorio PJ,Yeromin AV,et al.STIM1,an essential and conserved component of store-operated Ca2+channel function[J].J Cell Biol,2005,169(3):435-445.doi:10.1083/jcb.200502019.
[3]Liou J,Man LK,Heo WD,et al.STIM is a Ca2+sensor essential for Ca2+-store-depletion-triggered Ca2+influx[J].Curr Biol,2005,15(13):1235-1241.doi:10.1016/j.cub.2005.05.055.
[4]Berridge MJ,Bootman MD,Roderick HL.Calcium signalling:dynamics,homeostasis and remodelling[J].Nat Rev Mol Cell Biol,2003,4(7):517-529.doi:10.1038/nrm1155.
[5]Prevarskaya N,Skryma R,Shuba Y.Calcium in tumour metastasis:new roles for known actors[J].Nat Rev Cancer,2011,11(8):609-618.doi:10.1038/nrc3105.
[6]Rizzuto R,Pinton P,Ferrari D,et al.Calcium and apoptosis:facts and hypotheses[J].Oncogene,2003,22(53):8619-8627.doi:10.1038/sj.onc.1207105.
[7]Prevarskaya N,Skryma R,Shuba Y.Ion channels and the hallmarks of cancer[J].Trends Mol Med,2010,16(3):107-121.doi:10.1016/j.molmed.2010.01.005.
[8]Andruska N,Zheng X,Yang X,et al.Anticipatory estrogen activation of the unfolded protein response is linked to cell proliferation and poor survival in estrogen receptor α-positive breast cancer[J].Oncogene,2015,34(29):3760-3769.doi:10.1038/onc.2014.292.
[9]Chen YF,Chiu WT,Chen YT,et al.Calcium store sensor stromalinteraction molecule 1-dependent signaling plays an important role in cervical cancer growth, migration, and angiogenesis[J].Proc Natl Acad Sci U S A,2011,108(37):15225-15230.doi:10.1073/pnas.1103315108.
[10]Zhang Z,Liu X,Feng B,et al.STIM1,a direct target of microRNA-185,promotes tumor metastasis and is associated with poor prognosis in colorectal cancer[J].Oncogene,2015,34(37):4808-4820.doi:10.1038/onc.2014.404.
[11]Wang JY,Sun J,Huang MY,et al.STIM1 overexpression promotes colorectal cancer progression,cell motility and COX-2 expression[J].Oncogene,2015,34(33):4358-4367.doi:10.1038/onc.2014.366.
[12]Xu Y,Zhang S,Niu H,et al.STIM1 accelerates cell senescence in a remodeled microenvironment but enhances the epithelial-tomesenchymal transition in prostate cancer[J].Sci Rep,2015,5:11754.doi:10.1038/srep11754.
[13]Yang N,Tang Y,Wang F,et al.Blockade of store-operated Ca(2+)entry inhibits hepatocarcinoma cell migration and invasion by regulating focal adhesion turnover[J].Cancer Lett,2013 ,330(2):163-169.doi:10.1016/j.canlet.2012.11.040.
[14]Li P,Bian XY,Chen Q,et al.Blocking of stromal interaction molecule 1 expression influence cell proliferation and promote cell apoptosis in vitro and inhibit tumor growth in vivo in head and neck squamous cell carcinoma[J].PLoS One,2017,12(5):e0177484.doi:10.1371/journal.pone.0177484.
[15]Wang Y,Wang H,Li L,et al.Elevated expression of STIM1 is involved in lung tumorigenesis[J].Oncotarget,2016,7(52):86584-86593.doi:10.18632/oncotarget.13359.
[16]Casas-Rua V,Tomas-Martin P,Lopez-Guerrero AM,et al.STIM1 phosphorylation triggered by epidermal growth factor mediates cell migration[J].Biochim Biophys Acta,2015,1853(1):233-243.doi:10.1016/j.bbamcr.2014.10.027.
[17]Stathopulos PB,Li GY,Plevin MJ,et al.Stored Ca2+depletioninduced oligomerization of stromal interaction molecule 1(STIM1)via the EF-SAM region:An initiation mechanism for capacitive Ca2+entry[J].J Biol Chem,2006,281(47):35855-35862.
[18]Stathopulos PB,Ikura M.Partial unfolding and oligomerization of stromal interaction molecules as an initiation mechanism of store operated calcium entry[J].Biochem Cell Biol,2010,88(2):175-183.doi:10.1139/o09-125.
[19]Stathopulos PB,Zheng L,Li GY,et al.Structural and mechanistic insights into STIM1-mediated initiation of store-operated calcium entry[J].Cell,2008,135(1):110-122.
[20]Lewis RS.The molecular choreography of a store-operated calcium channel[J].Nature,2007,446(7133):284-287.doi:10.1038/nature05637.
[21]Linse S,Forsén S.Determinants that govern high-affinity calcium binding[J].Adv Second Messenger Phosphoprotein Res,1995,30:89-151.
[22]Lewit-Bentley A,Réty S.EF-hand calcium-binding proteins[J].Curr Opin Struct Biol,2000,10(6):637-643.
[23]Stapleton D,Balan I,Pawson T,et al.The crystal structure of an Eph receptor SAM domain reveals a mechanism for modular dimerization[J].Nat Struct Biol,1999,6(1):44-49.doi:10.1038/4917.
[24]Mancini M,Toker A.NFAT proteins:emerging roles in cancer progression[J].Nat Rev Cancer,2009,9(11):810-820.doi:10.1038/nrc2735.
[25]Li Y,Guo B,Xie Q,et al.STIM1 mediates hypoxia-driven hepatocarcinogenesis via interaction with HIF-1[J].Cell Reports,2015,12(3):388-395.doi:10.1016/j.celrep.2015.06.033.
[26]Chen JP,Luan Y,You CX,et al.TRPM7 regulates the migration of human nasopharyngeal carcinoma cell by mediating Ca2+,influx[J].CellCalcium,2010,47(5):425-432.doi:10.1016/j.ceca.2010.03.003.
[27]Xu Y,Zhang S,Niu H,et al.STIM1 accelerates cell senescence in a remodeled microenvironment but enhances the epithelial-tomesenchymal transition in prostate cancer[J].Sci Rep,2015,5(23):11754.doi:10.1038/srep11754.
[28]Thiery JP,Acloque H,Huang RY,et al.Epithelial-mesenchymal transitions in development and disease[J].Cell,2009,139(5):871-890.doi:10.1016/j.cell.2009.11.007.
[29]Thiery JP,Sleeman JP.Complex networks orchestrate epithelial mesenchymal transitions[J].Nat Rev Mol Cell Biol,2006,7(2):131-142.doi:10.1038/nrm1835.
[30]Savagner P,Boyer B,Valles AM,et al.Modulations of the epithelial phenotype during embryogenesis and cancer progression[J].Cancer Treat Res,1994,71:229-249.
[31]Tam WL, Weinberg RA.The epigenetics of epithelialmesenchymal plasticity in cancer[J].Nat Med,2013,19(11):1438-1449.doi:10.1038/nm.3336.
[32]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[33]Zhang H,Li Y,Lai M.The microRNA network and tumor metastasis[J].Oncogene,2010,29(7):937-948.doi:10.1038/onc.2009.406.
[34]Cui X,Song L,Bai Y,et al.Stromal interaction molecule 1 regulates growth,cell cycle,and apoptosis of human tongue squamous carcinoma cells[J].Biosci Rep,2017,37(2).pii:BSR20160519.doi:10.1042/BSR20160519.
[35]Zhang S,Miao Y,Zheng X,et al.STIM1 and STIM2 differently regulate endogenous Ca2+entry and promote TGF-β-induced EMT in breast cancer cells[J].Biochem Biophys Res Commun,2017,488(1):74-80.doi:10.1016/j.bbrc.2017.05.009.
[36]Xu JM,Zhou Y,Gao L,et al.Stromal interaction molecule 1 plays an important role in gastric cancer progression[J].Oncol Rep,2016,35(6):3496-3504.doi:10.3892/or.2016.4704.
[37]Kondratska K,Kondratskyi A,Yassine M,et al.Orai1 and STIM1 mediate SOCE and contribute to apoptotic resistance of pancreatic adenocarcinoma[J].Biochim Biophys Acta,2014,1843(10):2263-2269.doi:10.1016/j.bbamcr.2014.02.012.
[38]Kelland L.The resurgence of platinum-based cancer chemotherapy[J].Nat Rev Cancer,2007,7(8):573-584.doi:10.1038/nrc2167.
[39]Wei M,Zhou Y,Sun A,et al.Molecular mechanisms underlying inhibition of STIM1-Orai1-mediated Ca2+entry induced by 2-aminoethoxydiphenyl borate[J].Pflugers Arch,2016,468(11/12):2061-2074.doi:10.1007/s00424-016-1880-z.
[40]Yoshida J,Iwabuchi K,Matsui T,et al.Knockdown of stromal interaction molecule 1(STIM1)suppresses store-operated calcium entry,cell proliferation and tumorigenicity in human epidermoid carcinoma A431 cells[J].Biochem Pharmacol,2012,84(12):1592-1603.doi:10.1016/j.bcp.2012.09.021.
[41]El Boustany C,Bidaux G,Enfissi A,et al.Capacitative calcium entry and transient receptor potential canonical 6 expression control human hepatoma cell proliferation[J].Hepatology,2008,47(6):2068-2077.doi:10.1002/hep.22263.
[42]Chen YF,Hsu KF,Shen MR.The store-operated Ca(2+)entrymediated signaling is important for cancer spread.[J].Biochim Biophys Acta,2016,1863(6 Pt B):1427-1435.
