胸腺五肽超分子水凝胶的制备及其免疫调节作用研究
2018-07-04任春华高阳禇丽萍刘鉴峰
任春华,高阳,禇丽萍,刘鉴峰
胸腺五肽是一种人工合成的短肽,来源于含49个氨基酸的促胸腺生成素的第32~36片段,其氨基酸组成为Arg-Lys-Asp-Val-Tyr(RKDVY)。研究证实,RKDVY具有与促胸腺生成素相同的生物活性,能够通过促进胸腺细胞的分化以及调节成熟T细胞的功能来影响免疫系统[1]。作为一种免疫调节剂,目前RKDVY已经被临床应用于多种自身免疫性疾病的治疗,包括慢性淋巴白血病、过敏性皮炎、类风湿性关节炎以及获得性免疫缺陷综合征等[2-4]。但是,由于RKDVY本身较小的分子质量以及极高的水溶性,导致其存在细胞膜渗透性差、半衰期短以及生物利用度低等缺陷[5-6],从而使其临床应用受到较大的限制和挑战。因此,对RKDVY进行合理的结构修饰以提高其稳定性和生物活性具有重要的临床价值和意义。本研究通过将RKDVY共价修饰到自组装短肽上,以加热-冷却的方法制备RKDVY超分子活性水凝胶,探讨其增强细胞摄取及免疫调节作用的效果,以期为RKDVY纳米递送系统的设计及改善其临床疗效提供新的思路与方法。
1 材料与方法
1.1 材料 (1)主要试剂:三苯基甲基氯树脂购自天津南开和成科技有限公司;N-9芴甲基羰基(Fmoc)氨基酸及RKDVY购自上海吉尔生化有限公司;肿瘤坏死因子(tumor necrosis factor-α,TNF-α)试剂盒购自于美国Biolegend公司;小鼠巨噬细胞(RAW 264.7细胞)为本实验室保存。(2)主要仪器:高效液相色谱仪(HPLC,LC 2000,中国);液质联用色谱仪(LC-MS,SHIMADZU 2020系统,日本);透射电子显微镜(TEM,Tecani G2 F20系统,FEI,美国);流变仪(AR 1500ex,TA,美国);全波长酶标仪(VARIOSKAN FLASH,Thermo scientific,美国);活细胞工作站(DMI6000B,Leica,德国)。
1.2 方法
1.2.1 自组装多肽(NapGDFDFDYGRKDVY)合成、纯化及表征分析 NapGDFDFDYGRKDVY的合成采用经典成熟的Fmoc固相合成法,即每一个氨基酸的氨基都被Fmoc保护着。反应过程中用碱性溶液(哌啶)脱除moc保护基,使之裸露出氨基并与已经活化的下一个氨基酸的羧基交联缩合,形成肽键。反应过程中用苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(O-Benzotriazole-N,N,N',N'-tetraMethyl-uroniumhexafluorophosphate,HBTU)做为氨基酸羧基的活化剂,用N,N-二异丙基乙胺(N,N-DiisopropylethylaMine,DIEA)做催化剂。不断重复缩合-洗涤-脱保护-洗涤的过程,使肽链从C端向N端依次延长,待肽链全部完成时使用三氟乙酸将肽链从树脂上切割下来。经真空减压旋转蒸发后除去多余液体,使用无水乙醚沉淀出固体多肽粗品。多肽粗品用二甲基亚砜(DiMethyl sulfoxide,DMSO)溶解后使用高效液相色谱(HPLC)进行分离纯化,经冷冻干燥后得到目的多肽纯品。通过液质联用色谱仪(LC-MS)对多肽纯品的分子质量和纯度进行表征分析。
1.2.2 FITC标记肽的合成、纯化及表征分析 异硫氰根FITC(FITC-NCS)上的异硫氰根基团(-NCS)能够与RKDVY的赖氨酸残基(K)侧链上的氨基在碱性条件下发生共价反应,生成FITC标记肽。具体步骤:称取适量RKDVY及NapGDFDFDYGRKDVY纯品并分别溶于少量DMSO中,分别加入等摩尔量的FITC-NCS,用少量三乙胺调节反应溶液的pH值至8.0~9.0,室温下反应过夜。使用HPLC对反应液进行分离纯化,经冷冻干燥后得到FITC标记多肽纯品,用LC-MS对多肽纯品的分子质量和纯度进行表征分析。
1.2.3 胸腺五肽超分子水凝胶的制备及表征分析 称取2 mg NapGDFDFDYGRKDVY溶于磷酸盐缓冲液(phosphate buffer saline,PBS)中,并加入 2~3 mol的碳酸钠调节pH 为7.4,最终配置成浓度为2 g/L的溶液。用移液器吸取500 μL溶液于玻璃小瓶中,在酒精灯上加热使其充分溶解后静置于桌面上,待其冷却后通过瓶倒置的方法判断其是否发生了溶液到凝胶的转变。使用流变仪对其力学性能进行分析测试,使用透射电镜对其微观形貌进行表征分析。
1.2.4 细胞摄取实验 将小鼠RAW 264.7细胞以2×105/孔的密度接种于24孔板中,每孔加入1 mL含10%胎牛血清、100 U/mL青霉素和100 mg/L链霉素的DMEM培养基,置于37℃、5%CO2的细胞培养箱中培养。待细胞全部贴壁且生长状态良好时,分别加入含有0.02 mmol FITC标记的游离胸腺五肽(RKDVY-FITC)及胸腺五肽纳米纤维(NapGDFDFDYGRKDVY-FITC),分别孵育4 h后将孔内液体吸出,用PBS洗3次,用新鲜配置的4%多聚甲醛固定细胞10 min。吸去固定液并用PBS洗3次后,再用5 mg/L的DAPI溶液染细胞5 min,吸去液体后PBS洗2次。置于荧光显微镜下通过观察FITC荧光强度来分析RKDVY-FITC及NapGDFDFDYGRKDVY-FITC的细胞摄取情况。
1.2.5 体外免疫调节实验 将小鼠RAW 264.7细胞以5×105/孔的密度接种于24孔板中,待细胞生长状态良好时去除培养基。分别加入含有30 μmol/L的游离RKDVY及NapGDFDFDYGRKDVY的无血清DMEM培养基,每组药物设立5个平行孔并设立不含药物的空白对照组。孵育24 h后,收集细胞培养液并在5 000×g转速下离心5 min以分离出可能含有的细胞碎片。将离心得到的上清液取出后置于冰箱4℃保存。按照TNF-α试剂盒提供的使用说明,通过酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)及已建立的标准曲线测定不同溶液中TNF-α的含量。
1.3 统计学方法 采用SPSS 19.0软件行统计学分析。符合正态分布的计量数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 NapGDFDFDYGRKDVY合成、纯化及表征 自组装多肽NapGDFDFDYGRKDVY的化学结构如图1A所示。固相合成1 mmol该多肽可以得到1 200 mg多肽粗品,粗品合成产率达到理想产率的85%以上;合成的100 mg NapGDFDFDYGRKDVY多肽粗品经高效液相色谱分离纯化后可以得到83 mg多肽纯品,纯化产率达到80%以上。纯化后的NapGDFDFDYGRKDVY样品用LC-MS对其纯度和分子质量进行分析鉴定,见图1B:质谱结果显示为1 421.65,与测算得到的多肽分子质量1 420.58基本相符。色谱图显示纯化后的多肽产品只有一个峰,纯度达到95%以上,符合后续实验的纯度要求。

Fig.1 The chemical structure of NapGDFDFDYGRKDVY(A)and its LCMS spectra(B)图1 NapGDFDFDYGRKDVY的化学结构(A)及LC-MS谱图(B)
2.2 FITC标记肽的合成及表征 经HPLC纯化后,分别得到了RKDVY-FITC与NapGDFDFDYGRKDVYFITC。纯化后的样品用LC-MS对其纯度和分子质量进行分析鉴定,见图2A,RKDVY-FITC经质谱鉴定后分子质量为1 069,与测算得到的分子质量1 069相符,从色谱峰形可以看出其纯度达到95%以上;同样,NapGDFDFDYGRKDVY-FITC经质谱鉴定后分子质量为1 809(图2B),与测算得到的分子质量1 809相符,纯度达到95%以上,两种标记多肽的纯度均符合后续实验要求。

Fig.2 LC-MS spectrum of RKDVY-FITC(A)and NapGDFDFDYGRKDVY-FITC(B)图2RKDVY-FITC(A)及NapGDFDFDYGRKDVY-FITC(B)的LC-MS谱图
2.3 胸腺五肽超分子水凝胶的制备及表征 成胶测试结果表明,多肽分子NapGDFDFDYGRKDVY加热冷却后5 min内即可形成透明的水凝胶,其最低成胶浓度为1 g/L(图3A);透射电镜结果表明,形成的水凝胶内部由密集交错的直径约为20~30 nm的长纤维构成(图3B);流变测试结果表明,在0.1~100 rad/s的测试频率范围内,该水凝胶的弹性模量G′始终大于其黏性模量G′′,表明该水凝胶具有良好的延展性(图3C)。

Fig.3 The optical image(A),TEM image(B)and rheology property(C)of NapGDFDFDYGRKDVY supramolecular hydrogel图3 NapGDFDFDYGRKDVY超分子水凝胶的光学照片(A)、透射电镜照片(B)以及流变学表征(C)
2.4 细胞摄取实验 小鼠RAW 264.7巨噬细胞对RKDVY-FITC及NapGDFDFDYGRKDVY-FITC的摄取结果,见图4。孵育4 h后,RKDVY-FITC作用后的细胞内能观察到较弱的FITC荧光信号,表明游离状态的RKDVY-FITC通过被动扩散进入细胞并在细胞内少量滞留;而NapGDFDFDYGRKDVY-FITC作用后的细胞内FITC荧光信号则明显强于RKDVYFITC,表明细胞对NapGDFDFDYGRKDVY有较强的摄取性能。
2.5 体外免疫调节实验 空白对照组、RKDVY组及NapGDFDFDYGRKDVY组作用后的细胞上清中TNF-α的浓度呈依次增加趋势(F=644.1,P<0.05),见图5。
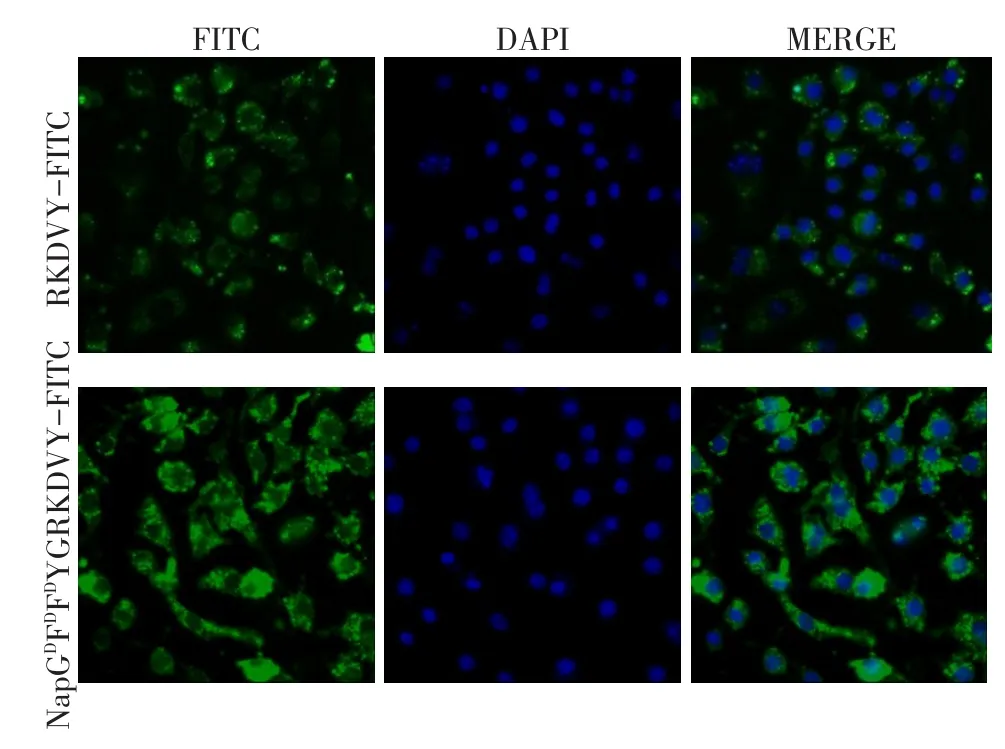
Fig.4 Cellular uptake of free thymopentin and thymopentin-containing nanofibers in RAW 264.7 cells after 4-hour incubation图4 RAW 264.7细胞对游离胸腺五肽及胸腺五肽纳米纤维在4 h后的摄取结果
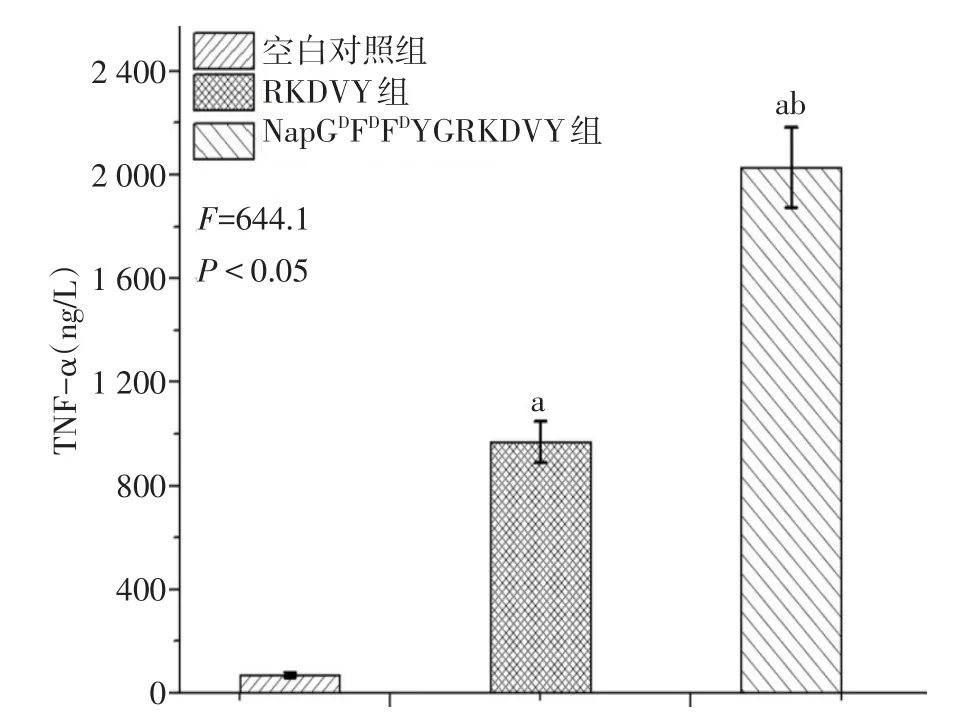
Fig.5 The amount of TNF-α in RAW 264.7 cells stimulated by free thymopentin and thymopentin-containing nanofibers for 24 hours图5 RAW 264.7细胞在游离胸腺五肽及胸腺五肽纳米纤维刺激24 h后分泌TNF-α的含量
3 讨论
基于多肽自组装的超分子水凝胶由于具有容易设计合成、生产成本低以及生物相容性好等优势,近年来在药物递送、免疫佐剂、肿瘤治疗等方面表现出了较大的应用潜能[7-8]。Zhao等[9]发现包括活性肽在内的药物小分子经共价修饰到特定的短肽上后,可自组装形成纳米纤维、纳米粒子等自传输的药物递送系统,从而能够实现提高药物稳定性和活性的目的。另外,Wang等[10-11]研究表明,疏水性五肽-NapGFFY/NapGDFDFDY具有较强的自组装凝胶化性能,其本身并无免疫调节作用,但能够作为抗原载体提高机体对特定抗原的免疫应答。本研究设计合成的自组装活性肽在分子结构上主要由疏水性的NapGDFDFDY和亲水性的RKDVY构成,得到的衍生多肽-NapGDFDFDYGRKDVY能够经加热-冷却形成稳定的水凝胶。其成胶原理为:化合物分子在加热高温下溶解,温度降低后溶解度逐渐降低,当溶解与析出达到平衡时,分子发生自组装形成网状纳米纤维将水分子包裹住,从而形成肉眼可见的水凝胶。由于多肽中天然存在的L构型氨基酸容易被活性蛋白酶快速降解[12],因此本研究用D构型的FFY取代L构型的FFY,得到的自组装多肽有望在一定程度上提高RKDVY的稳定性和生物利用度。
RKDVY作为一种亲水性短肽,具有极高的水溶性,其溶解度可达10 g/L以上。由于构成细胞膜主要成分的磷脂双分子层在结构上是两亲性的,致使太亲水及太疏水的活性小分子都不易穿过细胞膜屏障进入细胞,存在细胞膜渗透性差的缺陷。Cai等[13]发现相较于游离小分子通过被动扩散的方式进入细胞,形成纳米结构后的药物分子则可以通过能量依赖的主动运输途径进入细胞,从而极大提高细胞摄取率。本研究中,相较于游离RKDVY,RAW 264.7细胞对NapGDFDFDYGRKDVY的摄取量显著增强,与上述文献结论相一致,表明纳米结构的形成可以有效提高RKDVY的细胞摄取结果。
作为免疫调节功能的一部分,RKDVY已经被证实能够刺激未分化的巨噬细胞产生TNF-α,良好的细胞摄取滞留性能是其在细胞内发挥其功能作用的基本保障。RKDVY由于极短的半衰期(30 s),在临床应用中需要不断重复注射以维持其活性,从而给患者增加了额外的痛苦和负担[5]。目前,已有报道采用纳米制剂物理包裹的方式来提高RKDVY的半衰期和治疗疗效。如Yin等[14]利用修饰有凝集素的聚乳酸-羟基乙酸共聚物(polylactic-co-glycolic acid,PLGA)纳米粒子包载RKDVY以提高其口服给药的效果。Zhang等[6]制备了生物可吸收的聚乳酸-聚 乙 二 醇 -聚 乳 酸[polylactide-poly(ethylene glycol)-polylactide,PLA-PEG-PLA]水凝胶,通过物理包裹的方式实现了对RKDVY的可控释放。相比于物理包裹方法,本研究通过共价修饰制备得到的胸腺五肽自传输水凝胶,具有合成简单、可重复性好、载药量高等优势。本研究体外细胞免疫调节实验结果表明,相较于游离RKDVY,NapGDFDFDYGRKDVY具有更强的免疫调节性能,为下一步体内研究提供了基础。另外,有研究表明纳米纤维经物理打散后可通过静脉注射的方式进入体内血液循环,进一步通过增强的通透性和滞留性效应(enhanced permeability and retention effect,EPR)富集到肿瘤等病灶部位[15],因此,本研究制备的纳米纤维有望极大提高RKDVY的体内免疫调节效果。本研究为RKDVY结构修饰及治疗活性的提高提供了新的方法与思路。
[1]Lao XZ,Li B,Liu M,et al.Increased antitumor activity of tumorspecific peptide modified thymopentin[J].Biochimie,2014,107,277-285.doi:10.1016/j.biochi.2014.09.013.
[2]Wang Y,Ke XY,Khara JS,et al.Synthetic modifications of the immunomodulating peptide thymopentin to confer antimycobacterial activity[J].Biomaterials,2014,35(9):3102-3109.doi:10.1016/j.biomaterials.2013.12.049.
[3]Zhu MX,Wan WL,Li HS,et al.Thymopentin enhances the generation of T-cell lineage derived from human embryonic stem cells in vitro[J].Exp Cell Res,2015,331(2):387-398.doi:10.1016/j.yexcr.2014.12.012.
[4]Li J,Cheng Y,Zhang XK,et al.The in vivo immunomodulatory and synergistic anti-tumor activity of thymosin alpha 1-thymopentin fusion peptide and its binding to tlr2[J].Cancer Let,2013,337(2):237-247.doi:10.1016/j.canlet.2013.05.006.
[5]Tan YY,Wang W,Wu CL,et al.Myristic acid-modified thymopentin for enhanced plasma stability and immune-modulating activity[J].Int Immunopharmacol,2017,47:88-94.doi:10.1016/j.intimp.2017.03.025.
[6]Zhang Y,Wu XH,Han YR,et al.Novel Thymopentin release systems prepared from bioresorbable pla-peg-pla hydrogels[J].Int J Pharm,2010,386:15-22.doi:10.1016/j.ijpharm.2009.10.045.
[7]WangY,Cheetham AG,AngacianG,etal.Peptide-drug conjugates as effective prodrug strategies for targeted delivery[J].Adv Drug Delivery Rev,2017,110:112-126.doi:10.1016/j.addr.2016.06.015.
[8]Wang M,Cheetham AG,Cui HG,et al.Building nanostructures with drugs[J].Nano Today,2016,11(1):13-30.doi:10.1016/j.nantod.2015.11.003.
[9]Zhao F,Ma ML,Xu B,et al.Molecular hydrogels of therapeutic agents[J].Chem Soc Rev,2009,38(4):883-891.doi:10.1039/b806410p.
[10]Wang HM,Luo ZC,Wang YZ,et al.Enzyme-catalyzed formation of supramolecular hydrogels as promising vaccine adjuvants[J].Adv Funct Mater,2016,26(11):1822-1829.doi:10.1002/adfm.201505188.
[11]Luo ZC,Wu QJ,Yang CB,et al.A Powerful Cd8(+)T-cell stimulating D-Tetra-peptide hydrogel as a very promising vaccine adjuvant[J].Adv Mater,2017,29(5):1601776.doi:10.1002/adma.201601776.
[12]Wang HM, Feng ZQ, Xu B.D-amino acid-containing supramolecular nanofibers for potential cancer therapeutics[J].Adv Drug Delivery Rev,2017,110:102-111.doi:10.1016/j.addr.2016.04.008.
[13]Cai YB,Shen HS,Zhan J,et al.Supramolecular"trojan horse"for nuclear delivery of dual anticancer drugs[J].J Am Chem Soc,2017,139(8):2876-2879.doi:10.1021/jacs.6b12322.
[14]Yin,Y,Shu C,Da W,et al.Lectin-conjugated PLGA nanoparticles loaded with thymopentin:Ex vivo bioadhesion and in vivo biodistribution[J].J Controlled Release,2007,123:27-38.doi:10.1016/j.jconrel.2007.06.024.
[15]Webber MJ,Langer R.Drug delivery by supramolecular design[J].Chem Soc Rev,2017,46(21):6600-6620.doi:10.1039/c7cs00391a.
