难治性噬血细胞综合征并发多脏器功能衰竭一例ICU抢救体会
2018-07-04王旖君张祯李财峰张营高莹王昭王志强
王旖君,张祯,李财峰,张营,高莹,王昭,王志强△
噬血细胞综合征(hemophagocytic syndrome,HPS)是由活化的淋巴细胞和组织细胞增殖失控并分泌大量炎性细胞因子而引起的过度炎症反应[1],较为罕见,但病死率很高[2]。其病情凶险,诊断困难,患者可很快死于感染和多脏器功能衰竭[3]。一般认为在初次常规或重新强化治疗2~4周后患者的临床症状和实验室检查指标无明显改善甚至恶化即可归为难治性HPS的范畴,超过该时限的延误很有可能导致病情加重、甚至死亡等不良后果[4]。因此,不少学者提出了挽救性治疗的理念与及时治疗的必要性[5]。本文是对天津医科大学总医院重症医学科成功抢救的1例难治性HPS并发多脏器功能衰竭患者所做的回顾性综合报告,不仅完整回顾了整个救治过程,还特别依据挽救性治疗的理念对该患者进行了临床实践,旨在探讨重症难治性HPS在重症监护病房(ICU)抢救中的策略与体会。
1 临床资料
患者 女,29岁。主因间断发热2周,周身皮疹3 d,于2014年9月15日入住天津医科大学总医院感染免疫科。2周前,患者出现低热,体温37.8℃左右,同时发现颈部及腹股沟淋巴结稍大,自认为“感冒”,未进行特殊处理。3 d前体温波动增大,最高达38.5℃,自服退热药无缓解。患者自感颈部淋巴结有所增大,伴周身散在皮疹,故以“上呼吸道感染,传染性单核细胞增多症?血液系统恶性肿瘤?结缔组织病?”等为初步诊断收住院。既往体健,育有一子,无毒物接触史。入感染科之时,持续表现为中等度发热,体温波动明显,介于37.0~38.5℃。查体见颈部及腹股沟淋巴结如绿豆样大小,周身散在点状粟粒样皮疹。怀疑病毒性上呼吸道感染,予甲基泼尼松龙40 mg每天1次;喷昔洛韦500 mg每12 h 1次,对症处理后好转,体温恢复正常,于2014年9月30日出院。出院后1周,患者于家中受凉后再度出现高热,体温达39.5℃,于天津医科大学总医院感染免疫科门诊检查发现白细胞、血小板有明显减低趋势,并出现肝功能明显异常。患者于2014年10月3日主因“发热伴周身皮疹加重2 d”,拟定诊断与前次住院相同,再次入住感染免疫科。当时实验室检查表现出“血三系”(血红蛋白、白细胞、血小板)进行性下降,肝功能恶化,凝血异常。综合治疗1周余,延用激素控制炎症,吲哚美辛降温,喷昔洛韦、膦甲酸钠抗病毒的基础上,联合美罗培南、万古霉素、卡泊芬净、哌拉西林他唑巴坦等抗细菌真菌感染,并于2014年10月10日及10月11日2次行血浆置换治疗,每次血浆用量约1 500 mL。但体温无改善,仍持续高热39℃以上,并呈现多脏器损害状态。次日行PET-CT检查:肝脾明显肿大,尤以脾脏突出,有特征性放射性浓集表现,见图1、2;经全院会诊后于2014年10月13日转入重症医学科。
患者转入重症医学科后,体格检查:体温(T)38.3℃,心率(HR)82次/min,呼吸(R)17次/min,无创血压(NIBP)122/67 mmHg(1 mmHg=0.133 kPa),血氧饱和度(SpO2)1(鼻导管吸氧5 L/min);神志清,但精神差,烦躁不安;皮肤黏膜及巩膜明显黄染,周身散在皮疹及出血点;双侧颈前、颈后及腹股沟淋巴结呈进行性肿大,最大的如蚕豆大小。腹部膨隆、腹围102 cm(体健时约80 cm),又以左上腹脾区肿胀明显;双下肢水肿(+++)。血常规:白细胞计数(WBC)0.7×109/L,红细胞计数(RBC)1.03×1012/L,血红蛋白(Hb)50 g/L,血小板计数(PLT)15×109/L;肝功能检查:纤维蛋白原(FIB)0.55 g/L;乳酸脱氢酶(LDH)1 607 U/L,总胆红素(TBIL)126.3 μmol/L,总蛋白(TP)45 g/L,白蛋白(ALB)19 g/L,丙氨酸转氨酶(ALT)97 U/L,天冬氨酸转氨酶(AST)439 U/L,血清铁蛋白(SF)1.032×105μg/L;NK细胞活性15.46%(正常参考值15.11%~26.91%);可溶性IL-2受体(sCD25)>44 000 ng/L(正常参考值<6 400 ng/L);EB病毒DNA复制载量6.67×106拷贝/mL(正常参考值<400拷贝/mL);查风湿免疫全项、降钙素原(PCT)、G试验未见异常。考虑患者严重粒细胞缺乏,免疫力低下,给予重症监护,冰毯物理降温,输注新鲜全血,血小板、白蛋白、纤维蛋白原等血液支持治疗,抗细菌与抗病毒药物联合应用。但患者仍间断高热体温39℃以上,血象继续恶化,严重凝血功能异常,周身大面积瘀斑与出血点,以胸、背部为著。同时,心肌酶显著升高,磷酸肌酸激酶(CK)450 U/L,磷酸肌酸激酶同工酶(CK-MB)65 U/L,肌钙蛋白T(cTnT)0.18 μg/L,伴阵发室性心律失常。
本例患者在ICU中临床特征存在的一些特异性表现,归纳如下:(1)发热:体温39℃持续1周以上。(2)中度脾肿大(肋缘下5 cm),PET-CT有特征性放射性浓集表现。(3)Hb 50 g/L,PLT 15×109/L(最低达3×109/L),WBC 0.7×109/L,明显的“血三系”减低;骨穿示骨髓粒红系增生,但未见噬血现象。(4)低纤维蛋白原血症:FIB 0.55 g/L。(5)NK细胞活性较低:NK细胞活性15.46%。(6)高铁蛋白血症:SF 1.032×105μg/L。(7)可溶性IL-2受体水平明显升高:sCD25>44 000 ng/L。(8)EB病毒DNA复制载量显著升高,达6.67×106拷贝/mL。根据HLH-2004诊断标准[6],经津京两地专家多次会诊,最终确诊为EB病毒相关性组织淋巴细胞性噬血综合征。
2 治疗体会与关键点
2.1 初治 患者转入重症医学科后,WBC最低0.12×109/L,处于粒细胞缺乏状态,有极高的感染风险。为预防感染,将患者转至ICU层流正压病房。尽管感染风险极高,但由于病情进展极快,经慎重考虑,仍于转入3 d后(2014年10月16日)给予依托泊苷(etoposide,VP-16,江苏恒瑞医药)150 mg静脉滴注化疗1次。辅以甲基泼尼松龙40 mg每12 h 1次,连续应用3 d。但是,患者体温仍每日最高达39℃以上,精神食欲差,出血倾向加重,腹部皮下多发自发性血肿,黄疸加重。在一系列抗感染,保肝降酶,补充血制品,控制心律失常等对症综合治疗下,2014年10月22日查WBC恢复到4.13×109/L,Hb 115 g/L,PLT 42×109/L,FIB 2.57 g/L,ALB补充到40 g/L,ALT 36 U/L,AST 113 U/L,SF 1.707×104μg/L,肌酐(Cr)正常范围,EB病毒DNA复制载量1.18×104拷贝/mL,较转入时6.67×106拷贝/mL有明显降低。但TBIL升至328.8 μmol/L,血氨(NH3)101 μmol/L,考虑出现早期肝功能衰竭,于2014年10月24日及10月25日紧急行血液胆红素灌流吸附治疗后,TBIL暂时降至178.3 μmol/L,SF 9.884×103μg/L。
2.2 挽救治疗一 由于患者病情未见明显好转,综合津京两地专家的会诊意见与指南建议,考虑患者为难治性噬血细胞综合征。故于转入ICU层流正压病房13 d后(2014年10月26日)患者各脏器功能暂时稳定的条件下,决定采用挽救性治疗方案,即在原有的化疗方案基础上调整为以阿霉素类为主体的联合化疗方案。应用VP-16 150 mg联合脂质体阿霉素20 mg各1次治疗,同时应用甲基泼尼松龙820 mg每天1次静脉冲击,连用3 d。该方案实施后仅2 d,患者情况明显稳定好转,体温基本控制于37℃左右,食欲好转,皮下出血明显减轻,黄疸明显减轻。
2.3 病情平稳与再燃复治 随后于2014年11月3日及11月13日,查EB病毒DNA复制载量下降至1.18×103拷贝/mL和<400 拷贝/mL(实测值63.0);SF 4.44×103μg/L和3.47×103μg/L,提示患者在化疗和初次挽救性治疗后病毒复制得到了有效的控制。延续治疗给予VP-16 150 mg每周1次。
但患者于2014年11月14日再次出现体温升高,达39℃。复查发现,再次出现白细胞与血红蛋白下降,WBC 3.09×109/L,Hb 108 g/L。腹CT示脾明显增大,腹壁多发血肿;2014年11月20日复查发现EB病毒DNA复制载量反跳,升至4.13×104拷贝/mL。北京专家根据EB病毒复制量增加及血液系统再变,考虑噬血再燃。再次给予挽救方案化疗的同时,建议积极准备干细胞移植,同时因血液系统疾病化疗后感染风险高,予抗生素升级处理。
2.4 挽救治疗二 于2014年11月20日和11月22日,分别给予VP-16 150 mg和脂质体阿霉素20 mg各1次。同时,静脉应用大剂量甲基泼尼松龙冲击,820 mg每天1次,共3 d。1周后沿用VP-16 150 mg巩固效果,此后血常规及凝血功能,肝肾功能再次恢复至正常,黄疸消失,生命体征平稳,体温、二便正常,可正常进食及基本生活自理。以上均表明在ICU的一系列治疗下,血液系统病变得到了有效控制。但是,患者EB病毒DNA复制载量(1.3×104拷贝/mL)和铁蛋白(5.45×103μg/L)仍持续高位,显示噬血再燃,尚无缓解。结合患者治疗体会与当时脏器功能恢复情况:血常规及凝血功能大致正常,肝肾功能基本正常,各项生命体征平稳,体能明显恢复(可自行下床活动),故在1周后转往专科医院行造血干细胞移植治疗,以期从病因根治噬血细胞综合征。
2.5 ICU辅助治疗体会 首先是感染防控。患者严重白细胞缺乏,WBC最低0.12×109/L,且经过多次化疗。但是,依托ICU严格的无菌操作与消毒隔离措施,配合层流病房隔离及ICU高水平护理管控,多次复查PCT、G试验等感染指标及影像学均未发现明显感染征象,取得了理想的预期效果。其次是及时的血液治疗支持。患者严重贫血,凝血异常,PLT最低15×109/L,FIB最低0.55 g/L,且全身多发片状皮下出血,腹部皮下多发自发性血肿,给予输注大量新鲜全血,补充纤维蛋白原、冷沉淀及血小板,同时在凝血严重异常条件下,多学科配合,精准定位,建立深静脉抢救通路。第三是有效的脏器功能支持。患者有严重的脏器损害,实施挽救化疗方案前就出现肝衰竭表现,TBIL升至328.8 μmol/L。通过床旁血液净化,胆红素吸附,ICU综合抢救技术最大限度地保证了患者在治疗期间的脏器承载能力。同时,床旁超声心动、CT、磁共振等影像技术,对评估心肺脑功能,从而对症保护心肌、气道,降低化疗药物的心肌和肺间质损害起到了巨大的作用。最后,病情监控指标的选取至关重要。针对患者病情连续监测血常规及肝肾功能,尤其针对噬血细胞综合征连续监测SF及EB病毒DNA复制载量,对挽救性治疗方案的选择、调整和升级起到了关键的导向性意义。将患者病情变化及治疗过程简要总结如下,见表1。
3 讨论
HPS又名噬血细胞性淋巴组织细胞增多症(hemophagocytic lymphohistiocytosis,HLH),是由活化的淋巴细胞和组织细胞增殖失控并分泌大量炎性细胞因子(形成细胞因子风暴)而引起的过度炎症反应,使患者处于一种严重的炎症状态,可危及生命;主要症状和体征是长期发热、肝脾肿大和全血细胞减少。特征性生化标志物包括血三酰甘油、铁蛋白升高,纤维蛋白原降低等[1]。根据HLH-2004诊断标准,分子生物学诊断符合噬血细胞综合征或以下8项中满足5项即可诊断:(1)发热。持续时间>7 d,体温>38.5℃。(2)脾脏肿大(肋缘下≥3 cm)。(3)血细胞减少(外周血三系中至少有两系以上减少)。Hb<90 g/L(<4周的婴儿Hb<100 g/L),PLT<100×109/L,N<1.0×109/L,且非骨髓造血功能减低所致。(4)高三酰甘油血症和(或)低纤维蛋白原血症。空腹三酰甘油≥3.0 mmoL/L,FIB≤1.5 g/L。(5)骨髓、脾脏或淋巴结中发现噬血现象。(6)NK细胞活性减低或缺失。(7)高铁蛋白血症。SF≥500 μg/L。(8)sCD25水平明显升高[6]。其中血清sCD25及外周血NK细胞活性检测是HPS重要的辅助诊断指标[7]。本例患者符合以上诊断标准多达6项。
HPS包括原发性和继发性两大类,两者均以全身性炎症、严重的细胞因子风暴和免疫介导的器官损伤为特征。原发性噬血细胞综合征是由参与颗粒介导的细胞毒作用的基因突变引起的,继发性噬血细胞综合征发生于感染,恶性肿瘤或自身免疫性/自身炎性疾病的情况下[8],其中感染相关性HPS极为常见。许多病原体与HPS有关。在这些病原体中,与疱疹病毒家族,特别是与巨细胞病毒和EB病毒感染相关的HPS最为常见,而EB病毒被认为是最常引起感染相关性HPS的病原体[9]。HPS的治疗策略主要分为短期策略和长期策略。无论是原发性还是继发性HPS,患者最初都以全身性过度炎症反应为主要特征,因此短期策略都是以控制过度炎症为主;而长期策略则以纠正潜在的免疫缺陷为主[10],包括进行异基因造血干细胞移植来纠正缺陷基因(原发性HPS)以及积极控制原发病(继发性HPS)[4]。

Tab.1 Changes of disease and the process of treatment表1 病情变化及治疗过程
第1个HPS国际治疗标准(HLH-94治疗方案)是1994年由国际组织细胞协会HLH研究小组提出的,该方案包括用免疫抑制剂和细胞毒药物进行的初始强化治疗8周,目的是诱导处于活动状态的疾病缓解,故也可称为诱导治疗[11]。具体方案为应用VP-16联合地塞米松,同时,鞘内注射甲氨蝶呤被推荐用于进行性神经症状和(或)持续存在异常脑脊液检查结果的患者。8周后,患者可以继续治疗或停止治疗,或进行allo HSCT[12]。而如今,HLH-2004治疗方案已经成为HPS治疗新的主流,其中仍包含前8周的诱导治疗,具体方案为VP-16联合地塞米松及环孢素,部分中枢神经系统受累的患者可给予鞘内注射甲氨蝶呤和泼尼松龙。诱导治疗后可转为维持治疗[6]。对于EB病毒感染相关噬血细胞综合征(EBV-HLH),其诊断需符合HPS诊断标准、存在EB病毒感染证据(血清EB病毒DNA复制载量升高可确诊EB病毒感染),同时除外原发性HPS及淋巴瘤相关HPS等原发病[13],病情复杂,治疗棘手,虽然是病毒感染,但在目前,抗病毒治疗在EBV-HLH治疗中的作用仍有待明确[14]。VP-16能够强烈地抑制拓扑异构酶2,从而导致病毒的双链DNA断裂[15]。目前在其治疗药物的选择中有着不可替代的作用。
对于难治性噬血细胞综合征,目前没有公认的诊断标准,一般认为在初次常规或重新强化治疗2~4周后患者的临床症状和实验室检查指标无明显改善甚至恶化即可归为难治性HPS的范畴,超过该时限的延误治疗很有可能导致病情加重、甚至死亡等不良后果[4]。因此,不少学者提出了挽救性治疗的理念与及时治疗的必要性[5],但目前尚无统一方案。值得一提的是,首都医科大学附属北京友谊医院进行了第1个关于成人难治性HPS的前瞻性临床研究[16];对63例难治性HPS患者给予脂质体阿霉素联合VP-16及甲基泼尼松龙(DEP)作为挽救治疗方案;结果显示,完全缓解17例(27.0%),部分缓解31例(49.2%),总体反应率为76.2%(48/63);对DEP无反应的患者在抢救治疗后4周内死亡,48例获得完全或部分缓解的患者中有29例在随后的化疗、allo HSCT或脾切除术后存活。这项研究表明DEP方案是成人难治性HPS的有效挽救方案[17]。除此之外,血浆置换也是快速清除血清中大量炎性细胞因子的可靠而有效的治疗方法[18]。
HPS病情凶险,诊断困难,患者可很快死于感染和多脏器功能衰竭。有研究指出,大多数HPS病例死亡均发生于前8周[3]。所以在HPS治疗的早期,不管患者是处于诱导治疗还是处于挽救治疗阶段,及时而有力的支持治疗必不可少。本例患者抢救成功的关键点不仅仅是抓住了初治的早期以及挽救治疗的及时性、有效性,更是与感染的治疗与预防,血液系统功能维护,重要脏器功能的保护,营养补充与身体内环境的稳定等方面密不可分。例如患者短期内肝功能迅速恶化,黄疸,腹胀,“血三系”明显减低,凝血功能严重异常,全身出血倾向等危机的应对和处理:在TBIL急剧上升时及时进行了血液净化及血液灌流,减轻了高胆红素血症的全身损害,为治疗赢得了宝贵的时间;在血小板、纤维蛋白原极低,严重出血倾向时及时有效地进行了B超引导下深静脉穿刺置管,为后期化疗及支持治疗提供了重要保障。以上这些都充分体现了ICU的价值所在。在阿霉素类药物化疗期内曾出现心肌损害所致的恶性心律失常,正是ICU的实时监护,使病情得以及时发现和处理,化解了对生命的威胁。在中性粒细胞缺乏情况下的化疗,严重感染导致死亡风险极高,但患者的抢救治疗始终于ICU而非普通病房中进行,依托ICU强大的脏器支持能力和细致专业的监护、护理以及评估体系,最终成功避免了患者因多脏器衰竭及严重感染而导致的不良后果,为后期造血干细胞移植争取到了时间。
总之,在及时正确治疗原发病的基础上,诸如挽救性治疗等新理念的引入,对HPS的综合救治给我们以深刻的体会。同时,有效的感染控制和全面的脏器支持,可明显改善HPS的阶段性治疗结局,为HPS患者的存活提供可能。这也为HPS的治疗理论提供了新的尝试。
(图1、2见插页)

Fig.1 PET-CT images suggest the increased metabolism in spleen and bone marrow,and no signs of the malignant solid tumor图1 PET-CT示脾及骨髓代谢弥漫增高,未见恶性实体肿瘤征象
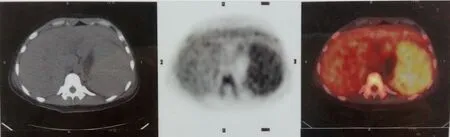
Fig.2 PET-CT images show characteristic radioactive concentration图2 PET-CT有特征性放射性浓集表现
Fig.1 Bone window图1 骨窗
[1] Janka GE. Familial and acquired hemophagocytic lymphohistiocytosis[J]. Annu Rev Med,2007,166(2):233-246.doi:10.1146/annurev-med-041610-134208.
[2] Mehta RS, Smith RE. Hemophagocytic lymphohistiocytosis (HLH):a review of literature[J]. Med Oncol,2013,30(4):740.doi:10.1007/s12032-013-0740-3.
[3]王旖旎,王昭,吴林,等.多中心72例噬血细胞综合征诊疗分析[J].中华血液学杂志,2009,30(12):793-798.Wang YN,Wang Z,Wu L,et al.A multicenter retrospective analysis of diagnosis and treatment of 72 hemophagocytic syndrome patients[J].Chinese Journal of Hematology,2009,30(12):793-798.doi:10.3760/cma.j.issn.0253-2727.2009.12.001.
[4]黄文秋,王旖旎,王昭.噬血细胞性淋巴组织细胞增生症的治疗进展[J].临床荟萃,2014,29(10):1147-1150.Huang WQ,Wang YN,Wang Z. Treatment advance in hemophagocytic lymphohistiocytosis[J].Clinical Focus,2014,29(10):1147-1150.
[5]Marsh RA,Allen CE,Mcclain KL,et al.Salvage therapy of refractory hemophagocytic lymphohistiocytosis with alemtuzumab[J].Pediatr Blood Cancer,2013,60(1):101-109.doi:10.1002/pbc.24188.
[6]Henter JI,Horne A,Aricó M,et al.HLH-2004:Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J].Pediatr Blood Cancer,2007,48(2):124-131.
[7]王菱菱,胡昳歆,陈纬凤,等.可溶性IL-2受体及NK细胞活性在噬血细胞性淋巴组织细胞增多症中的意义[J].中国实验血液学杂志,2012,20(2):401-404.Wang LL,Hu YX,Chen WF,et al.Significance of soluble interleukin-2 receptor and NK cell activity in patients with hemophagocytic lymphohistiocytosis[J].Journal of Experimental Hematology,2012,20(2):401-404.
[8]Brisse E, Wouters CH, Matthys P. Hemophagocytic lymphohistiocytosis(HLH):A heterogeneous spectrum of cytokinedriven immune disorders[J].Cytokine Growth Factor Rev,2015,26(3):263-280.doi:10.1016/j.cytogfr.2014.10.001.
[9]Rosado FG,Kim AS.Hemophagocytic lymphohistiocytosis:an update on diagnosis and pathogenesis[J].Am J Clin Pathol,2013,139(6):713-727.doi:10.1309/AJCP4ZDKJ4ICOUAT.
[10]Janka GE,Lehmberg K.Hemophagocytic lymphohistiocytosis:pathogenesis and treatment[J].Hematology Am Soc Hematol Educ Program,2013,2013:605-611.doi:10.1182/asheducation-2013.1.605.
[11]Henter JI,Aricò M,Egeler RM,et al.HLH-94:a treatment protocol for hemophagocytic lymphohistiocytosis.HLH study Group of the Histiocyte Society[J].Med Pediatr Oncol,1997,28(5):342-347.
[12]Trottestam H,Horne A,Aricò M,et al.Chemoimmunotherapy for hemophagocytic lymphohistiocytosis:long-term results of the HLH-94 treatment protocol[J].Blood,2011,118(17):4577-4584.doi:10.1182/blood-2011-06-356261.
[13]卫青,王昭.EB病毒相关噬血细胞综合征研究进展[J].中国实验血液学杂志,2011,19(6):1541-1544.Wei Q,Wang Z.Research advance on Epstein-Barr virus-associated hemophagocytic lymphohistiocytosis-Review [J].Journalof Experimental Hematology,2011,19(6):1541-1544.
[14]Imashuku S. Treatment of Epstein-Barr virus-related hemophagocytic lymphohistiocytosis(EBV-HLH);update 2010[J].J Pediatr Hematol Oncol,2011,33(1):35-39.doi:10.1097/MPH.0b013e3181f84a52.
[15]HandeKR.Etoposide:fourdecadesofdevelopmentofa topoisomerase Ⅱ inhibitor[J].Eur J Cancer,1998,34(10):1514-1521.
[16]王旖旎,王昭.《Multicenter study of combination DEP regimen as a salvage therapy for adult refractory hemophagocytic lymphohistiocytosis》解读——难治性噬血细胞综合征挽救治疗的临床探索[J].临床血液学杂志,2016,29(5):351-353.Wang YN,Wang Z.Comments on“Multicenter study of combination DEP regimen as a salvage therapy for adult refractory hemophagocytic lymphohistiocytosis”——Clinical exploration of salvage therapy for patients with refractory hemophagocytic lymphohistiocytosis[J].Journal of Clinical Hematology,2016,29(5):351-353.doi:10.13201/j.issn.1004-2806.2016.05.001.
[17]Wang Y,Huang W,Hu L,et al.Multicenter study of combination DEP regimen as a salvage therapy for adult refractory hemophagocytic lymphohistiocytosis[J].Blood,2015,126(19):2186-2192.doi:10.1182/blood-2015-05-644914.
[18]Hoshi K,Matsuda M,Ishikawa M,et al.Successful treatment of fulminant pulmonary hemorrhage associated with systemic lupus erythematosus[J].Clin Rheumatol,2004,23(3):252-255.
