大肠杆菌亚型致脓毒症模型比较研究
2018-07-04张晶晶孔宪斌霍景瑞王蕾刘颖杨晓晖田毅侯振江陈锋陈旭义孙世中夏天光孙中磊黄梦强刘英富
张晶晶,孔宪斌,霍景瑞,王蕾,刘颖,杨晓晖,田毅,侯振江,陈锋,陈旭义,孙世中,夏天光,孙中磊,黄梦强,刘英富△
脓毒症是具有高死亡率的疾病,严重危害人类生命健康[1],同时耗费了大量资金投入[2],但脓毒症相关研究发展相对缓慢[3]。目前,常用的脓毒症动物模型有盲肠结扎穿孔模型(cecal ligation and puncture,CLP)、升结肠支架置入致腹膜炎(colon ascendens stent peritonitis,CASP)、腹腔注射脂多糖(Lipopolysaccharides,LPS)及腹腔注射活菌致脓毒症模型。然而,现有脓毒症模型不能完全模仿临床脓毒症患者的发病过程,这也是制约脓毒症研究进展的重要原因之一[4]。CLP模型和CASP模型常因结扎盲肠的部位和针头的尺寸差异造成模型均一性不足[5-6]。LPS诱导的脓毒症模型是急性内毒素血症模型,不能较好地模拟脓毒症患者对抗微生物感染过程和免疫应答反应[7]。腹腔注射大肠杆菌可诱发致死性腹部感染和脓毒症,可展现宿主抗菌防御机制的信息[8],且制作方法简单、方便、均一性较好,但因注射细菌的种类不同,引起脓毒症损伤程度有所差异。本研究旨在对比分析不同类型的大肠杆菌引起的脓毒症小鼠的损伤程度,以规范腹腔注射细菌致脓毒症的建模方法,为相关研究提供参考。
1 资料与方法
1.1 一般资料 (1)实验动物。清洁级雄性BALB/c小鼠152只,6~8周龄,体质量18~25 g,从中国人民解放军军事医学科学院实验动物中心获取[北京,中国SCXK-(军)2012-0004],小鼠被安置在无病原体的环境中,自由进食饮水,室内温度维持(22±2)℃,人工光暗周期12 h,所有实验都参照动物伦理规范。(2)试剂。大肠杆菌 DH5α、CMCC44102、ATCC25922由本实验室保存;小鼠肿瘤坏死因子(TNF)-α、白介素(IL)-6的酶联免疫吸附测定(ELISA)检测试剂盒购自北京四正柏生物科技有限公司;兔抗小鼠高迁移率族蛋白1(HMGB1)抗体购自Abcam公司,兔抗小鼠β-Tubulin抗体、辣根过氧化物酶(HRP)标记的羊抗兔抗体购自北京康为世纪生物科技有限公司,ECL发光液购自Millipore公司。
1.2 细菌悬浮液的制备及浓度测定 将细菌接种于100 mL的无菌培养基中,在37℃、200 r/min的摇床上培养12 h,随后分别在培养基中取1 mL进行10倍梯度稀释,稀释到10-9倍。在10-5~10-9稀释倍数中各取500 μL倒入装有无菌琼脂培养基的培养皿中,并顺时针转动培养皿,使菌液充分平铺,随后倒置37℃培养箱内培养12 h。将培养12 h的培养皿取出,计平板的细菌菌落数,推算原液细菌浓度,以原液中每毫升集落形成单位(clonal formation unit/Milliliter,CFU/mL)表示。
1.3 动物分组及处理 用随机数字表法将152只小鼠分为对照组、DH5α组、44102组和25922组,每组38只。DH5α组、44102组、25922组分别腹腔注射300 μL浓度为1.0×109CFU/kg的大肠杆菌DH5α、44102、25922;对照组腹腔注射等体积的生理盐水。3组细菌脓毒症模型均出现食欲不振,自洁能力下降,毛发失去光泽,独处,眯眼,分泌物增多等脓毒症造模成功的表现,对照组无上述表现,饮食如常。共造模152只,0只死亡,最后入组152只,各组38只。
1.4 血细菌培养 取造模成功后小鼠16只,每组4只[9],造模8 h后,各组经眼眶静脉丛无菌取血,肝素抗凝,各血液标本经LB液体培养基10倍稀释后分别取0.1 mL均匀涂布于LB固体平板,37℃孵育18 h,菌落计数仪统计菌落数并拍照,根据稀释浓度最终换算到血液菌落的数目,最终的计量单位为菌落形成单位(clonal formation unit,CFU)。
1.5 炎症因子检测 取造模成功后小鼠40只,每组10只,造模12 h后,各组通过摘眼球法采血1 mL,3 000 r/min离心15 min后取血清置于EP管中-80℃冻存,用于检测血清IL-6及TNF-α。
1.6 蛋白质免疫印迹试验(Western blot)检测HMGB1 分组同1.4。造模12 h后,各组通过摘眼球法采集血液标本,离心后取血清置于EP管中-80℃冻存待测。Western blot测定血清中HMGB1的表达,小鼠血清经与适量上样缓冲液混匀,经电泳后,应用湿式电转移法进行转膜;5%脱脂奶粉封闭,洗膜后,加入兔抗小鼠HMGB1抗体孵育;洗膜后,加入羊抗兔IgG/HRP孵育;洗膜后,显色曝光并扫描成像,同时以β-Tubulin为内参进行校准。利用Image J图像分析软件计算条带灰度值,以目的条带与内参条带灰度值的比值反映目的蛋白的表达水平。
1.7 肝肾功能检测 分组同1.5。造模12 h后,各组通过摘眼球法采集血液标本,离心并吸取血清于干净的EP管中,立即送检,采用自动生化分析仪检测各组血清中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、尿素氮(BUN)、血肌酐(CR)水平。
1.8 病理切片 分组同1.5。造模12 h后,取各组小鼠肺、肝、肾组织常规制作病理切片,苏木精-伊红(HE)染色,在光镜下观察并照相。
1.9 统计学方法 采用SPSS 20.0软件进行统计分析。符合正态分布的计量数据以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,组间多重比较用Tukey法,P<0.05为差异有统计学意义。
2 结果
2.1 各组血细菌培养 对照组小鼠血液中未检出细菌,DH5α组、44102组、25922组细菌量分别为(单位CFU)76.00±20.70、339.00±91.02和1 076±165.09,呈依次增多趋势(F=107.168,P<0.01)。
2.2 各组IL-6、TNF-α释放水平 DH5α组、44102组、25922组的IL-6、TNF-α均高于对照组(P<0.01);DH5α组、44102组、25922组TNF-α、IL-6均呈依次增高趋势(P<0.05),见表1。
Tab.1 Comparison of IL-6 and TNF-α between four groups表1 各组IL-6、TNF-α的比较 (n=10,ng/L,±s)

Tab.1 Comparison of IL-6 and TNF-α between four groups表1 各组IL-6、TNF-α的比较 (n=10,ng/L,±s)
**P<0.01;a与对照组比较;b与DH5α组比较,c与44102组比较,P<0.05;表2同
组别对照组DH5α组44102组25922组F IL-6 67.02±4.90 92.92±4.64a 100.29±5.51ab 108.48±7.85abc 93.335**TNF-α 11.27±3.11 20.39±2.10a 25.34±2.93ab 30.84±3.70abc 76.047**
2.3 各组HMGB1水平比较 DH5α组、44102组、25922组的HMGB1均高于对照组(P<0.05);DH5α组、44102组、25922组的HMGB1呈依次增高趋势(P<0.05),见图1。
2.4 各组肝肾指标变化 DH5α组、44102组、25922组的ALT、AST、BUN、CR的水平均高于对照组(P<0.01);DH5α组、44102组、25922组ALT、AST、BUN、CR呈依次增高趋势(P<0.05),见表2。
2.5 HE染色观察各组肺肝肾损伤情况 肺切片的肺泡结构损伤程度由重到轻依次为25922组、44102组、DH5α组;肝切片炎性细胞浸润程度由重到轻依次为25922组、44102组、DH5α组;肾切片显示肾小球萎缩程度由重到轻依次为25922组、44102组、DH5α组。对照组肺、肝、肾组织无明显损伤,见图2。
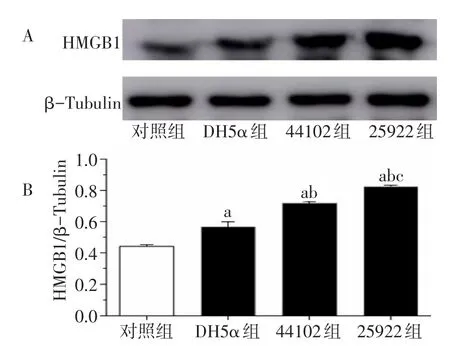
Fig.1 Quantitative histograms of HMGB1 protein expression and HMGB1/β-Tubulin in four groups图1 各组HMGB1蛋白表达及HMGB1/β-Tubulin的量化柱形图
Tab.2 Comparison of ALT,AST,BUN and CR between four groups表2 各组ALT、AST、BUN、CR的比较 (n=10,±s)
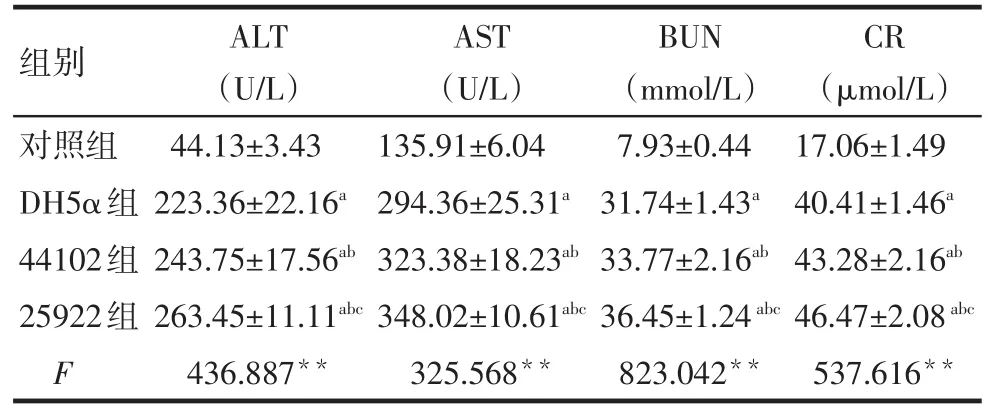
Tab.2 Comparison of ALT,AST,BUN and CR between four groups表2 各组ALT、AST、BUN、CR的比较 (n=10,±s)
**P<0.01;a与对照组比较,b与DH5α组比较,c与44102组比较,P<0.05
组别对照组DH5α组44102组25922组F ALT(U/L)44.13±3.43 223.36±22.16a 243.75±17.56ab 263.45±11.11abc 436.887**AST(U/L)135.91±6.04 294.36±25.31a 323.38±18.23ab 348.02±10.61abc 325.568**BUN(mmol/L)7.93±0.44 31.74±1.43a 33.77±2.16ab 36.45±1.24abc 823.042**CR(μmol/L)17.06±1.49 40.41±1.46a 43.28±2.16ab 46.47±2.08abc 537.616**
3 讨论
研究显示,通过腹腔接种细菌可形成相对局限的感染灶,诱发脓毒症,且血流动力学和代谢改变与临床相似[5]。然而,腹腔注射细菌形成的脓毒症模型仍存在同种属动物对不同类型的细菌反应存在差异的问题。所以比较不同类型细菌诱导的脓毒症模型损伤程度,为选择诱导脓毒症模型的细菌提供指导,这不仅可提高基础研究的严谨性,而且有利于基础研究更好地贴近临床。
细菌可以释放内毒素,内毒素直接或间接参与重要脏器损伤,宿主中血细菌培养较多,其引起的脓毒症模型可能会更重。脓毒症时体内细菌释放内毒素,内毒素可导致肝脏急性微血管反应以及肝细胞肿胀损害等现象[8,10],表现为肝细胞坏死、转氨酶升高等[11-12]。内毒素以及各种炎性介质入血之后,可导致肺循环血液流速减慢,出现肺脏损伤[13]。肾血流量减少被认为是脓毒症急性肾衰竭的中心环节,内毒素可使线粒体肿胀,细胞生物氧化功能受损[14]。目前,脓毒症动物模型仍有缺陷,如缺乏适当的疾病分期,随着脓毒症的发展;疾病的严重程度也会发生变化,这也是靶向治疗的主要障碍,适当的时机和具体的阶段性治疗能提高脓毒症动物模型的有效性[15]。
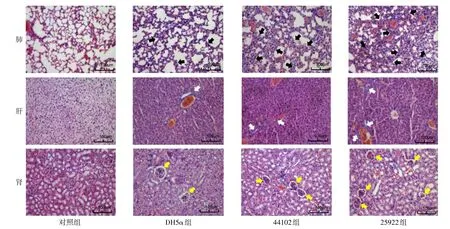
Fig.2 Observation of lung,liver and kidney tissues in four groups under light microscope(HE,×200)图2 各组肺肝肾组织光镜下观察(HE,×200)
本研究结果显示,3组细菌诱导的脓毒症模型血细菌培养由高到低依次为大肠杆菌25922、44102及DH5α,肝肾功能以及肺肝肾病理结果显示,3组小鼠脓毒症模型均出现了重要脏器的急性损伤,且细菌培养的数量与脏器损伤的严重程度呈正向关系,表明大肠杆菌25922增殖能力较强,对宿主的侵袭力最强,引起脏器损伤最严重,大肠杆菌DH5α增殖能力和侵袭力相对较弱,脏器损伤相对较轻,大肠杆菌44102的增殖能力、侵袭力,以及引起的脏器损伤介于大肠杆菌25922和大肠杆菌DH5α之间,提示大肠杆菌25922、44102、DH5α可分别用于诱导脏器严重损伤、中等损伤以及轻微损伤的脓毒症模型。
相关研究表明,脓毒症发病早期过强的炎症反应被认为是导致患者病情恶化和不良预后的关键因素,IL-6、TNF-α是主要的促炎因子,过强的炎症反应如果得不到控制会造成“细胞因子风暴”并引起促炎和抗炎失衡[16];IL-6、TNF-α炎症因子作为早期炎症因子,可直接或间接地损伤重要脏器[17-20]。HMGB1为近年发现的一种重要的晚期炎症介质,其不仅介导炎症反应[21],还可以与各种炎症因子相互作用引起级联反应[22],与脓毒症严重程度和预后关系密切[23]。另外,有研究认为部分患者并非死于脓毒症急性炎症风暴期,而是在脓毒症长期的免疫抑制阶段,形成器官功能障碍甚至死于二次感染[24]。本研究结果显示,25922组脓毒症模型产生促炎因子IL-6、TNF-α以及晚期炎症因子HMGB1能力最强,44102组产生IL-6、TNF-α、HMGB1能力介于25922组和DH5α组之间,DH5α组脓毒症模型产生IL-6、TNF-α、HMGB1能力相对较弱,表明大肠杆菌诱导炎症反应强度与脏器损伤成正向关系,25922组引起的脓毒症模型因炎症反应强烈,脏器损伤较重,DH5α组释放炎症因子水平相对较低,损伤相对较轻,44102组释放炎症因子水平、脏器损伤程度介于25922组和DH5α组之间,提示大肠杆菌25922可能适用于研究脓毒症初期炎症风暴阶段的动物模型;大肠杆菌DH5α可能适用于探索脓毒症免疫抑制期治疗方法的动物模型;大肠杆菌44102可能适用于无需限定脓毒症分期实验的动物模型。
[1]Septimus EJ,Coopersmith CM,Whittle J,et al.Sepsis national hospital inpatient quality measure(SEP-1):multistakeholder work group recommendations for appropriate antibiotics for the treatment of sepsis[J].Clin Infect Dis,2017,65(9):1565-1569.doi:10.1093/cid/cix603.
[2]Taneja I,Reddy B,Damhorst G,et al.Combining biomarkers with EMR data to identify patients in different phases of sepsis[J].Sci Rep,2017,7(1):10800.doi:10.1038/s41598-017-09766-1.
[3]Singer M,Deutschman CS,Seymour CW,et al.The third international consensus definitions for sepsis and septic shock(Sepsis-3)[J].JAMA,2016,315(8):801-810.doi:10.1001/jama.2016.0287.
[4]Chen L,Lu Y,Zhao L,et al.Curcumin attenuates sepsis-induced acute organ dysfunction by preventing inflammation and enhancing the suppressive function of Tregs[J].Int Immunopharmacol,2018,61(17):1-7.doi:10.1016/j.intimp.2018.04.041.
[5]Kingsley SM,Bhat BV.Differential paradigms in animal models of sepsis[J].Curr Infect Dis Rep,2016,18(9):26.doi:10.1007/s11908-016-0535-8.
[6]Tai LH,Ananth AA,Seth R,et al.Sepsis increases perioperative metastases in a murine model[J].BMC Cancer,2018,18(1):277.doi:10.1186/s12885-018-4173-4.
[7]Fink MP.Animal models of sepsis[J].Virulence,2014,5(1):143-153.doi:10.4161/viru.26083.
[8]Weinbren MJ,Collins M,Heathcote R,et al.Optimization of the blood culture pathway:a template for improved sepsis management and diagnostic antimicrobial stewardship[J].J Hosp Infect,2018,98(3):232-235.doi:10.1016/j.jhin.2017.12.023.
[9]Deng D,Li X,Liu C,et al.Systematic investigation on the turning point of over-inflammation to immunosuppression in CLP mice model and their characteristics[J].Int Immunopharmacol,2017,42(1):49-58.doi:10.1016/j.intimp.2016.11.011.
[10]Ge P,Yao X,Li J,et al.Diminazene aceturate alleviated lipopolysaccharide/D-galactosamine-induced fulminant hepatitis in mice[J].Biomed Pharmacother,2017,98(2):142-148.doi:10.1016/j.biopha.2017.12.034.
[11]Li J,Xia K,Xiong M,et al.Effects of sepsis on the metabolism of sphingomyelin and cholesterol in mice with liver dysfunction[J].Exp Ther Med,2017,14(6):5635-5640.doi:10.3892/etm.2017.5226.
[12]Zhao Y,Zhu H,Wang H,et al.FC-99 ameliorates sepsis-induced liver dysfunction by modulating monocyte/macrophage differentiation via Let-7a related monocytes apoptosis[J].Oncotarget,2018,9(19):14959-14976.doi:10.18632/oncotarget.24127.
[13]Chen X,Cai X,Le R,et al.Isoliquiritigenin protects against sepsisinduced lung and liver injury by reducing inflammatory responses[J].Biochem Biophys Res Commun,2018,496(2):245-252.doi:10.1016/j.bbrc.2017.11.159.
[14]Li T,Zhao J,Miao S,et al.Dynamic expression and roles of sequestome 1/p62 in LPS-induced acute kidney injury in mice[J].Mol Med Rep,2018,17(6):7618-7626.doi:10.3892/mmr.2018.8809.
[15]Zurfluh S,Baumgartner T,Meier MA,et al.The role of metabolomic markers forpatients with infectious diseases:implications for risk stratification and therapeutic modulation[J].Expert Rev Anti Infect Ther,2018,16(22):133-142.doi:10.1080/14787210.2018.1426460.
[16]Chousterman BG,Swirski FK,Weber GF.Cytokine storm and sepsis disease pathogenesis[J].Semin Immunopathol,2017,39(5):517-528.doi:10.1007/s00281-017-0639-8.
[17]Barre M,Behnes M,Hamed S,et al.Revisiting the prognostic value of monocyte chemotactic protein 1 and interleukin-6 in the sepsis-3 era[J].J Crit Care,2018,43(2):21-28.doi:10.1016/j.jcrc.2017.08.024.
[18]Gao N,Dong L.MicroRNA-146 regulates the inflammatory cytokines expression in vascular endothelial cells during sepsis[J].Pharmazie,2017,72(11):700-704.doi:10.1691/ph.2017.7600.
[19]Tanaka T, NarazakiM, Kishimoto T.Immunotherapeutic implications of IL-6 blockade for cytokine storm [J].Immunotherapy,2016,8(8):959-970.doi:10.2217/imt-2016-0020.
[20]Cavaillon JM.Exotoxins and endotoxins:Inducers of inflammatory cytokines[J].Toxicon,2017,pii:S0041-0101(17)30313-6.doi:10.1016/j.toxicon.2017.10.016.
[21]Yanai H,Chiba S,Hangai S,et al.Revisiting the role of IRF3 in inflammation and immunity by conditional and specifically targeted gene ablation in mice[J].Proc Natl Acad Sci USA,2018,115(20):5253-5258.doi:10.1073/pnas.1803936115.
[22]Andersson U,Yang H,Harris H,et al.Extracellular HMGB1 as a therapeutic target in inflammatory diseases[J].Expert Opin Ther Targets,2018,22(3):263-277.doi:10.1080/14728222.2018.1439924.
[23]Tzialla C,Manzoni P,Achille C,et al.New diagnostic possibilities for neonatal sepsis[J].Am J Perinatol.2018,35(6):575-577.doi:10.1055/s-0038-1639361.
[24]Horiguchi H,Loftus TJ,Hawkins RB,et al.Innate immunity in the persistent inflammation,immunosuppression,and catabolism syndrome and its implications for therapy[J].Front Immunol,2018,9:595.doi:10.3389/fimmu.2018.00595.
