基于基因芯片探索鼻咽癌的分子靶标
2018-07-04刘玉智门剑龙李杨
刘玉智,门剑龙,李杨△
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种鳞状细胞癌,常见于鼻咽侧壁咽鼓管口周围[1]。作为头颈部最常见的癌症类型,NPC是中国南方和东南亚地区发病率较高的恶性肿瘤之一[2]。放射治疗和化学治疗分别是早期和晚期NPC的主要治疗方法。尽管早期、局部的NPC患者大多数情况下是可治愈的,但大多数患者在就诊时已经被诊断为晚期,淋巴结转移、远端器官转移和局部病灶复发是晚期NPC患者预后不良的主要原因[3]。根据第七版美国癌症联合会(American Joint Committee on Cancer,AJCC)癌症分期手册,晚期NPC患者的5年生存率较低(Ⅲ期为62%,Ⅳ期为38%)[4]。研究发现病毒感染、遗传因素和环境因素均与NPC的发病相关,但其潜在的分子机制仍不明确[5]。利用分子生物学手段研究疾病的发病机制与病理过程是当前癌症领域研究的发展趋势;而通过表达谱芯片或转录组测序技术,在mRNA水平分析基因的表达,是筛选疾病相关基因最有效的途径。本研究利用生物信息学手段综合分析两套NPC表达谱芯片数据,并利用实时荧光定量PCR和Western blot在mRNA水平和蛋白水平进行验证,以期找到在NPC发生发展过程中起关键作用的基因。
1 材料与方法
1.1 材料 TRIzol购自Invitrogen公司;M-MLV逆转录酶购自Promega公司;PCR引物由华大基因公司合成;荧光定量PCR酶购自诺唯赞公司;Western blot裂解液购自天根公司;anti-CDC6、anti-CDK1购自abcam公司;anti-CCNB1购自LifeSpan BioSciences公司;anti-MCM2购自CST公司、山羊抗兔二抗购自CST公司。
1.2 数据预处理 以nasopharyngeal carcinoma为关键词,在GEO数据库(https://www.ncbi.nlm.nih.gov/gds/)中筛选出2套符合条件的基因芯片数据(GSE12452和GSE13597)。数据GSE12452中包含10个鼻炎黏膜组织样本和31个NPC样本,数据GSE13597中包含3个对照鼻炎黏膜组织样本和25个NPC样本。原始数据采用R编程语言的affy包对芯片探针水平上的表达值进行背景校准和Robust Multi-array Average(RMA)标准化;并且,利用芯片平台的注释包把探针符号转化为基因符号,对于多个探针对应同一个基因符号的情况,以这些探针表达值的平均值作为该基因的表达值。
1.3 基因差异表达分析 NPC组织与鼻炎黏膜组织基因表达差异采用t检验,P<0.05为差异有统计学意义。基因的相对表达差异以“NPC/Control”表示,以P<0.05并且|log2(NPC/Control)|>1为阈值,筛选差异表达基因。
1.4 基因功能分析和信号通路分析 采用美国国立卫生院(National Institutes of Health,NIH)的 DAVID(The Database for Annotation,Visualization and Integrated Discovery)软件平台对差异表达基因进行聚类分析。以P<0.05和至少富集10个基因为条件,筛选相关的GO(gene ontology)条目和KEGG(Kyoto Encyclopedia of Genes and Genomes)信号通路。
1.5 组织标本 鼻咽癌石蜡标本5例(NPC 1~NPC 5)来源于天津医科大学总医院病理科,对照鼻炎黏膜组织新鲜标本5例(Control 1~Control 5)来源于天津医科大学总医院耳鼻喉科门诊。全部组织标本资料信息见表1。
1.6 总RNA提取与实时定量PCR(real-time PCR) 取50~100 mg组织样品,利用TRIzol法提取总RNA,取2 μg总RNA经M-MLV逆转录酶逆转成cDNA后进行PCR反应,PCR引物序列见表2。PCR反应程序为预变性:94℃5 min;循环反应:(95 ℃ 10 s;60 ℃ 30 s)×40;溶解曲线:95 ℃ 15 s;60 ℃ 60 s;95℃15 s。基因相对表达水平采取2-ΔΔCt相对定量法计算。
1.7 Western blot 分别选取NPC 1~4组织和Control 1~4组织,裂解液裂解组织,提取总蛋白,聚丙烯酰胺凝胶电泳。将蛋白从SDS-PAGE胶转膜至PVDF膜,利用5%脱脂奶粉封闭,然后分别加入一抗anti-CDC6、anti-CDK1、anti-MCM2、anti-CCNB1,在37℃箱孵育1 h;TBST漂洗5 min×4次;加山羊抗兔二抗(1∶1 000),37℃作用1 h;TBST 漂洗5 min×4次;暗室避光X线胶片曝光,用化学发光法显影。
1.8 统计学方法 采用SPSS 11.5软件进行统计学分析,计量数据以均数±标准差(±s)表示,组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
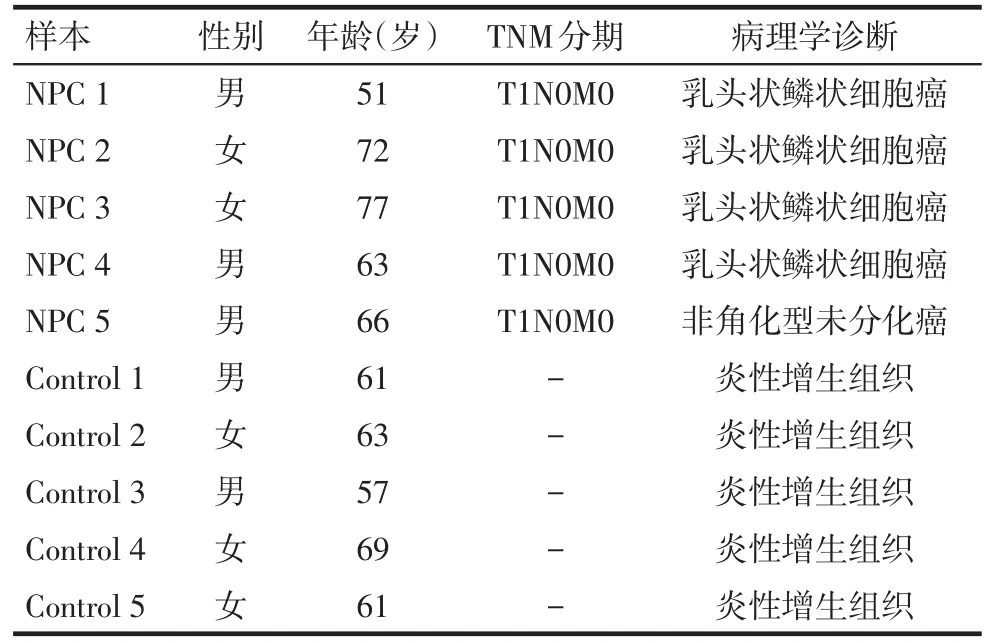
Tab.1 Information of tissue specimen表1 组织标本资料信息
2 结果
2.1 差异表达基因 本研究在数据GSE12452中找到1 701个差异表达基因,其中988个基因表达下调,713个基因表达上调;数据GSE13597中找到869个差异表达基因,其中363个基因表达下调,506个基因表达上调。为了进一步筛选在NPC发生发展过程中起关键作用的基因,对两套基因芯片数据的结果取交集,获得了260个差异表达基因。
2.2 基因功能分析和信号通路分析 筛选出16个GO条目和4个KEGG信号通路,见表3、4。
2.3 Real-time PCR验证基因芯片结果 利用realtime PCR技术检测18个细胞周期相关基因在NPC组织中和鼻炎黏膜组织中的mRNA表达水平,结果发 现 CDC6、CDK1、SKP2、TTK、CHEK1、MCM2、CDK4、MCM4、CCNB1、CDC45、MYC、CCNA2的表达水平在NPC组织中显著上调,而MAD2L1、MCM7、CCNB2、CCND2、BUB1、BUB1B的表达水平在两种组织中没有明显变化,见表5。
2.4 Western blot验证 Western blot检测NPC组织中和鼻炎黏膜组织中CDC6、CDK1、MCM2和CCNB1蛋白的表达水平,结果发现CDC6、CDK1、MCM2和CCNB1在NPC组织中表达显著上调,见图1。

Tab.2 Primer information表2 引物信息
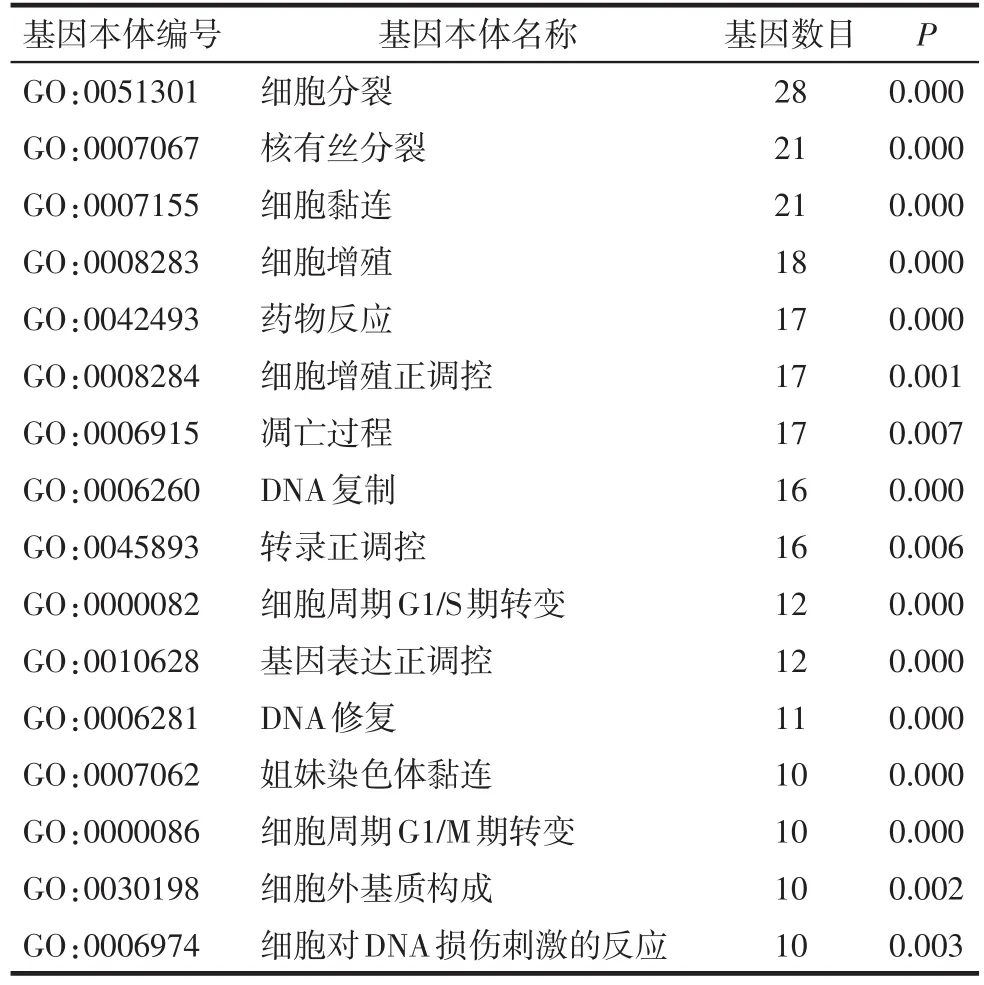
Tab.3 GO analysis of differential expression genes表3 差异表达基因的GO分析

Tab.4 KEGG signal pathway analysis of differential expression genes表4 差异表达基因的KEGG信号通路分析
3 讨论
病毒感染、遗传因素和环境因素均与NPC的发病过程有关。例如,EB病毒编码的LMP1蛋白可以通过抑制LKB1-AMPK通路促进NPC上皮细胞的恶性转化[6]。研究发现,基因LOC344967启动子区的单核苷酸多态性(32G/A)可以在其转录调控区域形成一个AP-1蛋白的结合位点,进而导致LOC344967的异常表达,并参与NPC的恶性转化进程[7]。此外,吸烟可以促进EB病毒的复制,并诱导转录因子Zta和Rta的异常表达,从而促进NPC的发生发展[8]。因此,在分子水平上研究NPC的发病机制,找到NPC的潜在治疗靶点尤为重要。
本研究在GEO数据库中筛选出2套关于NPC的基因芯片数据,通过生物信息学分析,找到了18个与细胞周期相关的基因在NPC组织中表达异常升高。这些基因中部分已经被广泛研究。例如,SKP2是F-box蛋白家族成员,该蛋白是cyclin A-CDK2 S期激酶的必要元件。SKP2在S期可以特异性地识别磷酸化的CDKN1B,并且可以与SKP1相互作用,参与细胞周期的调控[9-10]。Wang等[11]发现SKP2在NPC组织中表达显著升高,而且与不良预后相关。敲低SKP2的表达可以抑制细胞增殖,促进细胞衰老,抑制细胞干性和自我更新能力。Feng等[12]发现,用姜黄素处理NPC细胞系CNE1和CNE2,可以通过上调miR-7的表达,进而抑制其靶蛋白SKP2,并最终促进NPC细胞周期停滞,抑制细胞增殖、迁移和侵袭,促进细胞凋亡。CHEK1基因编码的蛋白属于Ser/Thr蛋白激酶家族,该蛋白可以整合来自ATM和ATR(涉及DNA损伤反应的两种细胞周期蛋白)的信号,参与DNA损伤引起的细胞周期停滞。此外,CHEK1还可以通过诱导CDC25A蛋白磷酸酶的磷酸化,参与双链DNA断裂引起的细胞周期延滞[13]。Liu等[14]发现,用EA6(一种草药提取物)处理NPC细胞系CNE1,可以使其细胞周期停滞在G2/M期。这种EA6诱导的细胞周期停滞作用可以在CHEK1敲低后被逆转,说明CHEK1可能是EA6抑制NPC细胞增殖的一个新的分子靶标。Mak等[15]报道,用CHEK1的小分子抑制剂(AZD7762)和WEE1的小分子抑制剂(MK-1775)同时处理NPC细胞,可以诱导NPC细胞的有丝分裂障碍,进一步说明CHEK1可能是NPC治疗的一个潜在治疗靶点。CDK4基因编码的蛋白属于Ser/Thr蛋白激酶家族,是蛋白激酶复合物的催化亚单位。CDK4的活性由调节亚基D型细胞周期蛋白和CDK抑制剂p16(INK4a)调控,而且CDK4的生物学活性仅局限于G1/S期,对细胞周期G1期进展至关重要[16]。Chen等[17]注意到CDK4可以通过破坏细胞周期来调控肿瘤的进程,而且CDK4的高表达是NPC不良预后的潜在标志物。Jiang等[18]注意到CDK4蛋白可以同时在细胞核与细胞浆中表达,而CDK4的核表达水平越高的患者(尤其是T1~2期、N2~3期以及临床分期为Ⅲ期或Ⅳ期的NPC患者),其生存期越短。此外,抑制CDK4在NPC细胞中的表达可以观察到癌细胞的生长和细胞周期进程受到抑制,与此同时,NPC细胞中CCND1、CDK6和E2F1的表达受到抑制,p21的表达上调[19]。
Tab.5 Real-time PCR analysis of mRNA expression levels of 18 genes in two kinds of tissues表5 Real-time PCR检测18个基因在2种组织中的mRNA表达水平 (n=5,±s)
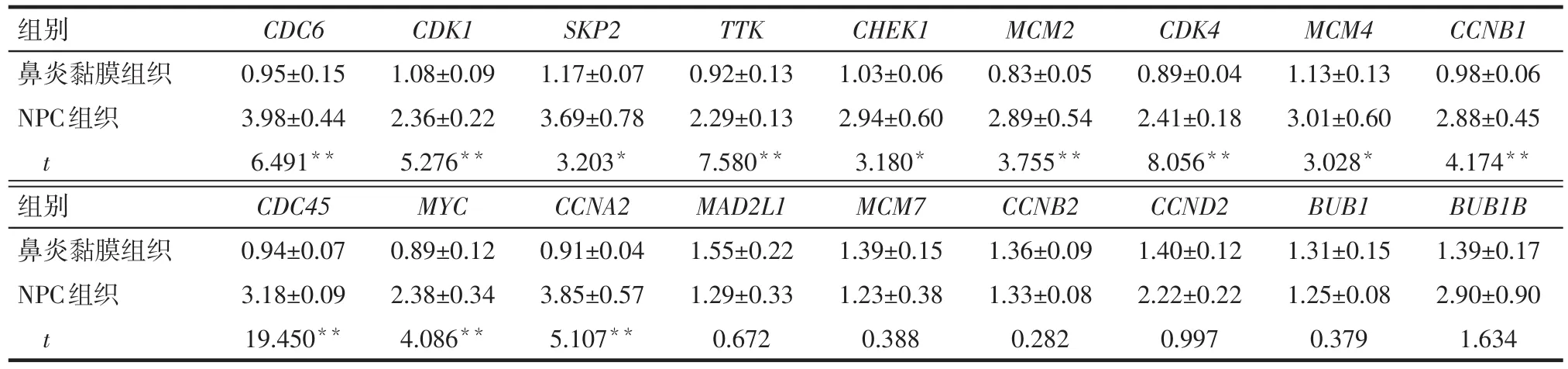
Tab.5 Real-time PCR analysis of mRNA expression levels of 18 genes in two kinds of tissues表5 Real-time PCR检测18个基因在2种组织中的mRNA表达水平 (n=5,±s)
*P<0.05,**P<0.01
TTK 0.92±0.13 2.29±0.13 7.580**1.55±0.22 1.29±0.33 0.672组别鼻炎黏膜组织NPC组织t鼻炎黏膜组织NPC组织t CDC6 0.95±0.15 3.98±0.44 6.491**0.94±0.07 3.18±0.09 19.450**CDK1 1.08±0.09 2.36±0.22 5.276**0.89±0.12 2.38±0.34 4.086**SKP2 1.17±0.07 3.69±0.78 3.203*0.91±0.04 3.85±0.57 5.107**CHEK1 1.03±0.06 2.94±0.60 3.180*1.39±0.15 1.23±0.38 0.388 MCM2 0.83±0.05 2.89±0.54 3.755**1.36±0.09 1.33±0.08 0.282 CDK4 0.89±0.04 2.41±0.18 8.056**1.40±0.12 2.22±0.22 0.997 MCM4 1.13±0.13 3.01±0.60 3.028*1.31±0.15 1.25±0.08 0.379 CCNB1 0.98±0.06 2.88±0.45 4.174**1.39±0.17 2.90±0.90 1.634
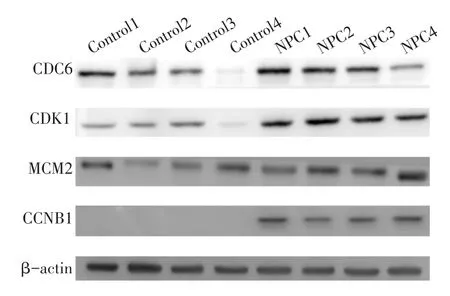
Fig.1 Western blot analysis of protein expression levels of CDC6,CDK1,MCM2 and CCNB1 in two kinds of tissues图1 Western blot检测NPC组织和鼻炎黏膜组织中CDC6、CDK1、MCM2和CCNB1蛋白的表达水平
为了更进一步研究这些基因与NPC发病机制的关系,笔者利用real-time PCR在mRNA水平上检测18个细胞周期相关基因在NPC组织中与鼻炎黏膜组织中的表达,结果显示CDC6、CDK1、SKP2、TTK、CHEK1、MCM2、CDK4、MCM4、CCNB1、CDC45、MYC、CCNA2的表达水平在NPC组织中显著上调。本研究在芯片和real-timePCR中同样观察到SKP2、CHEK1和CDK4这3个基因在NPC组织中的高表达,与前述研究一致[11,15,17],说明本研究数据解读和定量PCR的可靠性。由于SKP2[11]、TTK[27569188]、CHEK1[15]、CDK4[17]、MCM4[25973099]、CDC45[23584157]、MYC[28586063]、CCNA2[17689134]等基因已经被广泛研究,最终笔者选取CDC6、CDK1、MCM2和CCNB1作为研究对象,进一步利用Western blot在蛋白水平上检测其在NPC组织中与对照鼻炎黏膜组织中的表达,结果发现,CDC6、CDK1、MCM2和CCNB1蛋白在NPC组织中均有不同程度的表达上调,提示这4个基因可能是NPC发生发展的潜在致病因子或治疗靶点。
[1]LeeAWM,NgWT,ChanYH,etal.Thebattleagainst nasopharyngeal cancer[J].Radiother Oncol,2012,104(3):272-278.doi:10.1016/j.radonc.2012.08.001.
[2]Cao SM,Simons MJ,Qian CN.The prevalence and prevention of nasopharyngeal carcinoma in China[J].Chin J Cancer,2011,30(2):114.
[3]Petersson F.Nasopharyngeal carcinoma:a review[J].Semin Diagn Pathol,2015,32(1):54-73.doi:10.1053/j.semdp.2015.02.021.
[4]Edge SB,Compton CC.The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J].Ann Surg Oncol,2010,17(6):1471-1474.doi:10.1245/s10434-010-0985-4.
[5]Tsang J,Lee VHF,Kwong DLW.Novel therapy for nasopharyngeal carcinoma-Where are we[J].Oral Oncol,2014,50(9):798-801.doi:10.1016/j.oraloncology.2014.01.002.
[6]Lo AKF,Lo KW,Ko CW,et al.Inhibition of the LKB1-AMPK pathway by the Epstein-Barr virus-encoded LMP1 promotes proliferation and transformation of human nasopharyngeal epithelial cells[J].J Pathol,2013,230(3):336-346.doi:10.1002/path.4201.
[7]Jiang RC,Qin HD,Zeng MS,et al.A functional variant in the transcriptional regulatory region of gene LOC344967 cosegregates with disease phenotype in familial nasopharyngeal carcinoma[J].Cancer Res,2006,66(2):693-700.doi:10.1158/0008-5472.CAN-05-2166.
[8]Xu FH,Xiong D,Xu YF,et al.An epidemiological and molecular study of the relationship between smoking,risk of nasopharyngeal carcinoma,and Epstein-Barr virus activation[J].J Natl Cancer Inst,2012,104(18):1396-1410.doi:10.1093/jnci/djs320.
[9]Gstaiger M,Jordan R,Lim M,et al.Skp2 is oncogenic and overexpressed in human cancers[J].Proc Natl Acad Sci USA,2001,98(9):5043-5048.doi:10.1073/pnas.081474898.
[10]Carrano AC,Pagano M.Role of the F-box protein Skp2 in adhesion-dependent cell cycle progression[J].J Cell Biol,2001,153(7):1381-1390.
[11]Wang J,Huang Y,Guan Z,et al.E3-ligase Skp2 predicts poor prognosis and maintains cancer stem cell pool in nasopharyngeal carcinoma[J].Oncotarget,2014,5(14):5591.doi:10.18632/oncotarget.2149.
[12]Feng S,Wang Y,Zhang R,et al.Curcumin exerts its antitumor activity through regulation of miR-7/Skp2/p21 in nasopharyngeal carcinoma cells[J].Onco Targets Ther,2017,10:2377.doi:10.2147/OTT.S130055.
[13]Zhang Y,Hunter T.Roles of Chk1 in cell biology and cancer therapy[J].Int J Cancer,2014,134(5):1013-1023.doi:10.1002/ijc.28226.
[14]Liu M,Wang W,Li X,et al.Wedelia chinensis inhibits nasopharyngeal carcinoma CNE-1 cell growth by inducing G2/M arrest in a Chk1-dependent pathway[J].Am J Chin Med,2013,41(5):1153-1168.doi:10.1142/S0192415X1350078X.
[15]Mak JPY,Man WY,Chow JPH,et al.Pharmacological inactivation of CHK1 and WEE1 induces mitotic catastrophe in nasopharyngeal carcinoma cells[J].Oncotarget,2015,6(25):21074-21084.doi:10.18632/oncotarget.4020.
[16]Ingham M,Schwartz GK.Biology of neoplasia:cell-cycle therapeutics come of age[J].J Clin Oncol,2017,35(25):2949-2959.doi:10.1200/JCO.2016.69.0032.
[17]Chen TJ,Lee SW,Lin LC,et al.Cyclin-dependent kinase 4 overexpression is mostly independent of gene amplification and constitutes an independent prognosticator for nasopharyngeal carcinoma[J].Tumor Biology,2014,35(7):7209-7216.doi:10.1007/s13277-014-1884-2.
[18]Jiang Q,Mai C,Yang H,et al.Nuclear expression of CDK4 correlates with disease progression and poor prognosis in human nasopharyngeal carcinoma[J].Histopathology,2014,64(5):722-730.doi:10.1111/his.12319.
[19]Liu Z,Long X,Chao C,et al.Knocking down CDK4 mediates the elevation of let-7c suppressing cell growth in nasopharyngeal carcinoma[J].BMC Cancer,2014,14(1):274.doi:10.1186/1471-2407-14-274.
