机械加载对高脂饮食诱导的肥胖和非酒精性脂肪肝的治疗作用
2018-07-04谭念李心乐翟丽东刘大全张平
谭念,李心乐,翟丽东,刘大全,张平
肥胖是由多种因素引起的能量和代谢失衡性慢性疾病,以体内脂肪沉积异常过多为特点,并伴有冠心病、高血压、2型糖尿病、高脂血症和非酒精性脂肪肝(NAFLD)等一系列全身性疾病[1]。肝脏脂肪变性是NAFLD的早期症状,其特点是肝脏脂质过多积累[2]。目前对于肥胖和脂肪肝尚无特异性的药物治疗[3]。机械加载是一种脉冲式关节加载,该方法以一定频率的温和动态加载力作用于膝关节等滑膜关节,进行机械刺激,通过作用于骨干的微小原位机械应力引起全身的相关合成代谢反应。笔者早期的研究表明,机械加载能够预防骨关节炎中的组织退化、减少股骨头坏死后的骨质流失以及促进骨折愈合[4-5]。迄今为止,机械加载对肥胖和脂肪肝的作用尚不清楚。因此,本研究通过建立高脂饮食诱导肥胖和脂肪肝的动物模型,探讨机械加载是否可改善肥胖和肝脂肪变性,并从内质网应激的角度探讨其可能的病理机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄SPF级雌性C57BL/6小鼠30只,体质量约18 g,购自解放军军事医学科学院实验动物中心,实验所用饲料购自北京华阜康生物科技有限公司,高脂饲料含脂量为60%。实验动物的饲养与管理过程均严格遵守天津医科大学实验动物管理规定,本研究经天津医科大学伦理委员会批准。
1.1.2 主要试剂 油红O染色试剂盒购于Sigma公司,转录激活因子4(activating transcription factor 4,ATF4)抗体、真核启动因子2α(eukaryotic initiation factor 2α,eIF2α)抗体和真核启动因子2α磷酸化(eukaryotic promoter2α phosphorylation,p-eIF2α)抗体购自美国Cell Signaling Technology公司。
1.2 方法
1.2.1 动物分组 采用随机数字表法将动物分成3组,正常对照(NC)组、高脂饮食(HF)组和高脂饮食机械加载治疗(HF+L)组,每组10只。在实验起始阶段,各组动物体质量没有明显差异。NC组给予正常饮食,HF和HF+L组给予高脂饮食,持续饮食诱导12周。整个实验过程中保证小鼠充足的食水,小鼠自由进食、进水。室温22~25℃,相对湿度约50%,明暗各12 h的照明条件。
1.2.2 机械加载 高脂诱导6周后,HF+L组小鼠经1.5%异氟烷麻醉后,采用自制的小动物关节加载治疗仪进行治疗。将小鼠膝关节外侧、内侧置于加载杆和定子之间,松紧应适宜,太紧会影响血流供应,以能触及到小鼠踝关节动脉跳动为标准(图1)。加载力为1 N,加载频率为10 Hz,每天加载6 min,每侧膝关节 3 min,每周连续加载5 d[6],连续加载6周。小鼠加载治疗期间,HF+L组持续高脂喂养,直至实验结束。NC组和HF组接受假机械加载治疗,即小鼠给予麻醉后,同样将膝关节置于加载仪,但不接受任何机械刺激。
1.2.3 收集动物体质量、脂肪含量等数据 每周固定时间用电子称(精密度0.01 g)测量并记录小鼠体质量,每3天统计1次小鼠摄食量。处死动物前12 h,小鼠禁食不禁水,取血测量小鼠空腹血糖。动物处死后,分离小鼠肝脏,称湿质量并记录。一部分肝脏固定于4%多聚甲醛,用于组织形态学分析;一部分肝脏用于Western blot分析。同时,收集小鼠腹股沟脂肪、子宫周脂肪、肾周脂肪和肠系膜脂肪,称湿质量并记录。
1.2.4 体成分分析 小鼠经1.5%异氟烷面罩吸入麻醉小鼠,测量体质量、体长(鼻尖至肛门),将所得数据输入体成分分析仪,按要求将探针刺入小鼠皮下(图2)。红色探针置于鼻尖处,黄色探针置于两耳连线中点处,蓝色探针置于肛门上方处,黑色探针置于尾巴距离蓝色探针1 cm处,然后开始测量并记录体脂含量。
1.2.5 组织形态学观测 小鼠新鲜肝脏经4%多聚甲醛固定48 h后,部分肝脏组织经蔗糖梯度脱水后进行冰冻切片,切片厚度8 μm,选取同一位置的切片进行油红O染色,光镜下观察肝脂肪变性程度;部分肝脏组织经乙醇梯度脱水、石蜡包埋后进行切片,切片厚度5 μm,同样选取同一位置的切片进行常规HE染色,中性树胶封片,光镜下观察3组肝组织切片的病理改变。每组选取7个样本切片,每个切片选择5个镜下视野进行统计。
1.2.6 Western blot分析 每组分别取3个肝脏标本,称取小鼠肝脏50 mg,冰上剪碎后置于研磨管中,加含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液0.5 mL,冰上裂解20 min后研磨成匀浆,14 000×g离心15 min,提取总蛋白,测量蛋白浓度。上样总蛋白浓度20 μg,加5×上样缓冲液,100℃变性5 min,采用10%分离胶进行SDS-PAGE电泳,电泳后将蛋白转至PVDF膜。再使用5%脱脂奶粉封闭2 h,洗膜后,一抗4℃孵育过夜,1×TBST清洗3次,二抗室温孵育2 h,化学发光、X线胶片曝光、显影和定影后用凝胶成像系统检测相关蛋白的表达。
1.3 统计学方法 采用SPSS 19.0统计软件进行分析,计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析(ANOVA),组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 机械加载对高脂饮食诱导的肥胖小鼠的治疗作用 实验期间,3组小鼠摄食量无明显差异。与NC组小鼠相比,HF组小鼠体型较大,治疗后HF+L组与HF组相比体型较小,见图3。高脂喂养2周后,与NC组相比,HF组小鼠体质量明显增加(P<0.05),6周后体质量持续增长(均P<0.05)。机械加载治疗2周后(第8周),HF+L组小鼠体质量较HF组显著降低,但仍然比NC组体质量高,治疗3周后体质量趋于平稳,差异均有统计学意义(P<0.05),见表1。
Tab.1 The body weight changes throughout the experiment in three groups of mice表1 整个实验过程中3组小鼠的体质量变化(n=10,g,±s)

Tab.1 The body weight changes throughout the experiment in three groups of mice表1 整个实验过程中3组小鼠的体质量变化(n=10,g,±s)
*P<0.05,**P<0.01;a与NC组比较,b与HF组比较,P<0.05;表2~4同
组别NC组HF组HF+L组F第2周18.98±0.27 19.86±0.22a 20.52±0.28a 6.692**第4周20.83±0.49 22.59±0.28a 22.60±0.45a 4.770*第6周20.93±0.37 24.74±0.54a 24.90±0.70a 9.898**NC组HF组HF+L组F 21.20±0.28 27.98±0.81a 25.97±0.40ab 24.600**22.53±0.55 30.43±0.89a 27.21±0.99ab 14.900**22.67±0.53 32.05±0.99a 27.36±0.98ab 19.800**
2.2 机械加载的降脂作用 体成分分析结果表明,与NC组相比,高脂饮食导致HF组小鼠全身体脂含量增加。机械加载干预后,HF+L组较HF组体脂含量降低,但仍高于NC组体脂含量,差异有统计学意义(P<0.05)。长期高脂饮食导致HF组空腹血糖高于NC组(P<0.05),而HF+L组血糖明显低于HF组(P<0.05),并且恢复到NC组血糖水平,见表2。
Tab.2 Comparison of body fat content,fasting blood glucose and hepatic adipocyte number between three groups of mice表2 小鼠体脂含量、空腹血糖和肝脏脂肪细胞数目比较(±s)
Tab.2 Comparison of body fat content,fasting blood glucose and hepatic adipocyte number between three groups of mice表2 小鼠体脂含量、空腹血糖和肝脏脂肪细胞数目比较(±s)
组别NC组HF组HF+L组F体脂含量(n=10,%)35.57±2.28 53.39±1.21a 47.75±1.24ab 31.760**血糖(n=10,mmol/L)4.22±0.26 9.52±0.85a 4.54±0.39b 27.940**肝脏脂肪细胞数目(n=7,个)0 60.58±4.21a 9.90±1.64ab 71.650**
2.3 机械加载对不同部位脂肪组织的作用 与NC组相比,HF组肾周脂肪、子宫周脂肪、肠系膜脂肪、腹股沟脂肪均增加(均P<0.05)。治疗干预后,HF+L组各部位脂肪质量较HF组显著降低,但仍高于NC组(均P<0.05),见表3。
Tab.3 The comparison of adipose tissue mass between different tissues表3 各部位脂肪组织质量的比较(n=10,g,±s)
Tab.3 The comparison of adipose tissue mass between different tissues表3 各部位脂肪组织质量的比较(n=10,g,±s)
组别NC组HF组HF+L组F肾周脂肪0.13±0.01 0.93±0.13a 0.58±0.10ab 11.520**子宫周脂肪0.29±0.01 1.49±0.18a 0.98±0.15ab 11.930**腹股沟脂肪0.24±0.01 1.41±0.18a 0.91±0.10ab 15.110**肠系膜脂肪0.22±0.02 0.57±0.06a 0.41±0.03ab 13.610**
2.4 机械加载对肝脏组织中脂肪细胞的作用 与NC组相比,HF组肝脏发生脂肪变性,肝脏体积增大,颜色轻度发黄,而HF+L组肝脏体积较HF组变小,肝脏颜色红润,见图4。肝脏组织HE染色显示,NC组小鼠肝脏组织肝索结构正常,肝细胞大小均匀,细胞核圆,胞质丰富;HF组肝索结构遭到破坏,脂肪细胞导致肝细胞排列紊乱,而HF+L组肝索结构较HF组规则,肝细胞核圆;与NC组相比较,HF组肝脏组织出现大量形态规则的白色空泡样脂肪细胞(图5黑色箭头所示),而HF+L组脂肪细胞较HF组明显减少。油红O染色结果显示,HF组肝脏组织出现大量红色着染的脂肪细胞(图6白色箭头所示),HF+L组几乎没有红色着染。将脂肪细胞量化后结果表明,HF组脂肪细胞较NC组明显增多,HF+L组脂肪细胞较HF组显著减少,但与NC组相比,仍然有一定数量的脂肪细胞(P<0.05),见表2。
2.5 机械加载对肝脏组织中p-eIF2α和ATF4表达的影响 肝脏组织蛋白检测分析表明,与NC组相比,HF组内质网应激相关蛋白p-eIF2α、eIF2α和ATF4的表达显著升高,而HF+L组较HF组明显降低(均P<0.05),与NC组相比差异无统计学意义,见表4、图7。
Tab.4 The marker proteins of endoplasmic reticulum stress detected by Western blot assay in three groups表4 Western blot检测各组内质网应激性标志蛋白的表达(n=3,±s)

Tab.4 The marker proteins of endoplasmic reticulum stress detected by Western blot assay in three groups表4 Western blot检测各组内质网应激性标志蛋白的表达(n=3,±s)
组别NC组HF组HF+L组F p-eIF2α/eIF2α 0.81±0.08 1.39±0.12a 0.87±0.05b 11.770**ATF4 0.73±0.04 1.14±0.07a 0.83±0.05b 13.360**

Fig.7 The marker proteins of endoplasmic reticulum stress detected by Western blot assay in three groups图7 Western blot检测3组内质网应激标记性蛋白的表达
3 讨论
3.1 机械加载治疗对体质量、体脂的作用 高热量食物的摄入和缺乏运动锻炼是导致肥胖的主要原因,而机体对于过剩的能量最初始的反应是将多余的能量储存于脂肪细胞[7]。尽管能量可以以此种形式储存于体内,但是脂肪组织的过度堆积会成为导致代谢性疾病的主要高危因素。本课题组通过长期高脂饮食诱导小鼠建立肥胖动物模型,6周高脂饮食诱导后,HF组小鼠体质量显著高于NC组,各部位脂肪组织也显著增加。运动锻炼被认为是减轻体质量最有效的治疗方法,同时可以提高心肺功能和整体生活质量[8]。但一些有基础疾病的老年人或身体残疾者难以进行运动锻炼,并且过度的运动可能会有肌肉损伤和骨折的风险。因此,本研究探讨了膝关节加载对肥胖的影响,结果提示膝关节加载治疗通过降低体质量和全身体脂含量,有效缓解了高脂饮食导致的肥胖的发生发展。这些结果表明,膝关节加载可以作为一种新的物理康复理疗方式,改善肥胖相关的脂质代谢异常。
3.2 机械加载对肥胖和脂肪肝的疗效 NAFLD是以肝脏脂质沉积和肝细胞脂肪变性为基本特征的一类疾病,是肥胖最严重的并发症之一[9]。肥胖和NAFLD之间关系密切,据报道约90%的肥胖患者伴有NAFLD,其严重程度与肥胖的程度成正比[10]。作为体内参与代谢的一个重要器官,肝脏对超重或肥胖极其敏感,体内脂肪的减少会导致肝脏中的脂滴减少和肝功能指数升高。研究表明内脏脂肪增加会增加患脂肪肝的风险,并且两者之间的关系呈正相关[11-12],本研究中,高脂导致了内脏脂肪(肾周脂肪、肠系膜脂肪和子宫周脂肪)的显著增加,而机械加载治疗有效减少了内脏脂肪的堆积。肝脏组织学分析结果也表明,长期高脂饮食导致肝脏组织内脂滴异常沉积。反之,膝关节加载干预治疗通过减少肝内脂肪沉积而缓解了NAFLD的发生发展。这些结果表明膝关节加载改善了高脂饮食导致的肝脂肪变性,为治疗肝脏脂质代谢异常提供了新的策略。
3.3 机械加载治疗脂肪肝中内质网应激的作用机制 很多研究表明内质网应激在肥胖以及NAFLD发展中起着至关重要的作用[13-15],内质网应激不仅是肝脏脂肪堆积的结果,也是造成这种病理表现的原因。在脂肪肝中,脂肪生成过多和脂肪沉积异常会导致慢性内质网应激[13]。肝脏是葡萄糖和脂质代谢的主要场所,内质网应激诱导的非折叠蛋白反应通路激活又是肝糖元和脂质代谢的重要调节通路[16]。同时,本研究结果也表明长期高脂饮食导致血糖异常升高,机械加载能够有效降低异常升高的血糖,并使其控制在正常范围内。为了探讨膝关节加载是否通过影响肝脏内质网应激而起到了这一系列的治疗作用,本研究检测了与内质网应激相关的PERK-ATF4轴蛋白水平的表达,结果显示在HF组小鼠p-eIF2α和ATF4蛋白表达水平升高,说明长期高脂饮食导致了慢性内质网应激。然而,在6周机械加载治疗后,这些蛋白表达水平显著降低。以上结果表明膝关节加载对肥胖和非酒精性脂肪肝的治疗作用可能与内质网应激有关。
(图1~6见插页)

Fig.2 The fixation of the surgical aspirator图2 吸引器的固定

Fig.3 Preoperative brain CT of case1图3 病例1术前头部CT
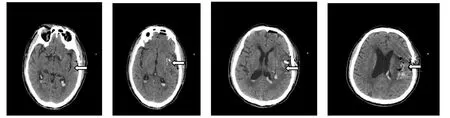
Fig.4 The postoperative brain CT 6 h after operation of case 1图4 病例1手术后6 h复查头部CT
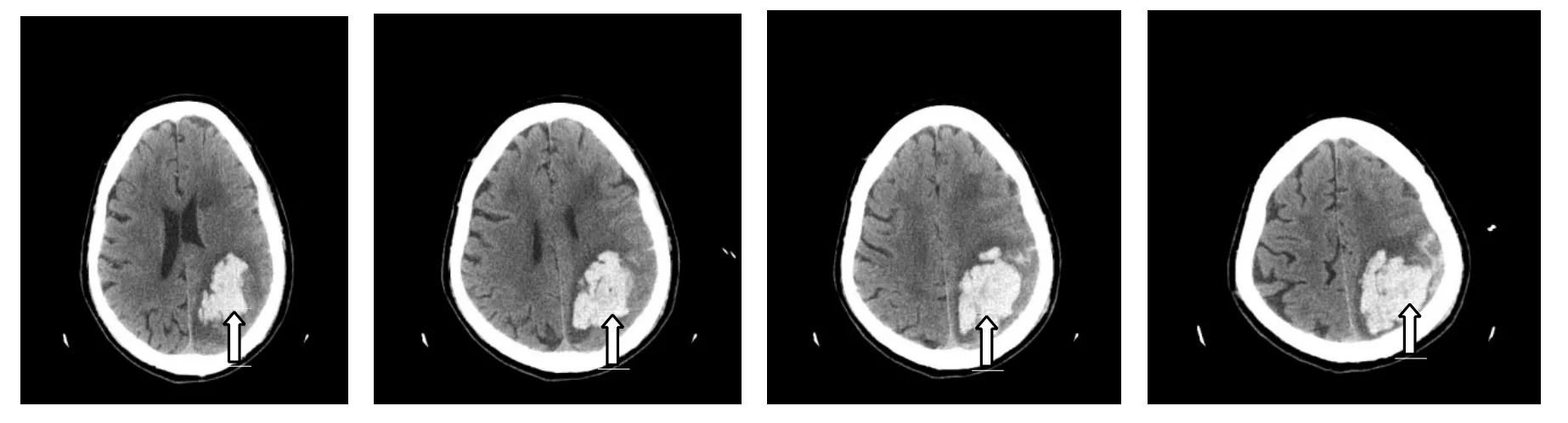
Fig.5 Preoperative brain CT of case 2图5 病例2术前头部CT

Fig.6 The postoperative brain CT 6 h after operation of case 2图6 病例2手术后6 h复查头部CT
[1]Huang CC,Tseng TL,Huang WC,et al.Whole-body vibration training effect on physical performance and obesity in mice[J].Int J Med Sci,2014,11(12):1218-1227.doi:10.7150/ijms.9975.
[2]Setiawan VW,Stram DO,Porcel J,et al.Prevalence of chronic liver disease and cirrhosis by underlying cause in understudied ethnic groups:The multiethnic cohort[J].Hepatology,2016,64(6):1969-1977.doi:10.1002/hep.28677.
[3]Lomonaco R,Sunny NE,Bril F,et al.Nonalcoholic fatty liver disease:current issues and novel treatment approaches[J].Drugs,2013,73(1):1-14.doi:10.1007/s40265-012-0004-0.
[4]Li XL,Yang S,Liu DQ,et al.Knee loading inhibits osteoclast lineage in a mouse model of osteoarthritis[J].Sci Rep,2016,6:24668.doi:10.1038/srep24668.
[5]Liu DQ,Li XL,Li J,et al.Knee loading protects against osteonecrosis of the femoral head by enhancing vessel remodeling and bone healing[J].Bone,2015,81:620-631.doi:10.1016/j.bone.2015.09.012.
[6]Sun D,Brodt MD,Zannit HM,et al.Evaluation of loading parameters for murine axial tibial loading:Stimulating cortical bone formation while reducing loading duration[J].J Orthop Res,2018,36(2):682-691.doi:10.1002/jor.23727.
[7]Rosen ED,Spiegelman BM.Adipocytes as regulators of energy balance and glucose homeostasis[J].Nature,2006,444(7121):847-853.doi:10.1038/nature05483.
[8]Sarzynski MA,Loos RJ,Lucia A,et al.Advances in exercise,fitness,and performance genomics in 2015[J].Med Sci Sports Exerc,2016,48(10):1906-1916.doi:10.1249/MSS.0000000000000982.
[9]Das MK,Bhatia V,Sibal A,et al.Prevalence of nonalcoholic fatty liverdisease in normal-weight and overweight preadolescent children in Haryana,India[J].Indian Pediatr,2017,54(12):1012-1016.
[10]Rong Y,Chun-Yan N,Hong-Xin Z,et al.Association of adolescent obesity with nonalcoholic fatty liver disease and related risk factors in Xi’an,China[J].Ann Hepatol,2017,17(1):85-91.doi:10.5604/01.3001.0010.7538.
[11]Kim D,Chung GE,Kwak MS,et al.Body fat distribution and risk of incident and regressed nonalcoholic fatty liver disease[J].Clin Gastroenterol Hepatol,2016,14(1):132-138.doi:10.1016/j.cgh.2015.07.024.
[12]Yu SJ,Kim W,Kim D,et al.Visceral obesity predicts significant fibrosis in patients with nonalcoholic fatty liver disease[J].Medicine(Baltimore),2015,94(48):e2159.doi:10.1097/MD.0000000000002159.
[13]Baiceanu A,Mesdom P,Lagouge M,et al.Endoplasmic reticulum proteostasis in hepatic steatosis[J].Nat Rev Endocrinol,2016,12(12):710-722.doi:10.1038/nrendo.2016.124.
[14]Jiang S,Yan C,Fang QC,et al.Fibroblast growth factor 21 is regulated by the IRE1α-XBP1 branch of the unfolded protein response and counteracts endoplasmic reticulum stress-induced hepatic steatosis[J].J Biol Chem,2014,289(43):29751-29765.doi:10.1074/jbc.M114.565960.
[15]Zhang ZG,Li B,Meng XJ,et al.Berberine prevents progression from hepatic steatosis to steatohepatitis and fibrosis by reducing endoplasmic reticulum stress[J].Sci Rep,2016,6:20848.doi:10.1038/srep20848.
[16]Qiu X,Li J,Lv S,et al.HDAC5 integrates ER stress and fasting signals to regulate hepatic fatty acid oxidation[J].J Lipid Res,2018,59(2):330-338.doi:10.1194/jlr.M080382.
