三清山黄杉林区土壤耐性孢子对花旗松生长的影响
2018-07-04温祝桂朱小梅赵宝泉邢锦城丁海荣洪立洲
温祝桂 ,朱小梅 ,刘 冲 ,赵宝泉 ,邢锦城 ,丁海荣 ,董 静 ,洪立洲
(1.盐城工学院 江苏省海洋滩涂生物化学与生物技术重点建设实验室,江苏 盐城 224051;2.江苏沿海地区农业科学研究所,江苏 盐城 224002)
黄杉属Pseudotsuga现仅存不足10个种[1-3],以花旗松Pseudotsuga menziesii为模式种,依据地理分布可分为美洲组Americanae group和亚洲组Asiaticae group,间断分布于东亚和北美西部。黄杉属在中国主要有5个种,均为特有种[1],隶属国家Ⅱ级保护濒危树种,主要分布于我国秦岭以南的亚热带山区:湖南、湖北、云南、贵州、安徽、江西、广西、福建和台湾,其中短叶黄杉P.brevifolia为黄杉属在我国分布最南的物种。中国黄杉依据种类的不同,表现出垂直分布特性:东部的华东黄杉P.gaussenii、台湾黄杉P.wilsoniana、黄杉P.sinensis和最西部的澜沧黄杉P.forrestii[4],由于各种原因在不断地减少,甚至灭绝,其中,外生菌根系统的改变是导致濒危树种枯萎、濒临死亡的重要原因之一。
外生菌根(ECM),作为土壤真菌与宿主植株形成的互惠共生体结构,是树木生存、生长过程中所必须的[5],真菌从土壤中获得氮源以提供宿主,满足其生长需求。在生态环境中,宿主的一些生理生态变化有时会由与其共生的ECM真菌所决定 。形成ECM除了菌丝体以外,土壤孢子也是一个重要因素。作为真菌赖以繁殖的孢子库,可以在土壤中保持繁殖能力长达几年,数十年,甚至更长[6],是陆地生态系统的重要组成部分[7]。土壤孢子,在外界因素:如火灾、飓风、砍伐[8-9],甚至一些根类分泌的刺激信号[10](如黄酮类化学物质等)的刺激下,与宿主植株重新形成ECM。外源树种引种时,与其共生的先锋菌种,往往起着关键作用,它们量大、分布广泛且易与引种树木形成ECM,可以很好地改善宿主耐性,提高其适应新环境的能力[11-12]。
亲缘关系比较近的树种易形成相似的菌根群落结构,同时华东黄杉种子资源稀缺,基于这两点,在本实验设计中,以黄杉属模式树种花旗松代替华东黄杉进行孢子回接实验,同时对成功形成ECM结构的真菌进行了鉴定。初步分析花旗松与土壤耐性孢子形成的ECM群落结构,研究ECM的形成在宿主生长中所起的作用。这样的研究成果,可以让人更好地了解先锋菌种以及特异性共生真菌在黄杉幼苗定植、生长中表现出来的作用,同时为保护濒危黄杉,防止森林植被的衰退提供一定的理论依据。
1 材料与方法
1.1 土壤样品的采集
1.1.1 采样点
三清山是江西省国家4A级风景名胜区,位于江西北部(28°56′ N,118°04′ E),属亚热带湿润性季风气候。三清山的植被具有明显的垂直分带现象, 从低海拔到高海拔依次分布有常绿阔叶林、常绿针叶阔叶混交林、常绿针叶林、高山矮灌丛。国家重点保护植物的华东黄杉林区以杜鹃花科Ericaceae、松科Pinaceae、山茶科Theaceae、壳斗科Fagaceae、蔷薇科Rosaceae、樟科Lamraceae和冬青科Aquifoliaceae等种类为主[13]。
1.1.2 土壤样品的采集
选取研究的树种——黄杉,GPS定位,在距离根部约1 m处,小心除去表面腐叶等杂物,采集土壤样品(5 cm×5 cm×10 cm,长×宽×深度),置于自封袋中。同时,对周边优势树种进行统计。每隔至少10 m,选取另一个样点,共采集土壤样品25个。去除腐叶、根等杂质,将土样自然风干,以获得一定耐性的孢子[6,14]。
1.2 土壤理化性质分析
测定上述采集土壤的pH值、电导率(Cond)、阳离子交换(CEC)、有机质(OM)、全磷(p)、全钾(K)以及全氮(N),测定方法参见鲍士旦(1999)《土壤农化分析》。
1.3 幼苗准备
挑选饱满的花旗松种子,用30%的H2O2表面消毒20 min,再用去离子水冲洗,在湿润的干净纱布上室温萌发。取50 mL离心管,在底部和侧面同时开小洞,便于通气和多余水分的流出,底部塞脱脂棉,保持一定水分。加入灭菌基质(121 ℃,2 h,土∶沙∶蛭石=1∶1∶1),在离心管土样上移种萌发露白的花旗松种子,每管2粒。至于阳光房中培育,自然光照,温控25 ℃/20 ℃(早/晚)。适时淋浇去离子水,以保持一定的湿度(65%±10%相对空气湿度)。30 d后间苗,保留一株生长良好的花旗松幼苗。
1.4 孢子液接种
取风干土样,加入无菌去离子水,充分震荡后,取孢子悬浮液,淋浇于幼苗根部土壤。阳光房中继续培养,以便耐性孢子形成ECM体系。
1.5 样品收集
育苗回接8个月后,收苗。小心地将土壤与幼苗分开(尽量保证根系的完整性)。根系用流水冲洗干净,小心收集,用于ECM样品的收集与统计。体式显微镜下,根据形态学特征,挑取不同形态的新鲜的ECM根尖样,每种形态3个重复(不足,则全部取出)。ECM样品置于含有100 µL 2×CTAB 缓冲液的PCR离心管中,-30 ℃保存备用。幼苗分地上与地下两部分,烘干(80 ℃,72 h),称重。
1.6 分子鉴定
采用CTAB法[15]提取ECM样品的DNA,引物对 ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和 ITS4(5’-TCCTCCGCTTATTGATATGC-3’)进行PCR扩增,扩增产物直接测序,结果经过ATGC(GENETYX Corp., Tokyo, Japan)人工核对后提交GenBank。
1.7 数据分析
对菌种的频度(ECM真菌出现的土样数)进行统计。利用频度数据,在EstimateS 9.1(http://viceroy.eeb.uconn.edu/EstimateS)中进行Chao2和Jackknife2 (Jack2)评估,确定能与花旗松形成ECM结构的土壤耐性孢子种类。同时,利用SPSS 22.0 (IBM, Armonk, NY, USA),通过单因素方差分析(ANOVA),检测不同菌种(主要的几种)和侵染菌种数目对宿主生长的影响(LSD,P<0.05), 采用冗余分析(Redundancy Analysis,RDA)(PC-ORD ver.6)[16]方法,研究主要土壤理化性质对耐性孢子形成ECM群落结构的影响。
2 结果与分析
2.1 土壤理化性质
采集土样基本理化性质如表1所示,土壤呈酸性。

表1 三清山采集土壤主要理化性质Table 1 Chemical characteristics of soils collected from Sanqing mountain
2.2 菌种的统计
通过形态学特征,共获得ECM样品115 个,经过ITS序列的PCR扩增,RFLP检验及序列测定,共获得有效序列71个,菌种9种(见表2)。其中,最常见的菌种为须腹菌属的一个种(Rhizopogonspp.),占鉴定序列的71.8%,与21株幼苗形成ECM。其次为Meliniomycesspp.1和Tomentellaspp.,都达到了7.0%。而其余菌种都小于5%(见表1)。实验用25株花旗松幼苗中,22株(88.0%)幼苗成功地与孢子形成ECM体系,单一幼苗(即单一土壤样品)中可以形成1到3种ECM,但主要集中在形成1到2种上,占形成ECM苗的86.4%。
Chao2 (±SD)和Jack2 (±SD)评估结果显示在所采集土样中,形成ECM的菌种数可以达到(11±4)或是(15±2)种,菌种累积曲线在所采集的最大土壤样品数处,趋于平稳(见图1)。
2.3 菌种数量、种类对宿主生物量的影响
ECM的侵染可以促进宿主植物的生长,并且ECM种类与宿主植物生物量统计分析可以看出,植物根部的菌种数量与植物的生物量(干重)存在一定相关性(地上:y=-0.010x2+0.042x+0.047,R2=0.308,P<0.001;地下:y=-0.007x2+0.032x+0.048,R2= 0.225,P<0.001)。ECM,尤其是两种ECM的存在,可以有效促进宿主植物花旗松幼苗的生长(见图2 )。
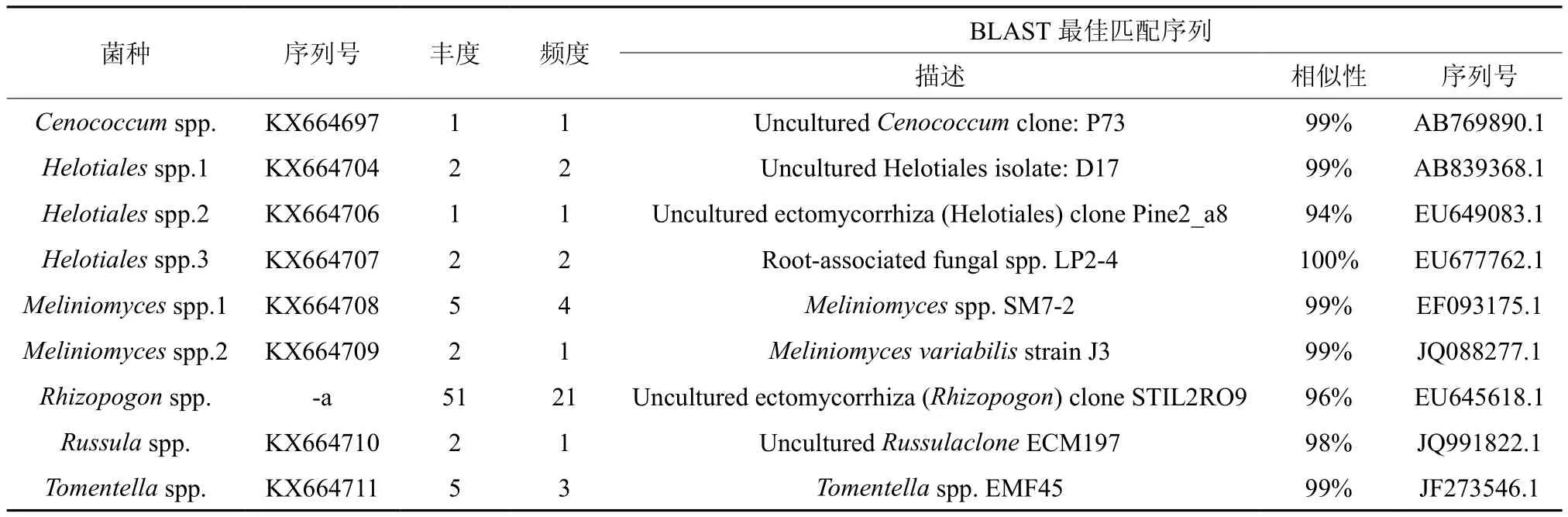
表2 温室培养中与花旗松幼苗共生菌根真菌的rDNA ITS序列BLAST的结果和物种的确定†Table 2 Summary of ITS rDNA BLAST results and species determinations for sequences of ectomycorrhizal fungi identified on P.menziesii seedlings in glasshouse experiment

图1 外生菌根(ECM)真菌评估种类及种类累计曲线Fig.1 Minimum species richness estimates and species accumulation curves of ectomycorrhzal (ECM)fungi
2.4 侵染率对幼苗的生长的影响
ECM的侵染,促进了幼苗的生长,其侵染率和花旗松幼苗的生物量(地上、地下部分干重)成正相关(y=0.054+0.145x,R2=0.404,P<0.001;y=0.058+0.097x,R2=0.188,P< 0.001),尤其是地上部,相关性显著。
2.5 主要菌种种类对宿主生物量的影响
与未成功侵染的幼苗比,ECM的存在显著提高了花旗松幼苗生物量,对于主要菌种,幼苗之间的地上部生物量、株高均存在显著性差异(见图4)。其中,Meliniomyces和Rhizopogon对幼苗生长影响最为显著。
2.6 土壤理化性质对耐性孢子群落结构的影响
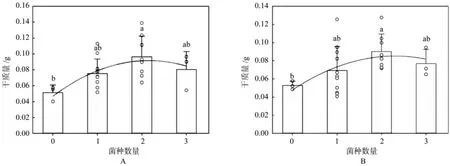
图2 侵染菌根种类与宿主生物量(A.地上部分;B.地下部分)相关性分析Fig.2 Linear regression to relate ectomycorrhizal colonizer richness to seedling biomass (A.Shoots; B.Roots)

图3 菌根侵染率与幼苗生物量(A.地上部分;B.地下部分)相关性分析Fig.3 Line correlation between mycorrhizal colonization rates and seedlings dry weight(A.Shoots; B.Roots)
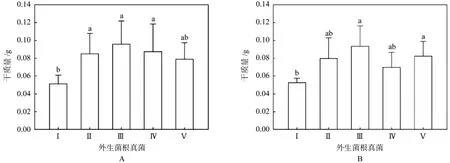
图4 主要菌根真菌种类对幼苗(A.地上部分;B.地下部分)生长的影响Fig.4 The effects of major ectomycorrhizal species on the growth (A.Shoots; B.Roots) of seedlings
RDA分析显示两个坐标轴的解释量分别只有19.3%和16.0%(见图5)。箭头线代表土壤理化性质(土壤因子),其长度表示某一土壤因子对菌种群落的影响大小。可见,在所测定土壤因子中,K、OM、Cond以及pH是影响ECM群落的主要因素。箭头线与排序轴之间的夹角反应了某一土壤理化性质与排序轴之间的相关性大小,K(r=0.521)、pH(r=0.469)与Axis2显著性相关,K(r=-0.430)、OM(r=-0.503)与Axis1显著性相关。

图5 土壤理化性质与ECM真菌RDA排序Fig.5 Redundancy Analysis (RDA) ordination of soil parameters and ectomycorrhizal fungal species
3 结论与讨论
华东黄杉是黄杉属在中国的一个特有濒危树种。而ECM结构体系的缺失可能是导致其枯萎、死亡的重要原因之一。然而,目前尚缺少中国黄杉林区土壤孢子库直接的研究报道,于是,在本实验研究中,利用了三清山黄杉林区采集的土壤,进行耐性孢子回接,以期了解濒危物种林区耐性孢子形成ECM结构情况,掌握ECM在宿主定植生长中起到的关键作用。
结果表明,温室环境下,形成ECM结构的菌种累积曲线在最大土壤样品数处趋于平稳,达到渐近线,甚至有向下的趋势,可见,本孢子回接实验获得的耐性孢子形成的ECM结构,基本可以反应土壤中所存在能与宿主形成ECM的耐性孢子群落。从ECM群落结构可见,少数菌种占有绝对优势,而大多数菌种相对稀少,尤其是先锋菌种(如:Rhizopogonspp.)最易与宿主幼苗形成共生结构,并占有绝对优势。在与黄杉属共生的菌根真菌的研究中,不仅在北美发现了Pseudotsuga-R.subg.Villosuli[17-18]这种特异性共生的结构,同时,在亚洲的日本黄杉、中国华东黄杉中,也发现了与其特异性共生的Rhizopogon菌种[15,19-20]。作为黄杉特异性共生的菌种Rhizopogonspp.,在成熟的黄杉林区相对少见[15,20],但在本孢子回接实验中,却是优势菌种(占鉴定序列的71.8%),可见,此菌种基本是以耐性孢子形式存在于土壤中,等待外部刺激来与宿主形成ECM[21-22]。先锋ECM真菌对宿主根系有较好地响应[23],易形成ECM体系,如:Rhizopogon、Laccaria、Hebeloma和Inocybe等[24],会以耐性孢子体的形式存在,等待外部的刺激来获得与宿主幼苗形成ECM[25-26]的机会。
Rhizopogonspp.在孢子群落中占优势地位,与宿主特异性共生,同时有效地促进宿主植物的生长。可见,在黄杉幼苗定植以及生长中,Rhizopogonspp.似乎是起到关键性作用的ECM真菌。笔者猜想,每一种濒危树种可能与一些特有的ECM真菌共生,并依赖于它们生存。尽管如此,仍没有充分的证据表明Rhizopogon菌种在黄杉林区的丰富度与稳定其生态系统、促进其定植生长之间存在某种特定关系。保护濒危物种,对维持生物多样性极其重要,它们往往建立了一个独特的森林生态系统,并维持着与其相关的物种多样性。
大量研究[5,27-30]表明,菌根真菌的侵染,可以有效地促进宿主植物的生长。ECM真菌是很多森林树种赖以定植、生存和生长的必要因素,与宿主之间互利共生:ECM真菌从宿主植物中获得C源,作为反馈,真菌为宿主提供N等矿质营养元素[5,29]。Kaewgrajang等[31]的研究发现,ECM真菌的侵染率和龙脑香幼苗的生物量(干重)成显著正相关。基于现有的研究结果同样显示,ECM真菌的侵染率、种类以及菌种数量,均对宿主植物花旗松幼苗的生长产生影响(参见结果部分)。显然,为了更好地了解ECM体系在生理学以及生态学方面可能表现出来的作用,就有必要深入探究ECM群落对宿主生长的作用机制。
ECM真菌群落结构很大程度上受到一些特定生物因素的影响,如:菌种本身的分布,孢子密度等[32]。此外,一些非生物因素,如土壤(土壤理化性质等)等也影响[33],或者说控制着某一地区的真菌群落[34]。本研究RDA分析结果显示:OM、K、Cond以及pH值对ECM群落结构的形成存在显著影响。但Axis1和2的因素解释量仅35.3%(分别为19.3%和 16.0%,图5),可见还有其它一些未被测定的土壤理化性质,如:重金属[35-36]等,土壤的质地[37]或其他非可控因素对ECM群落结构的形成同样起着重要作用。其次,一些生物因素,比如,群体之间的相互作用:真菌之间[38]、真菌与其他微生物之间[39]、植物之间[40]等,同样影响着耐性孢子形成的ECM群落结构。
由于ECM群落结构特性,可以被用来作为城市环境中植物的健康状况评估的指标。因此,在后续的研究工作中,有必要加深土壤理化性质、生物等环境因素共同作用对ECM群落结构影响机制的深入探讨,这对掌握林区ECM群落以及ECM在生态系统中表现出来的作用至关重要,是保护菌根生态系统的重要环节。同时,加强微生物技术的利用,筛选出有利菌种资源(细菌[41]、丛枝[28-29]与外生菌根真菌[5,15,31]),人为地控制某些可控因素,为菌根化提供更好的生存环境,可以更好地应用于濒危树种的保护与林业重建,改善生态环境。
[1]郑万钧,傅立国.中国植物志(第7卷)[M].北京:科学出版社, 1978: 95-106.
[2]Farjon A.World checklist and bibliography of conifers (second edition)[M].London:Royal Botanic Gardens, Kew, England,2001.
[3]Fu LK, Li N, Mill RR.Pseudotsuga[C]//In: Wu ZY, Raven PH(Eds), Flora of China, vol.4.Beijing and St.Louis:Science Press and Missouri Botanical Garden, 1999:33-37.
[4]李 楠.黄杉属植物地理学的研究[J].植物研究, 1993, 13(4):404-411.
[5]Smith SE, Read DJ.Mycorrhizal Symbiosis (3rd Edition)[M].Cambridge:Academic Press, UK, 2008.
[6]Bruns TD, Peay KG, Boynton PJ,et al.Inoculum potential ofRhizopogonspores increases with time over the first 4-yr of a 99-yr spore burial experiment[J].New Phytologist, 2009, 181(2):463-470.
[7]Baar J, Horton TR, Kretzer AM,et al.Mycorrhizal colonization ofPinus muricatafrom resistant propagules after stand-replacing wildfire[J].New Phytologist, 1999, 143: 409-418.
[8]Izzo AD, Meyer M, Trappe JM,et al.Hypogeous ectomycorrhizal fungal species on roots and in small mammal diet in a mixedconifer forest[J].Forest Science, 2005, 51:243-254.
[9]Grubisha LC, Bergemann SE, Bruns TD.Host islands within the California northern channel islands create fine- scale genetic structure in two sympatric species of the symbiotic ectomycorrhizal fungusRhizopogon[J].Molecular Ecology,2007, 16: 1811-1822.
[10]Kikuchi K, Matsushita N, Suzuki K,et al.Flavonoids induce germination of basidiospores of the ectomycorrhizal fungus Suillus bovinus[J].Mycorrhiza, 2007, 17: 563-570.
[11]Jumpponen A.Soil fungal community assembly in a primary successional glacier forefront ecosystem as inferred from rDNA sequence analyses[J].New Phytologist, 2003, 158:569-578.
[12]Nara K.Ectomycorrhizal networks and seedling establishment during early primary succession[J].New Phytologist, 2006,169:169-178.
[13]郭 微,沈如江,吴金火,等.江西三清山华东黄杉群落的组成及结构分析[J].植物资源与环境学报, 2007, 16(3):46-52.
[14]Rusca TA, Kennedy PG, Bruns TD.The effect of different pine hosts on the sampling of rhizopogon spore banks in five eastern Sierra Nevada forests[J].New Phytologist, 2006, 170: 551-560.
[15]温祝桂.中国黄杉(Pseudotsuga sinensis)菌根真菌群落结构研究及其特异性共生菌株的鉴定[D].南京: 南京农业大学,2014.
[16]McCune B, Mefford MJ.PC-ORD.Multivariate Analysis of Ecological Data.Version 6.MjM Software[M].Oregon:Gleneden Beach, USA, 2011.
[17]Massicotte HB, Molina R, Luoma DL,et al.Biology of the ectomycorrhizal genus Rhizopogon: II.Patterns of host-fungus specificity following spore inoculation of diverse hosts grown in monoculture and dual culture[J].New Phytologist,1994, 126:677-690.
[18]Molina R, Smith JE, McKay D,et al.Biology of the ectomycorrhizal genusRhizopogon.III.Influence of co-cultured conifer species on mycorrhizal specificity with the arbutoid hostsArctostaphylos uvaursiandArbutus menziesii[J].New Phytologist, 1997, 137: 519-528.
[19]Mujic AB, Hosaka K, Spatafora JW.Rhizopogon togasawarianaspp.nov., the first report ofRhizopogonassociated with an Asian species ofPseudotsuga[J].Mycologia,2014,106(1):105-112.
[20]Murata M, Kinoshita A, Nara K.Revisiting the host effect on ectomycorrhizal fungal communities: implications from hostfungal associations in relictPseudotsuga japonicaforests[J].Mycorrhiza ,2013,23(8):641-653.
[21]Taylor DL, Bruns TD.Community structure of ectomycorrhizal fungi in aPinus muricataforest: minimal overlap between the mature forest and resistant propagule communities[J].Molecular Ecology, 1999, 8: 1837-1850.
[22]Kjøller R, Bruns TD.Rhizopogonspore bank communities within and among California pine forests[J].Mycologia, 2003, 95: 603-613.
[23]Nara K.Spores of ectomycorrhizal fungi: ecological strategies for germination and dormancy[J].New Phytologist, 2009,181:245-248.
[24]Ishida TA, Nara K, Tanaka M,et al.Germination and infectivity of ectomycorrhizal fungal spores in relation to their ecological traits during primary succession[J].New Phytologist, 2008, 180:491- 500,
[25]Horton TR, Bruns TD.The molecular revolution in ectomycorrhizal ecology: peeking into the black-box[J].Molecular Ecology, 2001,10: 1855-1871.
[26]Jones MD, Durall DM, Cairney JWG.Ectomycorrhizal fungal communities in young forest stands regenerating after clearcut logging[J].New Phytologist, 2003, 157: 399-422.
[27]Näsholm T, Högberg P, Franklin O,et al.Are Ectomycorrhizal Fungi Alleviating or Aggravating Nitrogen Limitation of Tree Growth in Boreal Forests[J].New Phytologist, 2013, 198(1): 214-221.
[28]常双双,王承南,王 森,等.5种丛枝菌根真菌对君迁子幼苗光合生长的影响[J].经济林研究,2016,34(2): 79-85.
[29]姜清彬,仲崇禄,陈 羽,等.红菇菌根食用菌接种马尾松苗期的共生效应研究[J].中南林业科技大学学报, 2016, 36(8):6-9.
[30]马 坤,杨建军,李 璐,等.接种丛枝菌根真菌后干旱胁迫对木棉根区土壤和体内养分的影响[J].中南林业科技大学学报,2017,37(11):90-95,102.
[31]Kaewgrajang T, Sangwanit U, Iwase K,et al.Effects of ectomycorrhizal fungusAstraeus odoratusonDipterocarpus alatusseedlings[J].Journal of Tropical Forest Science, 2013,25(2): 200-205.
[32]Koide RT, Fernandez C, Petprakob K.General principles in the community ecology of ectomycorrhizal fungi[J].Annals of Forest Science, 2011, 68: 45-55.
[33]Hassan Sel D, Boon E, St-Arnaud M, Hijri M.Molecular biodiversity of arbuscular mycorrhizal fungi in trace metalpolluted soils[J].Molecular Ecology, 2011, 20: 3469-3483.
[34]Roy M, Rochet J, Manzi S,et al.What determinesAlnusassociated ectomycorrhizal community diversity and specificity?A comparison of host and habitat effects at a regional scale[J].New Phytologist, 2013, 198: 1228-1238.
[35]Huang J, Nara K, Lian C,et al.Ectomycorrhizal fungal communities associated with Masson pine (Pinus massonianaLamb.) in Pb-Zn mine sites of central south China[J].Mycorrhiza, 2012, 22: 589-602.
[36]Huang J, Nara K, Zong K,et al.Ectomycorrhizal fungal communities associated with Masson pine (Pinus massoniana)and white oak (Quercus fabri) in a manganese mining region in Hunan Province, China[J].Fungal Ecology, 2014, 9: 1-10.
[37]Lekberg Y, Koide RT, Rohr JR,et al.Role of niche restrictions and dispersal in the composition of arbuscular mycorrhizal fungal communities[J].Journal of Ecology, 2007, 95: 95-105.
[38]Tucker CM, Fukami T.Environmental variability counteracts priority effects to facilitate species coexistence: evidence from nectar microbes[J].Proceedings of the Royal Society B, 2013,281: 20132637.
[39]Fitter AH, Garbaye J.Interactions between mycorrhizal fungi and other soil organisms[J].Plant Soil, 1994, 159: 123-132.
[40]Davison J, Opik M, Daniell TJ,et al.Arbuscular mycorrhizal fungal communities in plant roots are not random assemblages[J].FEMS Microbiol Ecology, 2011, 78: 103-115.
[41]张晶晶,李建贵,郭艺鹏.新疆核桃根际土壤中解钾菌的分离筛选及鉴定[J].经济林研究,2016,34(2): 30-34.
