白蜡属优良种质资源亲缘关系的AFLP分析
2018-07-04燕丽萍吴德军王因花刘翠兰王开芳李庆华
燕丽萍 ,吴德军 ,王因花 ,刘翠兰 ,王开芳 ,吴 红 ,任 飞 ,李庆华
(1.山东省林业科学研究院,山东 济南 250014;2.山东省林木遗传改良重点实验室,山东 济南 250014;3.江苏农牧科技职业学院,江苏 泰州 225300)
白蜡属Fraxinus为木樨亚科Oleceae,全世界70余种,我国30多种,种质资源非常丰富,无论是实生苗还是栽培种质,均具有丰富的遗传多样性,这可能与其异化授粉的生物学特性有关,对其种质资源进行评价是育种研究工作的重要环节之一,但其种或品种的植物学分类存在争议[1-3]。传统的白蜡分类鉴别主要依靠翅果、花、芽、叶及花粉粒等形态学标记,以翅果和花性状的差异最为明显,其次是芽、叶缘锯齿和果实缺刻被作为分类的依据[4]。虽然形态表型标记研究简单直观且较适用,但有些不同种或品种间的形态表型特征极为相似,在种间交互难以区分,造成了白蜡属植物分类混淆问题,常出现同种多名称以及同名多品种的现象,导致白蜡命名上存在一些争议[5]。在白蜡种质资源的评价中,仅依靠单一的形态表型特征性状,通常不能准确的说明不同种或品系间的遗传差别和亲缘关系,因为形态表型性状极易受到环境气候的影响而发生变化,且同一树种随着地理位置的不同,产生连续性变异或高度可塑性,有些形态表型指标甚至受个体发育阶段的影响[6-7],这给种源间亲缘关系的确定带来困难。
随着现代分子生物学的迅速发展,分子标记技术能从DNA水平更能有效、准确的反映种质资源间的遗传变异及亲缘关系[8-9]。分子标记技术不受气候环境、发育阶段和植物组织的限制,仅用一个叶片、嫩芽或其它少量植物组织就可以从DNA水平上检测基因组的变异,获得精确的DNA指纹图谱,快速、有效地进行鉴定大量种或品种[10]。目前,已有十多种分子标记技术,其中,AFLP(扩增片段长度多态性 amplified fragment length polymorphism)分子标记技术结合了 RFLP和 RAPD 技术的特点,具有高效性、重复性好、多态性效率高和稳定性高等特点,已应用于基因定位、品种鉴定、遗传图谱、基因库构建、基因克隆等方面的研究[11-14]。在白蜡属植物仅对欧洲白蜡F.excelsior的核 DNA SSR、叶绿体 SSR、EST-SST 标记筛选分离,以及SSR标记在种群遗传分析与系统发生地理学方面进行了研究[15-17]。目前,尚未见到从分子水平上对白蜡属植物进行标记鉴定的报道。本研究采用AFLP分子标记技术对白蜡属部分种质资源进行研究,并探索种质间的遗传差异及其亲缘关系,为白蜡属植物鉴别分类、早期鉴定、资源保护提供分子证据,也为杂交育种的亲本选择及品种改良提供科学依据。
1 材料与方法
1.1 试验材料
试验材料为2013年在新疆、黑龙江、湖南、陕西、甘肃、北京、山东等8个省市自治区收集的资源,于2014年春天嫁接保存山东省林业科学研究院寿光试验站,绒毛白蜡Fraxinus velutina38份(包括新品种鲁蜡1号-鲁蜡4号),欧洲白蜡Fraxinus excelsior8份(包括5个新品种),美国白蜡Fraxinus americana7份(包括新品种红叶白蜡、秋紫白蜡、秋火白蜡和秋欢白蜡),美国紅梣Fraxinus pennsylvanica6份(包括新品种鲁蜡5号和鲁蜡6号),中国白蜡Fraxinus chinensis6份,2个未确定种质等, 15个树种共计90份,样品名称及来源见表1。每份种质取2~3片嫩叶装入做好标记的自封袋,用硅胶干燥后保存备用。
1.2 试验方法
1.2.1 总DNA制备
参照Murray和Thompson的CTAB法从试验材料幼叶中提取总DNA,并略作修改[18]。
1.2.2 AFLP分析
利用北京鼎国生物技术公司生产的AFLP试剂盒(PstI /Mse I 型)及其操作指南进行,分析90份白蜡属种质间的亲缘关系。。
(1)限制性酶切及连接反应。反应体系为20 μL,在0.2 mL的离心管中依次加入DNA模板4 μL (50 ng/μL),Adapter 1 μL,PstI /Mse I 2 μL,10×Reaction buffer 2.5 μL,ATP (10 mmol/L)2.5 μL,T4 Ligase 1 μL,ddH2O 7 μL。将上述混合液混匀离心数秒,37 ℃酶切5 h,之后8 ℃酶切4 h,4 ℃连接过夜,连接产物稀释20倍进行预扩增反应。
(2)预扩增反应。反应体系为25 μL,在0.2 mL的离心管中依次加入(DNA 2 μL,Preampmix 1 μL,dNTPs 0.5 μL,10XPCR buffer 2.5 μL,Taq DNA polymerase 0.5 μL,ddH2O 18.5 μL)进行预扩增。预扩增反应程序为:94 ℃变性2 min;94 ℃变性 30 s,56 ℃复性 30 s,72 ℃延伸 80 s,30个循环;72 ℃延伸5 min。
(3)选择性扩增反应。将预扩增产物稀释20倍作为选择性扩增模版,挑选9个带型清晰且多态性带好的选择性核苷酸PstI /Mse IⅠ引物进行选择性扩增(引物序列见表2)。PCR反应程序为第一轮扩增参数:94 ℃ 30 s,65 ℃ 30 s,72 ℃ 80 s,以后每轮循环温度递减0.7 ℃,扩增12轮。接着
按下列参数扩增23轮,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 80 s,最后延伸 5 min。
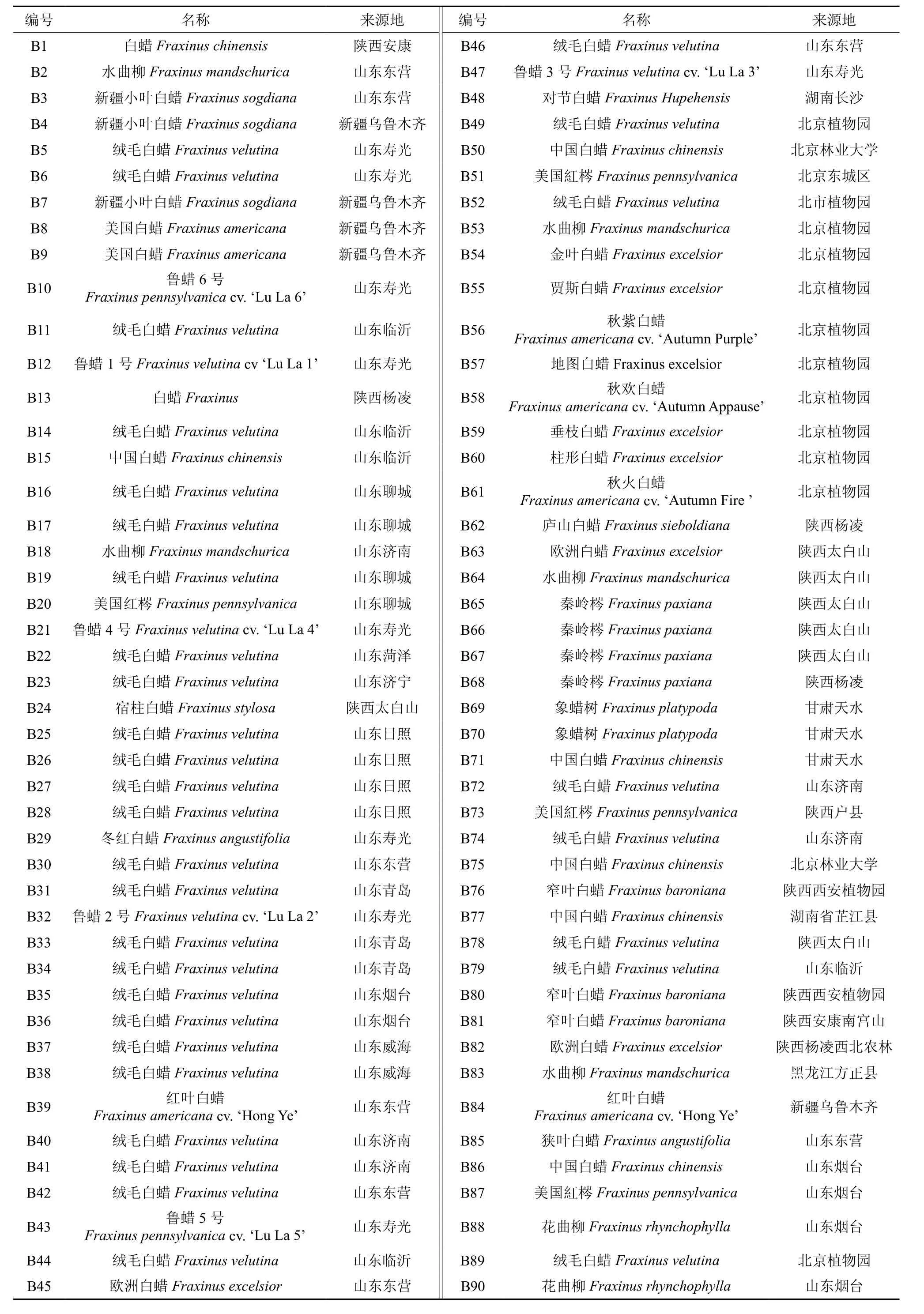
表1 供试材料及来源Table 1 Experiment materials and their origin
1.2.3 电泳分离检测与数据处理
取0.4 μL扩增产物采用ABI377型自动测序仪上样检测,Marker为荧光分子量标准(即GeneScan 500 Size Standard,ROX-500), 电泳结束后,DNA测序仪将自动保存胶图。运用GENESCAN 3.1分析软件,提取原始胶图中的数据。运用NTSYSpc 2.1软件,将得到的数据转变为0,1,有带的记为1,无带的记为0。按照赵丽华等的方法[15],使用POPGEN 32软件计算标记位点的多态性条带比率(percentage of polymorphic bands,PPB),标记位点的多态信息量(polymorphism informationcontent,PIC)和有效等位基因数(effective number of allele,Ne)。使用NTSYSpc-V.2.1计算遗传相似系数,并根据相似性系数对90份种质采kai用非加权配对类平均法(UPGMA)进行聚类分析。
2 结果与分析
2.1 DNA纯度检测
由图1琼脂糖凝胶电泳检测结果显示,提取的白蜡基因组DNA主带清晰,无RNA条带;核酸蛋白仪检测结果A260/A280比值1.796~1.868之间。表明采用改进CTAB法所提取白蜡基因组DNA结构完整,符合AFLP分子标记分析的要求。
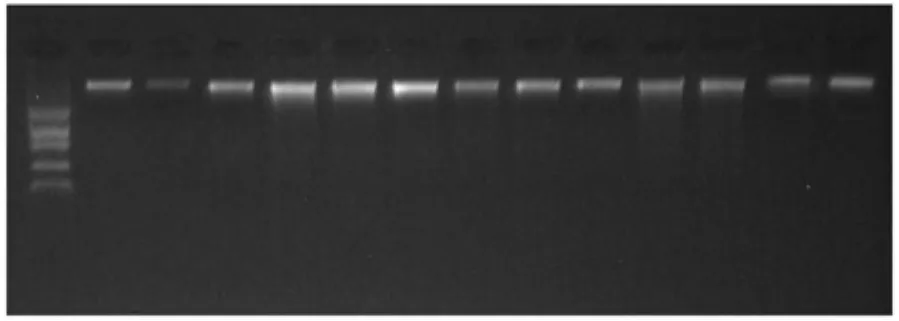
图1 部分样品基因组DNA 电泳图像Fig.1 Electrophoresis pattern of leaves DNA from part of samples
2.2 限制性酶切及连接反应
采用PstI/MseI对白蜡植物基因组DNA进行双酶切,0.8%的琼脂糖凝胶电泳结果如图2所示,酶切后,基因组DNA呈现连续均匀的弥散现象,表明DNA样品完全酶切。酶切时间在酶切反应中对酶切效果有重要的影响,酶切结果直接影响人工接头的连接反应和预扩增反应体系。为了进一步探讨适合白蜡属植物的酶切时间,本研究设置了7个不同时间酶切的梯度,图2对比结果显示,1~5 h酶切的带型相近,基因组DNA呈显连续均匀弥散状;6~7 h后,基因组DNA条带明显减弱,因此图2可以判断出1 h即可将DNA样品酶切充分,PstI/MseI酶切组合适合白蜡基因组DNA的AFLP标记分析。
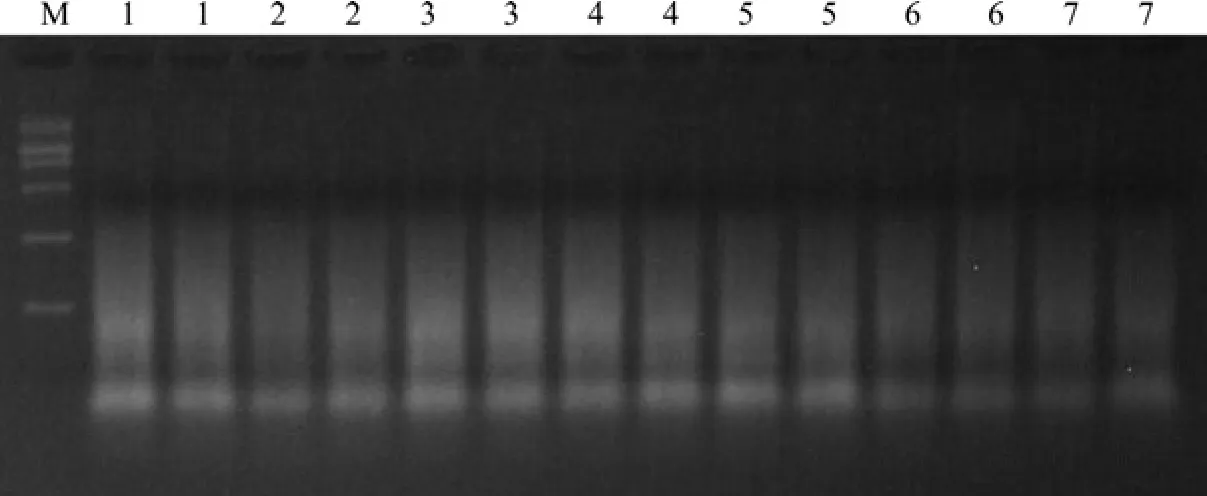
图2 双酶切时间梯度对比效果M: DL 2 000 Marker;1~7 :1、2、3、4、6、8 、10 h 时间梯度Fig.2 Effect of double enzyme time gradient.M: DL 2 000 Marker; 1-7 :1、2、3、4、6、8 、10 h time gradient
2.3 预扩增产物检测
PstI和MseI接头与PstI/MseI双酶切片段连接后,利用预扩增引物进行预扩增,图3扩增结果显示,预扩增片段主要集中在100~2 000 bp范围内,预扩增产物呈连续弥散均匀亮带,不同白蜡样品间预扩增带型比较一致,表明PstI和MseI接头与PstI/MseI双酶切片段已连接上,预扩增结果较好,可为选择性扩增提供较好地的模板,应用于AFLP选择性扩增分析。

图3 预扩增产物的电泳图像Fig.3 Electrophoresis pattern of pre-amplified product
2.4 白蜡种质AFLP扩增片段的多态性及遗传分析
从64对PstI/MseⅠ引物组合中筛选出8对稳定性好、多态性高且带型清晰的AFLP引物组合,对供试90份白蜡种质基因组DNA进行扩增与分析,结果见图1和表2。8对引物组合扩增出1630带条,其中多态性条带为1399条,平均多态位点百分率为85.8%。8对不同引物组合扩增效率存在一定的差异,其中引物组合GAG/CAG 效率最高,多态位点百分率达95.8%,引物组合GTG/CTC 最低,多态位点百分率为72.1%;平均每对引物扩增条带203.8条,其中多态性条带174.9条。结果表明,供试绒毛白蜡种质间的AFLP变异大,多态性高。
本研究利用POPGENE 3.2软件对各位点的遗传多样性参数进行计算,结果表明, 90份白蜡种质用8对引物进行遗传多样性分析,共检测到16个等位基因,每对引物检测到等位基因数目相等为2个;平均有效等位基因数为1.258 8,引物GTG/CTT的有效等位基因数最小为1.236 0,而引物GAG/CAA的最大为1.275 9;Nei’s 遗传多样性指数为0.171 7;Shannon信息指数范围为0.286 9(见表2),说明90份白蜡种质间存在遗传变异。

表2 绒毛白蜡AFLP 分析结果†Table 2 Results of AFLP analysis of Fraxinus velutina
2.5 供试种质的遗传相似系数及聚类分析
通过AFLP检测结果分析,90份绒毛白蜡材料的遗传相似系数的变异范围为0.707 2~0.888 9。由相似系数矩阵可以看出,在供试的90份白蜡材料中,B75与B77的遗传相似系数最大,为0.888 9,其遗传距离最小为0.111 1,说明其两者间的亲缘关系最近;而B24与B68之间的遗传相似系数最小,为0.7072,其遗传距离也最大为0.212 8。由遗传相似系数分析可知,供试材料间的遗传相似系数变化较大, 具有较为丰富的遗传多样性。
基于遗传相似系数,对90份白蜡种质采用UPGMA聚类分析并绘制树状图,结果见图4。从聚类图可以看出,以相似系数0.74 为标准可以将90个白蜡种质分为如下两大类。第1大类只有一个种质B24,该种质是课题组从陕西太白山收集的野生资源宿柱白蜡。第2大类包括89个种质,划分为两个亚类。第1亚类也仅有一个种质B71,甘肃天水收集的野生资源,中国白蜡。第2亚类包括88个种质,以相似系数0.762 为标准可以将88个白蜡种质分3组。
第1组由50个种质组成,其中山东38个种质,包括绒毛白蜡、美国紅梣和美国白蜡的新品种(红叶白蜡);北京7个种质,包括美国紅梣、绒毛白蜡和美国白蜡的新品种(秋紫白蜡、秋火白蜡和秋欢白蜡);陕西2个种质,绒毛白蜡和美国紅梣;新疆3个种质,包括美国白蜡和美国白蜡的新品种(红叶白蜡、、秋紫白蜡、秋火白蜡和秋欢白蜡)。
第2组由21个种质组成,其中山东6个种质,包括新疆小叶白蜡、水曲柳、狭叶白蜡和狭叶白蜡的新品种(冬红白蜡)、欧洲白蜡;北京6个种质,包括欧洲白蜡的新品种(金叶白蜡、贾斯白蜡、地图白蜡、垂枝白蜡、柱形白蜡)和水曲柳,陕西3个种质,包括欧洲白蜡和水曲柳;新疆2个种质为新疆小叶白蜡;甘肃2个种质为象蜡树;湖南1个种质为对节白蜡;黑龙江1个种质为水曲柳。B3山东东营的新疆小叶白蜡和B4新疆乌鲁木齐的新疆小叶白蜡亲缘关系较近,而与B7的较远,B3的种质可能来源于新疆乌鲁木齐;象蜡树与水曲柳的亲缘关系较近,B2与其它三个水曲柳的关系较远;欧洲白蜡与狭叶白蜡亲缘关系较近,狭叶白蜡新品种冬红白蜡与B85狭叶白蜡距离较远,说明新品种变异较大。B48对节白蜡单独为一支。
第3组由17个种质组成,其中山东4个种质包括花曲柳和中国白蜡;北京2个种质为中国白蜡;湖南1个种质为中国白蜡;陕西10个种质,包括秦岭梣、窄叶白蜡、庐山白蜡和2个未命名种质分别为B1和B13。未命名种质B1与B65、B66和B67秦岭梣聚为一支;未命名种质B13和B15中国白蜡聚为一支。庐山白蜡、花曲柳和窄叶白蜡聚为一支。
3 结论与讨论
多态带百分率(P)、有效等位基因数(Ne)、Nei’s基因多样性(H)与Shannon信息指数(I)是衡量植物遗传多样性常用指标[19]。本试验中多态位点指数范围为72.1%~95.8%,平均值为85.8%,位点多态性良好;有效等位基因数为1.258 8,Nei’s基因多样性为 0.171 7,Shannon 信息指数为0.286 9,在分子水平上显示了白蜡种质资源具有较高的遗传多样性。这与胡春龙[20]用11对SSR引物对46 份白蜡种质扩增所得82.93%的多态性比率较接近,低于王建兵[21]用10 对SSR引物对12 份白蜡种质亲本扩增所得100%的多态性比率。采用不同的分子标记方法获得多态性有明显差异,遗传多样性越高,其遗传背景越复杂,表明该物种存在的历史越悠久[22]。
至今对白蜡品种资源的分类还没有统一的方法,本试验根据树状分类图和样品间的遗传相似系数,将90个种质分成2大类,第2大类包括89个种质,划分为两个亚类。第1亚类仅有一个种质。第2亚类包括88个种质,以相似系数0.762 为标准可以将88个白蜡种质分3组。从本研究的聚类图中第1组可以看出,绒毛白蜡、美国紅梣和的美国白蜡聚为一类,这说明3个种的亲缘关系很近,有共同的系统来源,这与中国树木志[23]、山东木本植物志[24]和山东木本植物精要[25]的分类一致。第2组象蜡树、新疆小叶白蜡、欧洲白蜡、水曲柳、狭叶白蜡和对节白蜡6个种聚为一类;山东木本植物精要中将欧洲白蜡、水曲柳和狭叶白蜡聚为一组,对节白蜡单独为一支;而中国树木志中将象蜡树、对节白蜡、新疆小叶白蜡和水曲柳聚为一类,花有花萼的对节白蜡和象蜡树聚为一支,花无花萼的新疆小叶白蜡和水曲柳聚为一支,关于对节白蜡和象蜡树的分类地位还需进一步研究。第3组秦岭梣、庐山白蜡、花曲柳、中国白蜡、和窄叶白蜡5个种聚为一类,这与中国植物志中分类一致,秦岭梣和庐山白蜡亲缘关系较近,花曲柳、中国白蜡、和窄叶白蜡亲缘关系较近;其中未命名种质B1与B65、B66和B67秦岭梣亲缘关系较近;未命名种质B13和B15中国白蜡聚为一支,结合形态特征推测B1为秦岭梣,B13为中国白蜡。
总体来看,本研究中聚类分析结果与植物形态学分类基本上一致,进一步说明了AFLP分子标记的多态性与形态表型的多样性一致;而在少数白蜡种上的差异,造成这种现象的原因,可能为同名异物,或是白蜡品种的起源和亲缘关系较为复杂所致,也可能是因为地区之间白蜡品种的广泛交流导致了某些基因在不同地区种质间的渗入,或者引种过程中对种质的来源地没有调查清楚,反映出不同分类或聚类指标可能会产生不同的结果[26-28]。而分子标记能反映遗传上的差异,本研究利用AFLP标记技术初步揭示了白蜡种源的亲缘关系和遗传多样性,为进一步对白蜡种源进行遗传多样性分析和白蜡育种奠定了基础,更适合为育种服务。
目前,针对可应用于白蜡种质分子方面研究较少,还有2个未命名的种质,需要进一步通过表性特征和分子水平相结合进行鉴定。因而还需加大开发白蜡其它分子标记研究,因为分子标记技术具有扩增条带统计误差较大等缺点,不能真实地反映植物样本遗传多态性,所以在今后研究中,需继续开展不同种质间分子标记技术比较,再结合其它鉴定方法,才能更加全面、准确地反映白蜡遗传多样性。
[1]胡春龙,张 晨,刘翠兰,等.基于SSR标记构建白蜡种质资源分子身份证[J].山东农业科学,2015(5):6-9,22.
[2]燕丽萍,刘翠兰,李 丽,等.耐盐绒毛白蜡特异性SCAR分子标记的鉴定[J].西北植物学报,2014,34(4):671-675.
[3]孟昭和,刘德玺.绒毛白蜡引种研究现状[J].林业科技通讯,2001(1):17-21.
[4]刘 欢,张新全,马 啸,等.基于荧光检测技术的多花黑麦草EST-SSR指纹图谱的构建[J].中国农业科学,2017,50(3):437-450.
[5]洪亚平,代子闻,陈之端,等.木犀科梣属(Fraxinus)三心皮子房的确证及其系统学意义[J].河南林业科技, 2004,24(1):43-40.
[6]BOLARIC S, BARTH S, MELCHINGER A E,et al.Genetic diversity in European perennial ryegrass cultivars investigated with RAPD makers[J].Plant Breeding, 2005, 124(2):161-166.
[7]ROLDAN-RUIZ I, VAN EUWIJK F A, GILLILAND T J,et al.A comparative study of molecular and morphological methods of describing relationships between perennial ryegrass (Lolium perenneL.) varieties[J].Theoretical and Applied Genetics, 2001,103(8):1138-1150.
[8]Zabeau M, Vos P.Selective restriction fragment amplification:a general method for DNA fingerprinting.Euro-pean Patent Application, 1993,No.92402629, Publication No.534- 858.
[9]Vos P, Hogers V P, Bleeker R,et al.AFLP: A new technique for DNA finger printing[J].Nucleic Acids Research, 1995, 23:4407-4414.
[10]Tosto D S, Hopp H E.Suitability of AFLP markers for the study of genomic relationships within theOxalis tuberosaalliance[J].Plant Systematics and Evolution, 2000, 223:201-209.
[11]梁国校,刘 凯,马锦林,等.香花油茶分子分类与鉴定[J].经济林研究,2017,35(1):26-29.
[12]李善文,张有慧,张志毅,等.杨属部分种及杂种的AFLP分析[J].林业科学,2007,43(1):35-41.
[13]杨朝东,王 健,张俊卫,等.梅花不同样本间亲缘关系的AFLP初步分析[J].中国农业科学,2005,38(10): 2084-2089.
[14]Beedanagari S R, Dove S K, Wood B W,et al.A first linkage map of pecan cultivars based on RAPD and AFLP markers[J].Theoretical and Applied Genetics, 2005, 110: 1127-1137.
[15]HEUERTZ M S.FINESRHI, M.ANZIDEI,et al.Chloroplast DNA variation and postglacial recolonization of common ash(Fraxinus excelsiorL.) in Europe[J].Molecular Ecology,2004,13(11): 3437-3452.
[16]Bacles C F, Ennos R A.Paternity analysis of pollen-mediated gene flow forFraxinus excelsiorL.in a chronically fragmented landscape[J].Heredity,2008,101:368-380.
[17]Goto S K, Shimatani H, YoshimaruY,et al.Fat-tailed gene flow in the dioecious canopy tree speciesFraxinus mandshuricavar.japonica revealed by microsatellites[J].Molecular Ecology,2006,15(10):2985-2996.
[18]Murray M G, Thompson W F.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acids Research,1980,8(19): 4321-4325.
[19]李春侨,周 龙,陆 彪,等.天山樱桃野生居群遗传多样性SSR 分析[J].经济林研究,2017,35(3):44-49.
[20]胡春龙.基于SSR标记构建白蜡种质资源分子身份证及其遗传多样性分析[D].泰安:山东农业大学,2015.
[21]王健兵.白蜡核心种质及绒毛白蜡无性系SSR评价体系建立[D].兰州:甘肃农业大学,2014.
[22]李俊丽,向长萍,张宏荣,等.南瓜种质资源遗传多样性的RAPD分析[J].园艺学报,2005,32(5):834-839.
[23]郑万钧.中国树木志[M].北京:中国林业出版社,2004:4389-4390.
[24]李法曾,李文清,樊守金.山东木本植物志(下卷)[M].北京:科学出版社,2016:251-252.
[25]臧德奎.山东木本植物精要[M].北京:中国林业出版社,2015: 51-252.
[26]谢 荟,祝文娟,张应中,等.基于SRAP 分子标记的广宁红花油茶种质资源遗传多样性研究[J].中南林业科技大学学报,2017,37(8):93-97.
[27]沈 镝,朱德蔚,李锡香.云南竽种质资源遗传多样性的RAPD分析[J].植物遗传资源学报,2005,4(3):449-453
[28]Hao Q, Liu Z A, Shu Q Y,et al.Studies on paeonia cultivars and hybrids identification based on SRAP analysis[J].Hereditas,2008,145(1):38-47.
