维生素D3对博来霉素诱发小鼠肺纤维化的影响
2018-07-04徐德祥陈远华
王 熹,赵 卉,徐德祥,陈远华
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一类慢性间质性肺疾病,以肺泡上皮细胞损伤、成纤维细胞增生和细胞外基质聚集增多为病理特征[1]。IPF是最常见的肺部疾病之一,其发病机制复杂,早期诊断较为困难,预后极差。博来霉素(bleomycin , BLM)是一种广泛应用的抗肿瘤药物,常在实验中用于诱导小鼠肺纤维化,BLM诱导的肺纤维化,与人类的特发性肺纤维化相类似,是最常用的研究特发性肺纤维化的模型[2]。由于尚无有效方法治疗特发性肺纤维化,急需尝试新的预防和治疗性干预措施以预防特发性肺纤维化。越来越多研究[3-4]证明,活性氧可能在BLM诱导的肺纤维化中起关键作用,活性氮也参与其中,同时,大量研究[5]表明,抗氧化治疗具有一定的抗肺纤维化作用。维生素D(Vitamin D,VitD)是脂溶性开环类固醇激素。人体维生素D主要通过光照由皮肤合成,少量由食物摄入[6]。传统观点认为,维生素D在钙吸收和骨骼代谢中发挥关键作用[7]。最近研究[8]表明,维生素D也具有抗氧化剂作用。维生素D本身缺乏生物活性。维生素D在肝脏细胞色素P450(CYP)2R1作用下首先转化为25-(OH)-D3,25-(OH)-D3在肾脏CYP27B1作用下进一步转化成活性型1,25-(OH)2-D3(即骨化三醇)[9]。该研究旨在探讨维生素D3对BLM诱发小鼠肺纤维化的影响。
1 材料与方法
1.1化学试剂博来霉素和维生素D3购自美国Sigma Chemical公司;3-硝基酪氨酸抗体购自美国Santa Cruz Biottchnologies公司;TRIzol总RNA提取试剂购自美国分子研究中心;DNA酶和实时PCR扩增试剂盒购自美国Promega公司;化学发光(ECL)检测设备购自皮尔斯生物技术公司;引物由美国Life Technologies公司合成。
1.2实验动物成年的C57BL/6J雄性小鼠(8周大小,24~26 g)购自北京维通利华公司,实验前动物适应性喂养1周,自由饮食,昼夜节律,环境温度20~25 ℃,湿度(50±5)%。
1.3方法
1.3.1动物分组、处理 96只成年C57BL/6J雄性小鼠随机分为如下8组:生理盐水对照组(对照组),单纯维生素D3组(VitD3组),博来霉素组(BLM 1 d组、BLM 7 d组和BLM 21 d组),维生素D3+博来霉素组(VitD3+ BLM 1 d组、VitD3+BLM 7d组和VitD3+ BLM 21 d组)。BLM组和VitD3+ BLM组小鼠经气管内注射给予单次博莱霉素(3.0 mg/kg),对照组和VitD3小鼠经气管内注射给予等量生理盐水。VitD3+BLM组小鼠在BLM处理前30 min以及处理后每天经腹腔给予1次1 μg/kg的1,25(OH)2D3(活性维生素D3),对照组、BLM组和VitD3组给予等量的生理盐水或1,25(OH)2D3。1,25(OH)2D3剂量参照文献[10]。对照组、VitD3组于气管内生理盐水注射后21 d剖杀,余组分别于BLM处理后1 d、7 d、21 d剖杀,取左肺组织做石蜡切片和HE染色,取右肺放置在-80 ℃冰箱内用于RT-PCR。

图1 肺脏的HE染色 ×100
1.3.2肺组织病理学 将留取的肺组织标本固定在4%福尔马林中并按照标准的程序嵌入石蜡中包埋,用石蜡包埋的肺组织行连续切片,至少将5张连续的切片行HE染色。
1.3.3实时定量逆转录-聚合酶链反应 运用TRIzol总RNA提取试剂提取肺脏组织总RNA,在280 nm及260 nm波长下运用分光光度计测样品的吸光度值,进行RNA完整性验证及其浓度计算。稀释总RNA样品定量成0.5 μg/ml,进行DNA的消化、逆转录成cDNA。将cDNA 1 μl,MIX 10 μg,模板链和随从链引物各1 μl,无酶水7 μl,置入RT-PCR扩增仪,通过变性、退火、延伸3个步骤进行扩增,运用专用软件计算目标基因的相对值。各基因引物序列见表1。
1.3.4肺组织免疫组化学检测 随机从每组肺脏组织切片中选取5张 ,烤箱烤片后二甲苯脱蜡,依次梯度浓度乙醇水化,然后滴加TritonX-100通透细胞,再滴加10%过氧化氢进行封闭,后枸橼酸钠缓冲液中微波修复抗原3次,每次5 min,间隔10 min。冷却至室温后滴入5%的羊血清湿盒内静置20 min,然后在组织表面滴注3-硝基酪氨酸(3-nitrotyrosine,3-NT)一抗孵育,放置4 ℃冰箱孵育过夜。然后相应进行二抗孵育,SP反应,最后用DAB显色,在光镜下进行观察显色,显色充分后进行复染、脱水、透明、封片。每张片子随机取5个高倍镜视野在光学显微镜下观察,使用 Image-Pro Plus 6.0图像分析软件半定量分析各个视野下棕黄色区域占整个该视野面积的比例。

表1 各基因引物序列

2 结果
2.1维生素D3对博莱霉素所致小鼠肺纤维化的影响肺组织HE染色结果提示,与对照组对比,BLM组小鼠给药7 d、21 d后肺泡正常结构破坏严重,7 d开始出现肺泡间隔增厚,21 d肺间隔明显增宽、成纤维细胞增生、胶原沉积。VitD3显著减轻BLM引起的肺泡正常结构破坏、肺间隔增宽和肺纤维化。见图1。

图2 肺脏的3-NT免疫组化染色 SP×400
A:对照组;B:VitD3组;C:BLM 1 d组;D:VitD3+ BLM 1 d组;E:BLM 7 d组;F:VitD3+ BLM 7 d组;G:BLM 21 d组;H:VitD3+ BLM 21 d组
2.2维生素D3对博莱霉素所致肺蛋白质硝化的影响BLM组小鼠肺组织中棕黄色显色区域定量较对照组明显增多(P<0.01),蛋白质硝化随时间延长而增加,其中7 d达到峰值,21 d时有所下降,而VitD3+BLM组小鼠肺组织中棕黄色区域定量与BLM组对比明显减少(P<0.01),说明维生素D3抑制了BLM所致的蛋白硝化反应。见图2、3。
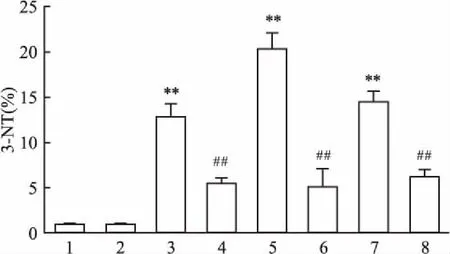
图3 3-NT 免疫组织化学染色相对表达量
1:对照组;2:VitD3组;3:BLM 1 d组;4:VitD3+ BLM 1 d组;5:BLM 7 d组;6:VitD3+ BLM 7 d组;7:BLM 21 d组;8:VitD3+ BLM 21 d组;与对照组比较:**P<0.01;与BLM组比较:##P<0.01
2.3维生素D3对博莱霉素上调小鼠肺NADPH氧化酶基因的影响与对照组对比,BLM组小鼠肺NADPH氧化酶基因p47phox在给药后1、7 d上调(P<0.05),p67phox在给药后7、21 d明显上调(P<0.01)。VitD3显著减轻BLM引起的小鼠肺p47phox和p67phox基因的上调。单纯维生素D3组与对照组比较氧化酶基因表达无明显变化。见图4。

图4 各组小鼠肺脏NADPH氧化酶mRNA表达情况
A:p47phox;B:p67phox;1:对照组;2:VitD3组;3:BLM 1 d组;4:VitD3+ BLM 1 d组;5:BLM 7 d组;6:VitD3+ BLM 7 d组;7:BLM 21 d组;8:VitD3+ BLM 21 d组;与对照组比较:*P<0.05,**P<0.01;与BLM组比较:#P<0.05,##P<0.01
2.4维生素D3对博莱霉素下调小鼠肺抗氧化酶基因的影响与对照组比较,BLM组小鼠肺抗氧化酶基因超氧化物歧化酶(superoxide dismutase,sod)1在给药后1、7和21 d明显下调(P<0.01),sod2在1d明显下调(P<0.01),谷胱甘肽过氧化物酶(glutathione peroxidase,gshpx)在21 d明显下调(P<0.01),VitD3显著对抗BLM引起的小鼠肺sod1、sod2、gshpx基因表达下调。BLM对谷胱甘肽还原酶基因(glutathione reductase,gshrd)表达影响很小,然而VitD3+BLM组gshrd基因表达明显升高(P<0.01)。单纯维生素D3组与对照组比较抗氧化酶基因表达无明显变化。见图5。
A:sod1;B:sod2;C:gshpx;D:gshrd;1:对照组;2:VitD3组;3:BLM 1 d组;4:VitD3+ BLM 1 d组;5:BLM 7 d组;6:VitD3+ BLM 7 d组;7:BLM 21 d组;8:VitD3+ BLM 21 d组;与对照组比较:**P<0.01;与BLM组比较:#P<0.05,##P<0.01
3 讨论
肺纤维化是一种慢性肺部疾病,其病理机制仍不明确,目前暂无有效的治疗药物。目前研究肺纤维化多数运用BLM诱导的肺纤维化模型,本研究成功复制BLM肺纤维化模型,并给予VitD3进行干预。结果显示,维生素D3明显减轻了BLM处理后7 d、21 d肺泡正常结构破坏、肺间隔增厚、纤维细胞增生以及胶原沉积。上述结果提示:维生素D3明显减轻了BLM引起的肺纤维化,这与早前研究报道维生素D3能改善BLM诱发小鼠肺纤维化相一致[11]。
随着氧化应激研究的深入,目前有研究[3]表明氧化应激在肺纤维化过程中起重要作用。另有研究[12]提示VitD3可以减轻LPS诱发的急性肾损伤中的氧化应激,其主要机制是调节氧化酶和抗氧化酶基因的表达。因此设想VitD3保护BLM诱发肺纤维化的机制与抗氧化应激相关。本研究结果显示BLM所致肺纤维化模型中小鼠肺NADPH氧化酶p47phox和p67phox基因分别在给药后1 d、7 d和7 d、21 d明显上调,同时抗氧化酶sod1在给药后1 d、7 d和21 d明显下调,sod2基因在1 d明显下调,gshpx基因在21 d明显下调,上述结果表明BLM所致肺纤维化中存在氧化酶基因上调和抗氧化酶基因下调,各种酶基因表达调节时间及时限不同,抗氧化酶以sod为主。VitD3处理显著减弱了BLM所致的肺NADPH氧化酶基因表达的上调和抗氧化酶基因表达的下调。此外,本研究免疫组化结果显示BLM所致肺纤维化模型中蛋白质硝化标志3-NT残留定量明显增多,而VitD3明显减少了BLM所致3-NT残留。综上所述:维生素D3抑制BLM所致肺纤维化过程中氧化应激,其可能的机制是下调氧化酶基因及上调抗氧化酶基因的表达。
目前,很多研究[13-14]显示BLM诱发肺纤维化的机制可能与炎症、氧化应激、内质网应激等领域相关。而前期研究[10,15]表明维生素D3抑制BLM诱导的肺部炎症以及内皮细胞中的内质网应激。本研究仅阐述维生素D3对BLM所致肺纤维化具有保护作用以及可能的机制是减轻其过程中的氧化应激,但维生素D3是直接影响氧化应激,还是通过改善炎症、内质网应激等间接影响氧化应激,抑或是作用三个机制共同起到保护作用,本研究暂未阐明,有待进一步的研究。总之本研究结果表明维生素D3对肺纤维化起保护作用及部分机制,并对临床治疗提出新的方向。
[1] Sergew A. Advances in the treatment of idiopathic pulmonary fibrosis[J]. Expert Opin Emerg Drugs, 2015, 20(4): 537-52.
[2] Moore B B. Murine models of pulmonary fibrosis[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(2): L152-60.
[3] Cheresh P, Kim S J, Tulasiram S. Oxidative stress and pulmonary fibrosis[J]. Biochim Biophys Acta, 2013, 1832(7): 1028-40.
[4] Hsu Y C, Wang L F. Nitric oxide in the pathogenesis of diffuse pulmonary fibrosis[J]. Free Radic Biol Med, 2007, 42(5): 599-607.
[5] Day B J. Antioxidants as potential therapeutics for lung fibrosis[J]. Antioxid Redox Signal, 2008, 10(2): 355-70.
[7] Holick M F. Resurrection of vitamin D deficiency and rickets[J]. J Clin Invest, 2006, 116(8): 2062-72.
[8] Zhong W, Gu B, Gu Y, et al. Activation of vitamin D receptor promotes VEGF and CuZn-SOD expression in endothelial cells[J]. J Steroid Biochem Mol Biol, 2014, 140: 56-62.
[9] Bikle D D. Vitamin D metabolism, mechanism of action, and clinical applications[J]. Chem Biol, 2014, 21(3): 319-29.
[10] Tan Z X, Chen Y H, Xu S, et al. Calcitriol inhibits bleomycin-induced early pulmonary inflammatory response and epithelial-mesenchymal transition in mice[J]. Toxicol Lett, 2016, 240(1): 161-71.
[11] Zhang Z, Yu X, Fang X, et al. Preventive effects of vitamin D treatment on bleomycin-induced pulmonary fibrosis[J]. Sci Rep, 2015, 5: 17638.
[12] Xu S, Chen Y H, Tan Z X, et al. Vitamin D3 pretreatment alleviates renal oxidative stress in lipopolysaccharide-induced acute kidney injury[J]. J Steroid Biochem Mol Biol, 2015, 152: 133-41.
[13] Todd N W, Luzina I G. Molecular and cellular mechanisms of pulmonary fibrosis[J]. Fibrogenesis Tissue Repair, 2012, 5(1): 11.
[14] Hotamisligil G S. Endoplasmic reticulum stress and the inflammatory basis of metabolic disease[J]. Cell, 2010, 140(6): 900-17.
[15] Haas M J, Jafri M, Wehmeier K R, et al. Inhibition of endoplasmic reticulum stress and oxidative stress by vitamin D in endothelial cells[J]. Free Radic Biol Med, 2016, 99:1-10.
