NLRP3炎症小体在大肠杆菌血流感染免疫反应机制中的作用
2018-07-04朱梦梦周树生
朱梦梦,周树生,刘 宝
血流感染以高死亡率和高发病率著称[1]。大肠杆菌是一种常见的和致命的导致血流感染的病原菌之一,同时也是血流感染中最常见的致病性革兰氏阴性杆菌[2]。研究[3]显示,Nod样受体蛋白3[nucleotide-binding domain (NOD)-like receptor protein 3,NLRP3]炎症小体可能与多种人类疾病有关。迄今为止,NLRP3炎症小体是研究最多的炎症小体,由NLRP3、凋亡相关的点状蛋白含CRAD结构域的凋亡相关斑点样蛋白(apoptosis associated speck-like protein containing a CARD,ASC)、半胱氨酸天冬氨酸蛋白酶1(cysteinyl aspartate specific proteinase-1,caspase-1)组成的蛋白复合物,许多微生物病原体可能通过其产物如:毒素、RNA、DNA等激活NLRP3炎症小体,包括真菌、细菌和病毒等[4]。caspase-1的激活导致专门的白介素1β(interleukin-1β,IL-1β)和白介素18(interleukin-18,IL-18)分泌[5],细胞因子IL-1β和IL-18可以诱导全身炎症反应和清除病原微生物。NLRP3炎症小体在多系统的多种炎症反应中起重要作用[6],但是在单一大肠杆菌血流感染引起的脓毒症中免疫反应机制尚不清楚,该实验通过单种革兰氏阴性细菌(大肠杆菌)血流感染建立脓毒症模型,探讨NLRP3炎症小体在免疫反应机制,为脓毒症的临床治疗提供一个新的思路。
1 材料与方法
1.1实验材料
1.1.1实验动物 60只SPF级健康雌性6周龄C57BL/6J小鼠(20~25 g),购自安徽省实验动物中心,饲养于12 h明暗交替SPF级环境中,实验开始前适应环境1周。
1.1.2菌株来源 大肠杆菌标准菌株 (ATCC 25922)由安徽省立医院临床微生物实验室惠赠。
1.1.3实验主要试剂 IL-1B和IL-18 ELISA测定试剂盒(武汉华美公司);TRIzol(美国Invitrogen公司);反转录试剂盒(美国Thermo公司);荧光定量PCR试剂盒(德国凯杰公司);RealTime专用八连管(美国ABI公司);β-actin单克隆抗体(北京中杉金桥生物公司);NLRP3单克隆抗体、caspase-1 p20单克隆抗体(英国abcam公司); ASC单克隆抗体(美国CST公司);通用型二抗、BCA蛋白浓度测定试剂盒、RIPA裂解液、蛋白酶抑制剂(PMSF)、SDS-PAGE蛋白上样缓冲液、PVDF膜、脱脂牛奶、ELC发光液等 Westem blot相关试剂(上海碧云天生物技术有限公司)。
1.1.4实验仪器设备 高速低温离心机(美国Beckman公司);LHP型恒温恒湿培养箱 (常州普天仪器制造有限公司);细菌比浊仪(英国Oxiod公司);酶标仪、WB电泳仪和电泳槽及湿性转印槽(美国Bio-Rad公司);RT-PCR分析系统(美国Biosystems 7500);紫外分光光度计(上海天普分光光度计有限公司);-80 ℃超低温冰柜(日本索尼公司)。
1.1.5引物 依据GenBank中收录的小鼠肌动蛋白(β-actin) 、NLRP3、ASC、caspase-1 基因序列,利用Primer premier 5.0引物设计软件设计引物用于RT-PCR检测,PCR引物由上海生工公司合成。各引物序列见表1。

表1 NLRP3炎症小体基因引物序列
1.2方法
1.2.1菌液培养 将冷冻的大肠杆菌接种在血琼脂平板上,琼脂平板在CO2培养箱中孵育24 h后,挑取单个的大肠杆菌菌落转移到LB液体培养基中,37 ℃摇菌12 h。菌液离心后重悬于PBS中,菌液稀释至2×109cfu/ml作为最适感染浓度[7]。
1.2.2模型建立 实验动物分成3组(对照组、血流感染24 h组、血流感染48 h组),每组20只,血流感染组小鼠分别麻醉后经尾静脉注射菌液0.1 ml/10 g,对照组小鼠注射等量的PBS。血流感染24 h组、血流感染48 h组分别于感染后24 h和感染后48 h安乐死处死小鼠,对照组在实验开始时即安乐死处死小鼠。
1.2.3ELISA法检测细胞因子 检测血清及肺、肾、肝组织匀浆中IL-1Β及IL-18的含量,严格按照ELISA检测试剂盒的操作说明进行操作,分别检测各标本在480 nm处的吸光度(optical density,OD)值,用标准品的浓度和OD值做标准曲线,根据样本的吸光度值和线性回归方程得出浓度值,样本浓度=实测浓度×稀释倍数。
1.2.4实时荧光定量PCR(RT-qPCR)法检测NLRP3、ASC、caspase-1 mRNA的表达 所有物品经DEPC水消毒,分别取血流感染组小鼠和对照组小鼠的组织(肝、肾、肺)50~100 mg放入匀浆器中,加入1 ml 预冷的TRIzol,彻底研磨后按RNA提取试剂盒说明书提取RNA。取2 μl mRNA按逆转录试剂盒说明书逆转录合成相应的cDNA,以β-actin 作为内参,cDNA为模板进行PCR扩增,PCR反应体系为cDNA 2 μl,上下游引物各0.8 μl,灭菌蒸馏水6 μl,ROX Reference DyeⅡ0.4 μl,共20 μl的反应体系。反应条件如下:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,总共进行40个循环。采用2-ΔΔCt法分析计算出相对表达量。
1.2.5Western blot 法检测小鼠组织中NLRP3、ASC、caspase-1 p20蛋白表达水平 分别取血流感染组和对照组小鼠组织100 mg放于匀浆器底部,分别加入RIPA裂解液1 ml和蛋白酶抑制剂10 μl在冰上研磨裂解,4 ℃、12 000 r/min离心20 min,按BCA蛋白浓度测定试剂盒说明书进行蛋白定量后,加入SDS-PAGE蛋白上样缓冲液(4 ∶1体积),100 ℃变性10 min后-20 ℃保存。NLRP3及β-actin 蛋白用10%分离胶,ASC、caspase-1 p20蛋白用12%分离胶,4种蛋白都用5%浓缩胶。浓缩胶80 V,分离胶120 V进行电泳,根据预染 Marker指示,转移相应蛋白到PVDF膜上,用5%脱脂牛奶封闭液封闭,室温1 h,封闭后分别用抗NLRP3、ASC、caspase-1抗体1 ∶1 000、β-actin 抗体1 ∶1 000孵育过夜,TBST洗涤3次,每次15 min,孵育二抗辣根过氧化物酶标记山羊抗兔 IgG 1 ∶20 000,室温1 h ,TBST 洗涤3次,每次15 min,用ECL曝光、显影,用Image J软件分析测定其灰度值。
1.2.6HE染色 新鲜的小鼠组织(肝、肾、肺)用福尔马林固定48 h后行石蜡包埋,切片,按HE染色步骤染色后置于光镜下观察并摄片,病理炎症评分(PIS)用于HE染色后的组织急性炎症评分,主要评估各组织切片HE染色后炎症细胞的浸润(主要为中性粒细胞和巨噬细胞)。

2 结果
2.1大肠杆菌血流感染小鼠组织切片HE染色大肠杆菌血流感染后的小鼠组织(肝、肾、肺)切片HE染色显示均有炎症细胞浸润、细胞坏死和组织脓肿,且感染后48 h处死组的炎症细胞浸润、组织细胞坏死较24 h组更为严重,与同时段同组别的肾和肺组织相比,肝组织的炎症反应(炎症细胞浸润、组织细胞坏死)较为严重,见图1。感染组小鼠组织病理炎症评分(PIS评分)明显高于对照组,其中48 h组较24 h组PIS评分明显增高,见图2。

图1 各组小鼠组织切片 HE染色×400
2.2大肠杆菌血流感染小鼠组织及血清中IL-18及IL-1β表达水平IL-18在3组血液、肝脏、肾脏、肺组织中的表达量不完全相同,差异有统计学意义(F=888.486、581.820、638.689、2 037.61,P<0.05)。IL-1Β在3组血液、肝脏、肾脏、肺组织中的表达量不完全相同,差异有统计学意义(F=1 316.75、1 339.9、5 269.836、4 588.62,P<0.05)。与对照组比较,24 h组和48 h组肝、肾、肺组织匀浆中的IL-18和IL-1β水平均明显升高,其中肺组织中48 h组IL-18表达水平较24 h组明显上升,肾组织中48 h组IL-1β表达水平较24 h组明显上升(P<0.05);24 h组和48 h组血液中IL-18表达水平也明显升高,24 h组血液中IL-1β明显升高(P<0.05),而48 h组血液中IL-1β没有明显升高,见表2、图3~4。
2.3组织匀浆中NLRP3、ASC、caspase-1mRNA表达水平与对照组相比,感染后24 h肝、肺组织匀浆中NLRP3、ASC、caspaase-1 mRNA表达水平明显增高(P<0.05),而肾组织匀浆中的NLRP3、ASC、caspase-1 mRNA表达水平在感染后48 h明显升高(P<0.05),见图5。

图2 各组小鼠组织切片HE染色PIS评分

组别IL-18(pg/ml)血肝肾肺IL-1β(pg/ml)血肝肾肺对照2.21±0.3332.52±2.8435.60±2.5031.26±2.329.96±0.560.99±0.158.30±1.109.33±1.0924 h9.81±0.54∗148.32±12.95∗149.86±12.56∗60.65±1.48∗55.18±3.86∗2 495.17±191.19∗784.85±23.37∗526.12±20.60∗48 h8.29±0.38#145.50±7.02#136.68±4.41#109.83±3.95#9.64±0.68#1 836.22±29.16#2 185.52±79.90#183.87±5.12#
与对照组比较:*P<0.05;与24 h组比较:#P<0.05

图3 各组小鼠血液及组织匀浆中IL-18表达

图4 各组小鼠血液及组织匀浆中IL-1β表达

图5各组小鼠组织中NLRP3、ASC、caspase-1mRNA表达
A:NLPR3;B:ASC;C:caspase-1;1:对照组;2:24 h组;3:48 h组;与对照组比较:*P<0.05;与24 h组比较:#P<0.05
2.4小鼠组织中NLRP3、ASC、pro-caspase-1、caspase-1p20蛋白表达水平与正常对照组相比,24 h组和48 h组蛋白表达水平均有升高(P<0.05)。肝、肺、肾组织中NLRP3蛋白、ASC蛋白在48 h组中表达量比在24 h组中表达量要明显升高(P<0.05),而pro-caspase-1 在肝肾组织中3组表达量没有明显区别,caspase-1蛋白在肺肾组织中表达量随时间推移表达量上升,见图6~7。

图6 各组小鼠组织中NLRP3、ASC、caspase-1 蛋白表达
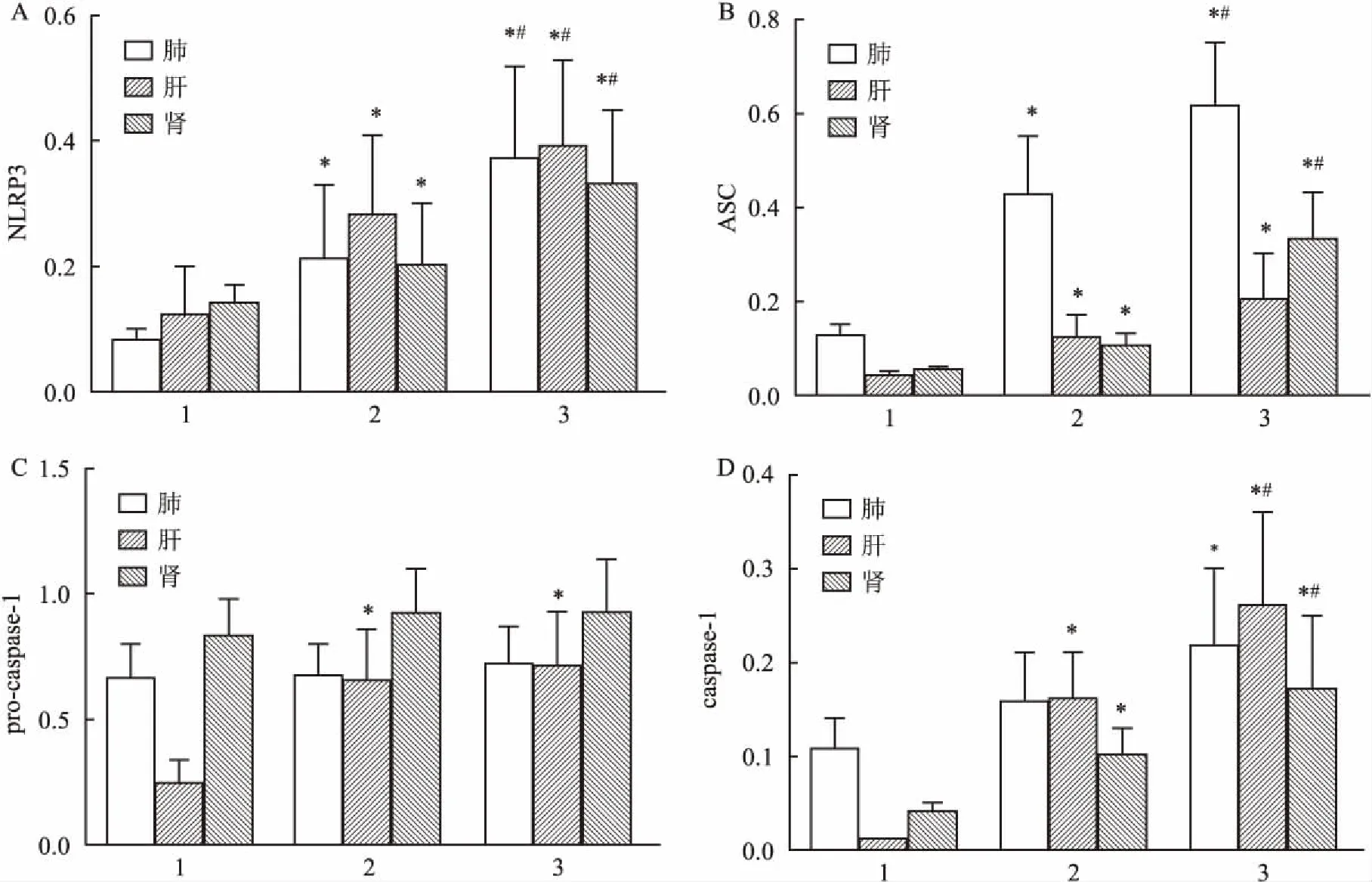
图7 各组小鼠组织中NLRP3、ASC、caspase-1、pro-caspase-1蛋白表达
3 讨论
血流感染(bloodstream infection,BSI)是一种由于血液中微生物,通常是细菌或真菌的存在引起的危及生命的疾病。由多种细菌导致的细菌血流感染可能是社区获得性的也可能是医源性的,引起了全世界范围内的高患病率和高死亡率[6]。一项以人群为基础的研究[8]显示大肠杆菌一直是BSI最常见的病原菌。炎症小体是导致有生物学活性的IL-1β释放的细胞质多蛋白复合物,其中最有代表性的就是NLRP3炎症小体[5]。NLRP3炎症小体是一种调节促炎细胞因子IL-18和IL-1β成熟的多蛋白复合物。NLRP3炎症小体包括NOD样蛋白NLRP3,适配器蛋白ASC和caspase-1,在内源性和外源性刺激下,NLRP3通过激活NLRP3并招募ASC和pro-caspase-1,导致caspase-1激活,随后将前IL-1β和前IL-18加工成其活性形式[9]。大肠杆菌血流感染可以导致脓毒症,目前脓毒症是ICU 死亡的主要原因,尽管卫生保健的进步,脓毒症的发病率和死亡率依旧很高。作为炎症小体的成员之一的NLRP3炎症小体感知细菌、病毒、真菌等病原体相关分子模式触发炎症反应。活化的NLRP3炎症小体可以招募炎症细胞到感染或受伤部位并诱导IL-1β和IL-18成熟和分泌。因此,NLRP3炎症小体在微生物诱导的脓毒症中起重要作用[10]。
国内目前最常用的脓毒症模型是盲肠结扎-穿孔(cecum ligation - perforation,CLP)模型,主要优点之一是易于标准化,还可以引入多种不同的变量,缺点是不能控制感染的细菌种类。同时,比较常用的脓毒症模型还有腹腔细菌接种、腹腔注射人粪便悬液、细菌或内毒素血症模型、烧伤脓毒症模型、腹膜炎脓毒症等多种脓毒症模型[11]。本课题组采用的是单种菌株静脉注射建立脓毒症模型,可以人为的控制感染剂量,稳定性和重复性好,更好的研究单一菌株对NLRP3炎症小体表达的影响,同时,该模型本身也存在一定的局限性,一过性的输入大量细菌可以引起动物的快速耐受或死亡,与临床感染灶细菌持续释放有一定的出入。本课题组前期研究[12]建立了简单易行的尾静脉或腹腔注射金黄色葡萄球菌,并成功摸索最适感染浓度,造成稳定的血流感染模型,为其他特定细菌或者多种已知细菌混合感染的研究奠定了基础。
Luo et al[9]通过CLP脓毒症模型发现血红素在脓毒症诱导的NLRP3炎症小体调节的急性肺损伤中起重要的保护作用。Zhang et al[13]研究发现在脓毒症小鼠中co通过释放分子3抑制心脏成纤维细胞中NLRP3炎症小体的活化来改善心肌功能。本课题组前期研究[14]显示在金葡菌诱导的血流感染中NLRP3炎症小体的表达呈上调 ,这为课题后期的实验研究奠定了基础。
本研究建立了大肠杆菌血流感染的小鼠脓毒症模型,通过HE染色证明了感染组小鼠肝、肾、肺组织的炎症反应和细胞坏死,不同组织间炎症反应略有差异,如肝组织中炎症细胞浸润和细胞坏死与同组肝肾组织相比较为严重;一定时间内随着感染后时间的推移,组织的感染越来越严重。Duan et al[7]的研究与本研究有相似的研究结果,感染后24 h肝组织表现出小部分的炎症改变,感染后2、3和5 d有更大、更多的组织损伤。
IL-18和IL-1β作为NLRP3 炎症小体裂解活化的产物,ELISA结果显示感染组小鼠血清和组织匀浆中IL-18和IL-1β水平均明显升高;Kang et al[15]研究结果与本研究有着相似之处,鲍曼不动杆菌杆菌感染后的小鼠IL-1β表达量升高,结果表明在鲍曼不动杆菌感染的巨噬细胞中,NLRP3和ASC与caspase-1活化和IL-1β成熟有关。
通过RT-qPCR法和Western blot 法分别检测到感染组NLRP3、ASC、caspase-1 mRNA和蛋白的表达量均有升高,而且不同组织中基因和蛋白的表达量稍有差异,同一组织中不同的基因和不同的蛋白的表达也不同。
综上所述,本实验显示大肠杆菌血流感染导致的脓毒症中NLRP3炎症小体的表达程现升高趋势,且在一定时间范围内有随时间推移表达增高趋势,这表明了NLRP3炎症小体在大肠杆菌血流感染中发挥了一定的调节作用。由于临床血流感染微生物的多样性和复杂性,NLRP3炎症小体在不同细菌、病毒、真菌血流感染中的作用有待进一步研究,同时NLRP3炎症小体的作用机制尚需深入研究。
[1] Rathinam V A, Vanaja S K, Waggoner L,et al.TRIF licenses caspase-11-dependent NLRP3 inflammasome activation by gram-negative bacteria[J].Cell,2012,150:606-19.
[2] Wang S, Zhao S Y, Xiao S Z, et al. Antimicrobial resistanceand molecular epidemiology ofEscherichiacolicausing bloodstream infections in three hospitals in Shanghai,China[J]. PLoS One,2016,11(1):e0147740.
[3] He Y,Hara H,Núez G. Mechanism and regulation of NLRP3 inflammasome activation[J].Trends Biochem Sci,2016, 41:1012-21.
[4] Wang H, Liu S, Wang Y, et al. Nod-like receptor protein 3 inflammasome activation byEscherichiacoliRNA induces transforming growth factor beta 1 secretion in hepatic stellate cells[J].Bosn J Basic Med Sci,2016,16(2):126-31.
[5] Kim J K,Jin H S,Suh H W,et al. Negative regulators and their mechanisms in NLRP3 inflammasome activation and signalling [J].Immunol Cell Biol,2017,95:584-92.
[6] Rutanga J P, Nyirahabimana T. Clinical significance of molecular diagnostic tools for bacterial bloodstream infections:a systematic review[J].Interdiscip Perspect Infect Dis,2016,2016:6412085.
[7] Duan J,Xie Y,Yang J,et al. Variation of circulating inflammatory mediators inStaphylococcusaureusandEscherichiacolibloodstream infection[J].Med Sci Monit, 2016,22:161-71.
[8] Laupland K B. Incidence of bloodstream infection:a review of population-based studies[J].Clin Microbiol Infect,2013,19(6):492-500.
[9] Luo Y P,Jiang L,Kang K,et al.Hemin inhibits NLRP3 inflammasome activation in sepsis-induced acute lung injury, involving heme oxygenase-1[J].Int Immunopharmacol,2014,20(1):24-32.
[10] Huang Y,Zhou M,Li C, et al. Picroside II protects against sepsisviasuppressing inflammation in mice[J].Am J Transl Res, 2016,8(12):5519-31.
[11] 郭松喜,王 丹,刘春生,等.脓毒症实验动物模型的研究进展[J].中华肺部疾病杂志,2015,8(5):635-7.
[12] 吴 丹,周树生,刘 宝,等.金黄色葡萄球菌经静脉和腹腔诱导小鼠血流感染的炎症反应和病理变化[J].中国免疫学杂志,2016,32(4):556-62.
[13] Zhang W,Tao A,Lan T,et al.Carbon monoxide releasing molecule-3 improves myocardial function in mice with sepsis by inhibiting NLRP3 inflammasome activation in cardiac fibroblasts[J].Basic Res Cardiol,2017,112(2):16.
[14] 吴 丹,周树生,胡仕静,等.NLRP3炎性小体在金黄色葡萄球菌血流感染小鼠免疫反应中的作用[J].中国感染与化疗杂志,2016,16(4):411-8.
[15] Kang M J,Jo S G,Kim D J,et al.NLRP3 inflammasome mediates IL-1β production in immune cells in response toAcinetobacterbaumanniiand contributes to pulmonary inflammation in mice[J].Immunology,2017,150:495-505.
