芹菜素改善肥胖大鼠肾脏氧化应激损伤
2018-07-04陶小根叶山东
黄 斌,陶小根,陈 剑,陈 超,叶山东
近年来随着经济的发展和生活方式的改变,肥胖的发病率逐年增高,已成为研究的热点。肥胖不仅是2型糖尿病及高血压的独立危险因素,亦是慢性肾脏疾病的独立危险因素,在早期阶段表现为高滤过、高灌注和肾体积肥大,并可见微量白蛋白尿;随着病情的进一步发展分别表现为肥胖相关性局灶节段性肾小球硬化;最后均发展为终末期肾衰竭[1]。要防治肥胖引起的肾损害,应尽量在发病早期进行干预,延缓或阻断肾损害的进一步进展的通路。氧化应激是一种机体内的失平衡状态,越来越多的证据显示,高脂肪的饮食结构、脂肪组织的堆积可显著加重哺乳动物体内的氧化应激水平,从而对各组织细胞中的生物大分子造成氧化损伤[2]。在肥胖、高胰岛素血症、高脂血症等一些病理条件下,过量的活性氧(reactive oxygen species,ROS)或者减弱的抗氧化防御均导致机体内氧化应激形成,进而对损伤全身很多器官[3]。
芹菜素(apigenin)是一种天然的黄酮类化合物,具有低毒性和无诱变性等特点,近年来,大量研究[4-5]表明,芹菜素具有多项药理作用和生物学特性,主要包括抗癌、心脑血管保护作用、抗炎、抗氧化、抗病毒等作用。肥胖状态下,炎症因子的表达上调,而芹菜素则可以逆转这种现象,同时使单核细胞、巨噬细胞和成纤维细胞的TNF-α表达下调,并抑制NF-κB的活化[6]。该实验设计拟证实芹菜素改善肥胖大鼠肾脏中氧化应激、炎症代谢紊乱状态并进一步探讨其可能的作用机制。
1 材料与方法
1.1动物模型建立及干预方法4周龄雄性SD大鼠,由上海斯莱克实验动物中心提供。按随机数字表法分为对照组和高脂组。对照组予普通饲料(热量比:蛋白质26%,碳水化合物64%,脂肪10%),高脂组予高脂饲料(热量比:蛋白质14%,碳水化合物32%,脂肪54%)喂养。连续高脂喂养12周后,在高脂组筛选出造模成功的肥胖大鼠(体重较普食对照组增加20%以上),按随机数字表法随机分组:干预组(Apigenin组,n=5)、肥胖组(Obesity组,n=5)。另外,加上对照组(Con组,n=5),共3组。分别予以不同干预:① 对照组:0.9%生理盐水灌胃,连续4周;② 肥胖组:0.9%生理盐水灌胃,连续4周;③ Apigenin组:40 mg/(kg·d)芹菜素(0.9%生理盐水配制)灌胃,连续4周。
1.2大鼠组织标本留取大鼠完成各种干预48 h后,空腹12 h,以水合氯醛腹腔注射处死,留取血清以及双侧肾脏,立即液氮冷冻后保存于-80 ℃冰箱待测。
1.3免疫组化组织样本经PBS缓冲液漂洗后,4%多聚甲醛溶液固定。经梯度酒精脱水、二甲苯透明、石蜡包埋、切片、按免疫组化试剂盒染色、洗脱、透明、封片后镜检并在200倍显微镜视野下照相。
1.4Westernblot检测目的蛋白表达在冰上用匀浆器将肾脏组织打碎,提取总蛋白,并以BCA法测定蛋白浓度。进行10% SDS-PAGE凝胶电泳150 min,转至PVDF膜。室温下用7.5%脱脂牛奶封闭1 h,然后与相应抗体LC3B(杭州碧云天公司);SOD2、iNOS(美国abcam公司);p-P67、p-P65(美国Santa Cruz公司);Beclin1、β-actin(南京巴傲德公司)。4 ℃孵育过夜;次日以TBST缓冲液洗膜5次,每次间隔5~10min,与相应二抗孵育1 h;暗室中以ECL试剂显影(美国Millipore公司),应用image-pro plus6.0软件分析目的蛋白与内参β-actin灰度值后计算相对值,以相对值进行统计学比较。
1.5肾脏组织DHE探针染色新鲜肾脏组织取出后经OCT胶包埋后置于-20 ℃冰冻后制作冰冻切片,切片在室温、避光环境下与5 μmol/L二氢乙啶(DHE)探针溶液孵育30 min,孵育完成后,PBS缓冲液充分漂洗切片、晾干后,在荧光显微镜上以Zeiss 573~637 nm波长滤镜原位观察荧光信号。照片拍摄完成后,采用ImageJ (V1.48,USA) 软件进行分析。每一个肾脏样品,从制作切片到最后拍照,整个过程同步进行。

2 结果
2.1芹菜素对肥胖大鼠体重的影响肥胖以及其伴随而来的全身慢性低度炎症是引起全身代谢异常的重要原因。本实验高脂喂养12周成肥胖模型,再经过4周的芹菜素干预治疗后,相较肥胖组相比,芹菜素组体重有一定的下降趋势,但是差异无统计学意义[芹菜素组(508.33±34.30)g,肥胖组(536.00±40.65)g,t=1.80,P=0.096],见表1。
2.2芹菜素对肥胖大鼠肾脏代谢紊乱状态的影响细胞清除自由基的能力受损后导致ROS过量,引起氧化应激。为研究大鼠肾脏中的ROS含量,用O2-(ROS的一种)探针DHE对肾脏组织冰冻切片进行原位染色。结果显示,肥胖组大鼠肾脏荧光信号明显增强,而芹菜素治疗后的冰冻切片荧光信号显著减弱(图1)。这一结果表明,持续摄入芹菜素能够有效地减轻肥胖所导致的肾脏氧化应激。通过Western blot检测显示,肥胖可引起肾脏组织中p67phox、iNOS、p-p65的蛋白表达显著升高;SOD2明显下降,经过4周的芹菜素治疗之后,均出现不同程度的逆转(图2、表2)。以上结果均提示芹菜素可一定程度的改善肥胖引起的大鼠肾脏氧化应激以及炎症状态。
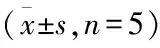
表1 芹菜素干预前后各组大鼠的体重变化
与对照组比较:*P<0.05

图1 肾脏组织切片DHE染色后荧光强度 ×200
A:对照组; B:肥胖组;C:干预组; D:IPP 6.0 软件程序用于图像荧光强度分析,与对照组比较:*P<0.05, 与肥胖组比较:#P<0.05
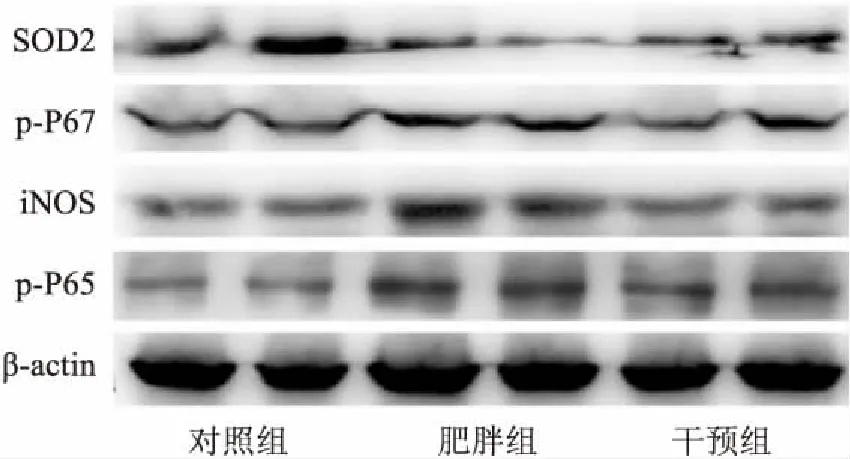
图2 芹菜素对肥胖大鼠肾脏代谢紊乱状态的影响
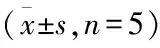
表2 各组大鼠肾脏相关蛋白表达比较
与对照组相比:*P<0.05;与肥胖组相比:#P<0.05
2.3芹菜素对肥胖大鼠肾脏自噬的影响作为自噬过程的标志性分子,与对照组大鼠相比,肥胖组肾脏中LC3Ⅱ/LC3Ⅰ、Beclin1蛋白含量并无明显变化。芹菜素治疗28 d后,两者表达显著上升(图3D、表2)。进一步通过免疫组化检测了LC3在肾脏中的表达,结果与Western blot的检测结论相一致(图3A、3B、3C),即芹菜素可激活肥胖大鼠肾脏中的自噬通路。
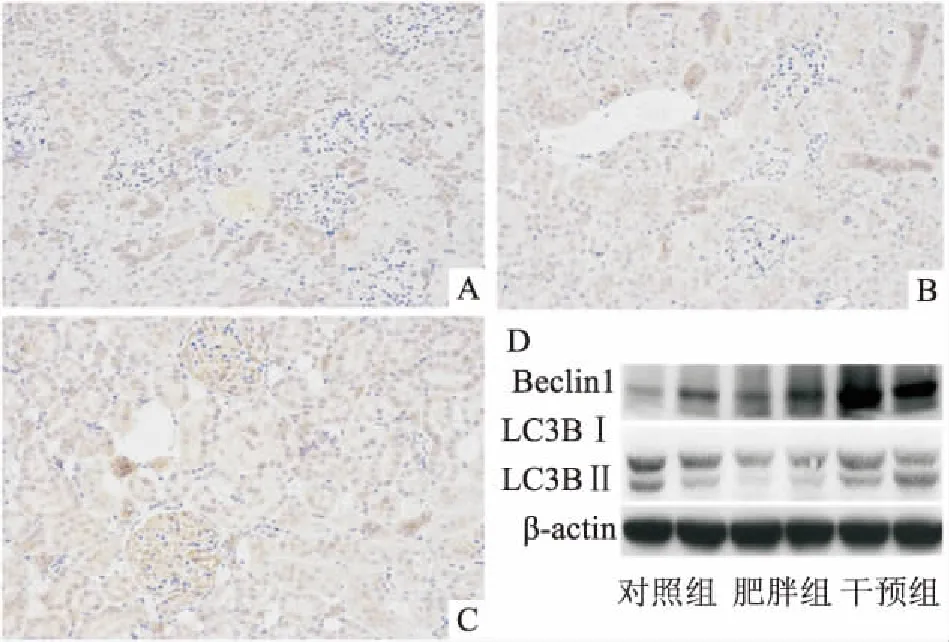
图3 芹菜素对肥胖大鼠肾脏自噬的影响 ×200
A:对照组的LC3免疫组化结果;B:肥胖组的LC3免疫组化结果;C:干预组的LC3免疫组化结果;D:Beclin1和LC3蛋白Western blot结果
3 讨论
现代社会久坐不动的生活方式以及高能量食物不断进入日常饮食中, 造成人体能量摄入过多诱发体重增加,导致肥胖症的发病率不断攀升。肥胖的迅速流行使其已经成为影响全球人口健康最主要的疾病之一[7]。流行病学调查显示,肥胖和超重与微量白蛋白尿显著相关[8]。有研究[9]认为 BMI 和肾脏病危险因素相关, BMI 增加使未来 20 年患肾脏病风险增加 20%。美国肾脏早期评估计划(KEEP)指出,肥胖是多种途径导致慢性肾脏病的疾病状态并且患者的肾脏损害与肥胖程度相关[10]。
肥胖被认为是一种系统性的亚急性炎症状态,肥胖机体低水平的内毒素血症、脂肪组织的局部炎症以及系统性炎症是肥胖相关疾病的共同驱动因素。大量研究[11]表明肥胖机体涉及抗氧化机制的损伤。芹菜素在过去的几十年里,其药理作用逐渐被揭示。众多研究[12]表明,芹菜素可通过抑制炎症因子释放、改善脂质紊乱、改善氧化应激等进而缓解各种疾病。肥胖病理条件下机体可产生过量的ROS,从而引起组织器官损伤,抗氧化防御系统则在预防该应激损伤中发挥着主要作用。为探究ROS的增加是否与机体降低的抗氧化能力有关,本研究检测了与ROS清除密切相关的重要抗氧化酶SOD2、p-P67的蛋白表达水平以及肾脏内的炎症状态指标iNOS、p-P65。实验结果提示芹菜素能明显改善肥胖引起的肾脏内氧化应激和炎症的增加,并且这种保护作用不依赖于降低机体的体重。
细胞自噬是从真核细胞到哺乳动物高度保守的重要亚细胞事件之一 ,当细胞处于应激情况下自噬过程可将胞内损伤蛋白或细胞器包裹形成自噬泡,之后与溶酶体融合降解其中生物大分子 ,进而重新被细胞利用。Lenoir et al[13]证实肾脏足细胞 Atg5 特异性敲除后,小鼠自噬功能减弱,使得高龄小鼠体内氧化蛋白蓄积,出现内质网应激和蛋白尿,最终导致足细胞损伤、 丢失及肾小球硬化。Kitada et al[14]发现2型糖尿病模型 Wistar 大鼠肾组织自噬通路受抑制,近端肾小管细胞出现线粒体损伤。Pallet et al[15]证实环孢素通过激活肾小管上皮细胞的自噬活性, 在环孢素处理早期自噬激活可起到保护肾小管上皮细胞的作用,减轻其对肾小管上皮细胞的毒性作用。在糖尿病肾病模型中,自噬活性较正常组明显下降,提示自噬可能参与糖尿病肾病的发生发展[16]。前人的研究结果均提示,自噬在肾脏功能的保护有一定的作用。近年来,芹菜素对自噬活性的提升尤其在炎症背景下逐步被人们揭示[17]。在本研究中,经过4周的芹菜素干预治疗肥胖大鼠肾脏内的自噬关键分子LC3、Beclin1的蛋白表达较肥胖组明显提升,LC3免疫组化也印证了Western blot结果。综上,芹菜素改善了肥胖导致的大鼠肾脏氧化应激、炎症增加,这种改善作用可能与激活自噬通路有关。
本研究肥胖组自噬活性较对照组差异并无统计学意义,一方面此批大鼠成模率较低,可能其对肥胖的耐受性较好,故体内的炎症损伤的强度尚不足以出现引起自噬抑制;另一方面实验模拟的是肥胖早期状态,肥胖组大鼠成模时间短,故体内的炎症持续时间亦较短,延长肥胖成模时间,自噬通路可能会较对照组出现显著的变化。
[1] Chang Y, Ryu S, Choi Y, et al. Metabolically healthy obesity and development of chronic kidney disease: a cohort study[J]. Ann Intern Med, 2016,164(5): 305-12.
[2] Li W, Wang L, Huang W, et al. Inhibition of ROS and inflammation by an imidazopyridine derivative X22 attenuate high fat diet-induced arterial injuries[J]. Vascul Pharmacol, 2015, 72: 153-62.
[3] Tominaga T, Dutta R K, Joladarashi D, et al. Transcriptional and translational modulation of myo-Inositol oxygenase (Miox) by fatty acids: implications in renal tubular injury induced in obesity and diabetes[J]. J Biol Chem, 2016, 291(3): 1348-67.
[4] Vallianou N G, Evangelopoulos A, Schizas N, et al. Potential anticancer properties and mechanisms of action of curcumin[J]. Anticancer Res, 2015, 35(2): 645-51.
[5] Ghosh S, Banerjee S, Sil P C. The beneficial role of curcumin on inflammation, diabetes and neurodegenerative disease: A recent update[J]. Food Chem Toxicol, 2015, 83: 111-24.
[6] Maradana M R, Thomas R, O'Sullivan B J. Targeted delivery of curcumin for treating type 2 diabetes[J]. Mol Nutr Food Res, 2013, 57(9): 1550-6.
[7] Chaput J P, Tremblay A. Obesity and physical inactivity: the relevance of reconsidering the notion of sedentariness[J]. Obes Facts, 2009, 2(4): 249-54.
[8] Sujanitha V, Sivansuthan S, Selvakaran P, et al. Overweight, obesity and chronic complications of diabetes mellitus in patients attending Diabetic Centre, Teaching Hospital, Jaffna, Sri Lanka[J]. Ceylon Med J, 2015, 60(3): 94-6.
[9] Cao X, Zhou J, Yuan H, et al. Chronic kidney disease among overweight and obesity with and without metabolic syndrome in an urban Chinese cohort[J]. BMC Nephrol, 2015, 16: 85.
[10] Bomback A S, Kshirsagar A V, Whaley-Connell A T, et al. Racial differences in kidney function among individuals with obesity and metabolic syndrome: results from the Kidney Early Evaluation Program (KEEP)[J]. Am J Kidney Dis, 2010, 55(3 Suppl 2): S4-14.
[11] Pereira S S, Alvarez-Leite J I. Low-Grade inflammation, obesity, and diabetes[J]. Curr Obes Rep, 2014, 3(4): 422-31.
[12] Maithilikarpagaselvi N, Sridhar M G, Swaminathan R P, et al. Preventive effect of curcumin on inflammation, oxidative stress and insulin resistance in high-fat fed obese rats[J]. J Complement Integr Med, 2016,13(2):137-43.
[13] Lenoir O, Jasiek M, Henique C, et al. Endothelial cell and podocyte autophagy synergistically protect from diabetes-induced glomerulosclerosis[J]. Autophagy, 2015, 11(7): 1130-45.
[14] Kitada M, Takeda A, Nagai T, et al. Dietary restriction ameliorates diabetic nephropathy through anti-inflammatory effects and regulation of the autophagyviarestoration of Sirt1 in diabetic Wistar fatty (fa/fa) rats: a model of type 2 diabetes[J]. Exp Diabetes Res, 2011, 2011: 908185.
[15] Pallet N, Livingston M, Dong Z. Emerging functions of autophagy in kidney transplantation[J]. Am J Transplant, 2014, 14(1): 13-20.
[16] 李治国, 张浩军, 董 晞, 等. 糖尿病肾病模型大鼠中存在蛋白降解途径失调[J]. 中华肾脏病杂志, 2011, 27(9): 656-61.
[17] Li F, Lang F, Zhang H, et al. Apigenin alleviates endotoxin-induced myocardial toxicity by modulating inflammation, oxidative stress, and autophagy[J]. Oxid Med Cell Longev, 2017, 2017: 2302896.
