不同基质溶液与渗透压对PEG沉淀血清循环免疫复合物的影响*
2018-07-03徐国萍孙长贵戴玉柱
徐国萍,成 军,孙长贵,戴玉柱
(1.杭州江干区人民医院检验科,杭州 310016;2.解放军第一一七医院检验科,杭州 310013)
血清循环免疫复合物(circulating immune complex,CIC)在多种疾病的发生、发展中起到了非常关键的作用,因此临床实验室出现了大批关于CIC检测的方法[1~3]。依据检测方法的特异性,将CIC检测方法分为特异性方法和非特异性方法两大类[4~6]。而聚乙二醇(PEG)沉淀法既可用于非特异性的方法检测(分光光度计检测吸光度),也可用于特异性方法的前处理(CIC浓缩或CIC与血清基质分离)。PEG为一种不带电荷的直链大分子多糖,主要通过促进CIC聚合成更大的凝聚物而使之被沉淀,PEG沉淀法因方法简便、快速、重复性好,在临床实验室被广泛用于病原体及血清CIC的分离与浓缩。国内外的文献均对PEG沉淀法的温度、离心力、时间等要素进行了优化和明确[5,7],但PEG沉淀法所用溶液基质、离子强度以及渗透压的选择对沉淀效果的影响,则未见相关报道。本文在PEG沉淀法常见的影响因素下,结合我们自主研发的特异性免疫复合物缓冲解离技术,提出了溶液基质、离子强度及渗透压对PEG沉淀法分离血清CIC的影响。具体如下:
1材料与方法
1.1 标本来源 335份五种乙肝血清标志物模式(HBV-M)标本来自于健康体检者、本院住院传染病科、浙江大学附属第一医院传染病中心住院病人,其中100份HBV-M-1标本(健康体检者,阴性对照组):HBsAg,anti-HBs,HBeAg,anti-HBe,anti-HBc均阴性;42份HBV-M-2标本:HBsAg,HBeAg和anti-HBc阳性,117份HBV-M-3标本:HBsAg,anti-HBe和anti-HBc阳性;30份HBV-M-4标本:HBsAg,anti-HBc阳性;46份HBV-M-5标本:anti-HBs,anti-HBe,anti-HBc阳性。
1.2 试剂和仪器 制备HBsAg-anti-HBsAg免疫复合物(HBsAg-CIC),其中HBsAg纯化抗原(3.0 mg/ml)购于以色列Prospec公司;羊-抗HBsAg多克隆抗体(3.0 mg/ml)购于北京博奥森生物技术有限公司;聚乙二醇(PEG 6000)、硼酸(H3BO3)、硼砂(Na2B4O7)、磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钠(NaH2PO4·2H2O)、氯化钠(NaCl)、氟化钠(NaF)购置于成都科龙化工;巴比妥钠(C8H11N2NaO3)购于华中海威基因有限公司;浓盐酸(HCl)购于兰溪六洞山化工。上海精宏DK-8D型水浴箱,上海精科UV-721型分光光度计,德国原装赛多利PP-50型pH计,德国艾卡C-MAG HS型磁力混匀器,德国艾本德5804 R型高速离心机,德国高能泰克osmomat 030型冰点渗透压仪,美国雅培诊断i2000型化学发光免疫分析仪及配套HBsAg检测试剂盒。
1.3 方法
1.3.1 HBsAg-抗HBsAg免疫复合物制备:在美国雅培公司i2000化学发光免疫分析仪及配套HBsAg试剂检测在线性范围内按照合适的比例配制HBsAg-CIC,用HBV-M均阴性的混合人献血员血清作为稀释剂稀释纯化的人血HBsAg至200 IU/ml(制备的HBsAg量),然后加入羊抗-HBsAg多克隆抗体直至游离HBsAg检测结果<1.5 IU/ml,游离抗体<15 IU/ml为止,37℃水箱放置2 h,然后放4℃冰箱过夜,即形成稳定的HBsAg-CIC,精确计算HBsAg终浓度为193.6 IU/ml,每升复合物制备溶液中加入0.2 ml proclin 300生物防腐剂后分装4℃保存备用。
1.3.2 免疫复合物分离:依据参考文献[5]选择70 g/L PEG 6000沉淀剂,4℃沉淀24 h,离心力为18 009×g离心10 min,对不同基质溶液、离子强度及渗透压进行多因素正交设计分组,各基质溶液的配置依据专利及参考文献[5,8,9]。①基质溶液浓度:0.10 mol/L,0.15 mol/L,0.20 mol/L;②不同基质溶液:硼酸盐缓冲液(BB)、磷酸盐缓冲液(PBS)、巴比妥钠-HCl缓冲液(Barbital -HCl),Tris-HCl缓冲液;③基质溶液渗透压:400 mOsm/kg,500 mOsm/kg,600 mOsm/kg,700 mOsm/kg;④基质溶液pH值:7.8,8.0,8.2,8.4。
1.3.3 免疫复合物传统法(传统PEG沉淀法)[10]与改良法[5](优化后的PEG沉淀分离法)的分离结果比较:传统法和改良法分离待测样本HBsAg-CIC沉淀各两份分别设空白管(未解离HBsAg测定值)和测定管(解离后HBsAg测定值)。分离后沉淀,按照我们自主研发的专利技术[8,9](专利号:ZL201410034039.5,ZL201410033277.4)对分离出的CIC进行解离,解离后使用化学发光定量检测游离HBsAg量,来计算免疫复合物量即解离率。空白对照管未解离的游离HBsAg测定:向空白对照管中同时加入CIC抗原缓冲解离剂和CIC抗原缓冲解离中和剂,混匀后采用Abbott i2000分析仪及配套试剂检测HBsAg,其结果作为空白值;测定管解离后的总游离HBsAg测定:向测定管中加入抗原缓冲解离剂,置42℃水浴振荡30 min(振荡频率60次/min);抗原缓冲解离中和剂,混匀后采用Abbott i2000分析仪及配套试剂2 h内检测HBsAg,其结果作为测定值(HBsAg-CIC=测定管HBsAg测定值-空白管HBsAg空白值)。
1.4 结果判断 HBsAg-CIC结果判断标准见表1。

表1 解离测定CIC中抗原结果判断标准
注:*Abbott i2000免疫分析仪的HBsAg Cutoff=0.05 IU/ml。
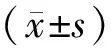
2结果
2.1 PEG沉淀法中不同基质、浓度、pH值、渗透压条件优化 见表2。通过采用正交设计对PEG各影响因素的优化比较发现:在这已知四个影响因素中,按照其对沉淀效果的影响大小依次为:溶液渗透压>基质溶液种类>溶液pH值>溶液浓度,通过四因素四水平的比较,得到PEG优化后改良法的最佳分离溶液体系:0.15 mol/L,pH 8.2,500 mOsm/kg的硼酸盐缓冲液含70 g/L PEG6000。
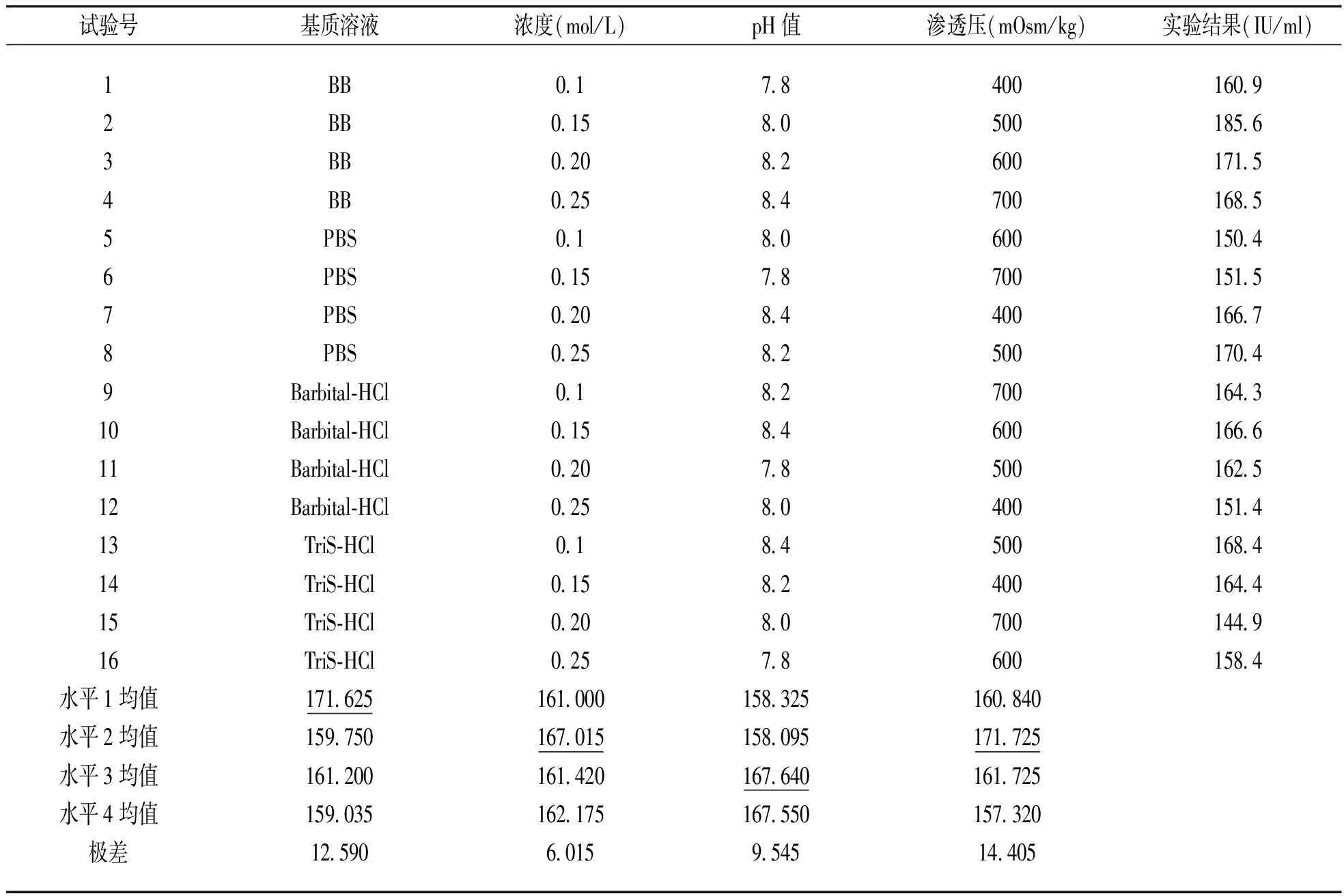
表2 不同基质、浓度、pH值、渗透压条件优化正交设计结果
注:表中加下划线数据为该因素中分离效果最佳的水平。
2.2 传统法与改良法分离结果比较 见图1。通过将传统法与改良法的前处理结果进行比较可知:在乙肝感染不同的HBV-M中,HBV-M2模式中的HBsAg-CIC阳性率最高,其次为HBV-M3模式,HBV-M1的HBsAg-CIC阳性率最低;图中乙肝各模式下经改良法前处理的HBsAg-CIC检出率明显高于传统法,其中HBV-M1为不存在HBsAg-CIC,所以两者无可比性。
由表3可知:改良法和传统法同时运用在乙肝不同模式下,改良法沉淀的HBsAg-CIC的量高于传统法,且在HBV-M 2,3,4中差异存在统计学意义(t=-5.66,-12.60,均P<0.05),另外在HBV-M 1,5模式中,两者差异无统计学意义(t=-0.775~-1.77,均P>0.05)。
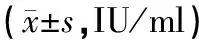
表3 不同HBV-M模式采用传统法与改良法的分离HBsAg含量比较
注:HBV-M-1:HBsAg,anti-HBs,HBeAg,anti-HBe,anti-HBc均阴性;HBV-M-2:HBsAg,HbeAg,anti-HBc阳性;HBV-M-3:HBsAg,anti-HBe,anti-HBc阳性;HBV-M-4:HBsAg,anti-HBc阳性;HBV-M-5:anti-HBs,anti-HBe,anti-HBc阳性。

图1 不同HBV-M模式采用传统法与改良法HBsAg-CIC阳性率(%)
3讨论抗原进入机体或自身抗原刺激(抗原变性、隐蔽性抗原释放),能诱发机体产生细胞及体液免疫应答,产生大量针对相关抗原的抗体,致使抗原与抗体形成免疫复合物[1~3]。部分抗原形成免疫复合物被清除,但在某些情况下,当抗原在体内持续存在或者机体清除抗原抗体复合物的功能受损时,免疫复合物可在机体的特定部位引起损害,导致急性炎症、慢性炎症、甚至变性坏死[11]。乙型肝炎在我国病毒性肝病中,患病比例最高,而且多数处于慢性化,病毒长期与宿主共存,难以完全清除,其中HBsAg-CIC在乙型肝炎引起肝病发生、发展中具有重要的作用[12,13]。PEG沉淀法检测免疫复合物,因其敏感度及特异度问题,在目前实验室逐渐被抗抗体法、补体法等相对特异的方法所取代。而PEG沉淀CIC法,在临床及基础实验室仍然被广泛用于各类CIC的分离及病原体核酸浓缩。本文围绕PEG沉淀法分离血清HBsAg-CIC这一主题,对该分离方法的实验过程进行优化,以提高分离效果。
由表2可知,除了PEG的浓度、沉淀时间以及离心力外,本文讨论的沉淀分离所受影响因素,其重要性依次为:渗透压>基质溶液>pH值>浓度,其中渗透压为主要因素,提示适当的提高渗透压有助于免疫复合物的有效分离,过高或者过低则影响CIC的分离。分析原因:适当的高压减少CIC处于悬浮状态,并且可使CIC的空间结构发生改变有利于CIC分离。当渗透压过低时,悬浮状态CIC过多导致最后的沉淀离心,无法将CIC沉淀完全。当渗透压过高时,CIC及其内部的抗体空间结构发生严重的改变,致使用其他特异性方法去检测时,CIC中的检测位点无法充分暴露,反而降低了检测效果致使检测能力下降。其次是基质溶液,我们在选择不同的基质时存在明显的差异,其中BB缓冲液与PBS缓冲液差异小,而使用巴比妥缓冲液与Tris-HCl作为基质溶液分离效果明显下降,这可能是不同的基质体系,即使是pH值一致,可其内部的缓冲离子量不同,导致分离效果存在差异。pH值单独作为影响因素和不同基质溶液是分不开的,不同的pH值在某种程度上也就决定了其缓冲能力的大小。溶液浓度影响最小,本文研究的均为缓冲体系,所以在一定的浓度范围内变化,基质溶液仍然呈现缓冲体系。
由表3和图1可知在乙肝不同模式下,HBsAg-CIC的阳性率不同,其中阳性率最高的是HBV-M2(HBsAg,HbeAg,anti-HBc阳性),最低的是HBV-M1 (HBsAg,anti-HBs,HBeAg,anti-HBe,anti-HBc均阴性),改良法的阳性率要高于传统法,另外改良法(HBV-M 2,3,4)分离的HBsAg-CIC量要高于传统法,且差异具有统计学意义(P<0.05),在HBV-M5中因为本研究收集的样本例数少,所以差异未能比较出统计学意义(P>0.05),由此说明在HBV疾病发生发展的不同阶段其HBsAg-CIC含量不尽相同,其形成机制和致病机理还不十分明确,有待下一步研究证明。
综上所述,PEG沉淀免疫复合物法,不仅要考虑到PEG浓度、离心力以及放置时间的因素,同时要考虑基质溶液渗透压、基质溶液种类、不同pH值和基质溶液浓度等因素。改良法PEG沉淀效果明显优于传统方法,为进一步研究HBsAg-CIC在HBV感染不同阶段的致病机理提供了一个可靠的技术手段,同时对于各类病原体或自身抗原所致疾病中形成的CIC研究工作提供了新思路。
参考文献:
[1] Murphy K,Travers P,Walport M.Janeway’s immunobiology[M].8th Ed.Garland Publishing Inc,2012.
[2] Iwasaki A,Medzhitov R.Control of adaptive immunity by the innate immune system[J].Nat Immunol,2015,16(4):343-353.
[3] Rojko JL,Evans MG,Price SA,et al.Formation,clearance,deposition pathogenicity and identification of biopharmaceutical-related immune complexes:review and case studies[J].Toxicol Pathol,2014,42(4):725-764.
[4] Takeda K,Maruki M,Yamagaito T,et al.Highly sensitive detection of hepatitis B virus surface antigen by use of a semiautomated immune complex transfer chemiluminescence enzyme immunoassay[J].J Clin Microbiol,2013,51(7):2238-2244.
[5] Dai Y,Hu Z,Chen Y,et al.A novel general and efficient technique for dissociating antigen in circulating immune complexes[J].Electrophoresis,2018,39(2):406-416.
[6] Moore TL.Immune complexes in juvenile idiopathic arthritis[J].Front Immunol,2016(7):177.
[7] Reshetnyak T,Alexandrova EN,Seredavkina NV,et al.AB0434 antibody to dsdna (anti-dsdna),circulating immune complex (cic) in systemic lupus erithematosus (sle) and antiphospholipid syndrome (aps)[J].Ann Rheum Dis,2013,72(suppl 3):A921.
[8] 成 军,戴玉柱,闫 利,等.一种免疫复合物缓冲解离剂及其应用,中国专利:ZL 2014 10033277.4[P].2016-4-6.
Cheng J,Dai YZ,Yan L,et al.An immune complex dissociation buffer agent and its application,CN:ZL 2014 10033277.4[P].2016-4-6.
[9] 成 军,孙长贵,戴玉柱,等.一种用于免疫复合物缓冲解离剂的CIC复溶剂,中国专利:ZL2014100340 39.5[P].2016-4-6.
Cheng J,Sun CG,Dai YZ,et al.An immune complex dissociation buffer agent CIC complex solvent,CN:ZL201410034039.5[P].2016-4-6.
[10] 管晓龙,王海永,周 莹,等.类风湿关节炎血清免疫复合物的质谱鉴定与差异蛋白分析[J].医学研究生学报,2017,30(5):495-501.
Guan XL,Wang HY,Zhou Y,et al.Differentially expressed proteins in serum immune complexes of rheumatoid arthritis:Analysis by mass spectrometry[J].Journal of Medical Postgraduates,2017,30(5):495-501.
[11] Sobenin IA,Salonen JT,Zhelankin AV,et al.Low density lipoprotein-containing circulating immune complexes:Role in atherosclerosis and diagmostic value[J].Bio Med Res Int,2014(2014):205697.
[12] Yao X,Wang X,Zhao C,et al.Transcriptional analysis of immune-related genes in dendritic cells from hepatitis B surface antigen (HBsAg)-positive transgenic mice and regulation of Fc gamma receptor IIB by HBsAg-anti-HBs complex[J].J Med Virol,2011,83(1):78-87.
[13] Takeda K,Maruki M,Yamagaito T,et al.Highly sensitive detection of hepatitis B virus surface antigen by use of a semiautomated immune complextransfer chemiluminescence enzyme immunoassay [J].J Clin Microbiol,2013,51(7):2238-2244.
