一起规模猪场胸膜肺炎放线杆菌的分离鉴定及药敏试验
2018-07-03,,,,,,,,,,
, ,,,, ,,,,,
(浙江省动物疫病预防控制中心,浙江 杭州 310018)
胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)是猪胸膜肺炎的病原菌,为一种革兰氏阴性、有荚膜、具有典型球杆菌形态的小杆菌。根据是否需要NAD(烟酰胺腺嘌呤二核苷酸),将其分为生物I型(依赖于NAD)和生物II型(不依赖于NAD)。生物I型在葡萄球菌菌落周围形成菌落呈“卫星”状,培养24 h后形成0.5~1 mm菌落,用绵羊血制成的血平板上出现β溶血现象。临床上引发猪放线杆菌胸膜肺炎(porcine contagious pleuropneumia,PCP)的主要是生物I型,该型细菌有13个血清型(1~12,15)[1-2]。1987年杨旭夫等首次证实了我国存在猪传染性胸膜肺炎,其后几年该病在我国的发病率显著上升,并在我国许多地区呈流行趋势,对集约化养猪业的发展造成了很大的威胁[3-5]。本次实验对浙江省杭州市萧山区某规模猪场发病猪舍的4头保育猪病料样品进行细菌分离鉴定,并对分离株进行药物敏感性试验,为该猪场有效防控猪病提供科学依据。
1 材料与方法
1.1材料
1.1.1仪器设备 TissueLyserⅡ组织匀浆机、Thermo LH11 CO2培养箱、蔡司(ZEISS)Scope.A1显微镜、Thermo 1300 SERIES A2生物安全柜、Eppendorf移液器、Eppendorf恒温混匀仪、Eppendorf 5424离心机、罗氏LightCycler®480Ⅱ实时荧光PCR仪。
1.1.2培养基和试剂 血琼脂平板购自郑州安图生物工程股份有限公司;胰蛋白胨大豆琼脂(TSA)和革兰氏染色液试剂盒购自青岛高科技工业园海博生物科技有限公司;金黄色葡萄球菌、胸膜肺炎放线杆菌标准菌株购自中国兽医药品监察所;药敏纸片购自杭州滨和微生物试剂有限公司;Ex Taq酶购自TaKaRa;QIAamp®DNA纯化试剂盒-Mini购自QIAGEN;引物和探针由上海生工公司合成。
1.1.3样本来源 2017年12月13日,采集浙江省杭州市萧山区某规模猪场4头发病保育猪的肺脏,分别编号为肺1、肺2、肺3、肺4。
1.2方法
1.2.1细菌分离 无菌操作法切开病变组织,用接种环刮取病料接种于血平板,再用金黄色葡萄球菌作交叉划线,于37℃、含5% CO2条件下培养24 h。
1.2.2细菌鉴定 于血平板上培养18~24 h,观察菌落形态。挑取可疑菌落作革兰氏染色,油镜下观察细菌形态及染色情况。
1.2.3V因子需要测定 将可疑菌株纯培养物接种于血平板,方法同1.2.1。
1.2.4过氧化氢酶试验 在洁净的载玻片上滴1滴3%的H2O2溶液,用接种环挑取适量的可疑菌在H2O2溶液中混匀,观察是否有气泡产生。
1.2.5荧光定量PCR检测 根据Tobias TJ等[6]的方法,合成一对特异性引物及探针。上游:GGG GAC GTA ACT CGG TGA TT,下游:GCT CAC CAA CGT TTG CTC AT,探针:CGG TGC GGA CAC CTA TAT CT。用DNA纯化试剂盒提取待检胸膜肺炎放线杆菌可疑菌株和胸膜肺炎放线杆菌标准菌株核酸分别作为定量PCR的模板和阳性对照。扩增体系:Taq酶0.12 μL,dNTPs 2 μL,上下游引物各0.2 μL,探针0.2 μL,10×buffer 2 μL,ddH2O 10.28 μL,DNA模板5 μL。按照以下程序进行扩增:95℃预变性2 min;98℃变性10 s,56℃退火30 s,72℃延伸30 s,40个循环;72℃延伸5 min。
1.2.6药敏试验 按照NCCL推荐的K-B纸片琼脂扩散法,选用临床上常用药物分别对分离纯化的菌株进行药敏试验。用无菌生理盐水将待检菌株制成0.5麦氏单位菌悬液,含菌量在5×107~5×108,用灭菌棉签拭子浸入细菌悬液中,在管壁挤去多余菌液,然后均匀涂布在90 mmTSA琼脂平板上,室温静止3~5 min后,无菌操作将药敏纸片均匀贴在上述TSA平板上,37℃ 5% CO2培养48 h,用游标卡尺测量抑菌圈直径,判断待检菌株对各种药物的敏感性[7]。
2 结果
2.1细菌分离结果 肺4分离到胸膜肺炎放线杆菌可疑菌株,编号为ZJYK-01226,其他病料(肺1、肺2和肺3)未发现胸膜肺炎放线杆菌可疑菌落。
2.2细菌形态学检查结果
2.2.1菌落形态 在血平板培养24 h后,菌落呈露珠样小菌落,呈β溶血,菌落直径0.5 mm~1 mm。靠近金黄色葡萄球菌菌苔的菌落较大,随着与葡萄球菌生长线的距离增加而变小或不生长。
2.2.2细菌形态 涂片作革兰氏染色后,镜检为革兰氏阴性短小杆菌。
2.3V因子需要测定结果 可疑菌株(ZJYK-01226)在血平板上生长有“卫星现象”,表明该菌株需要V因子(图1)。

图1 可疑菌株生长呈“卫星现象”
2.4过氧化氢酶试验结果 ZJYK-01226菌株过氧化氢酶试验结果为阳性。
2.5荧光定量PCR检测结果 对ZJYK-01226菌株进行荧光定量PCR检测,结果为胸膜肺炎放线杆菌阳性(表1、图2)。
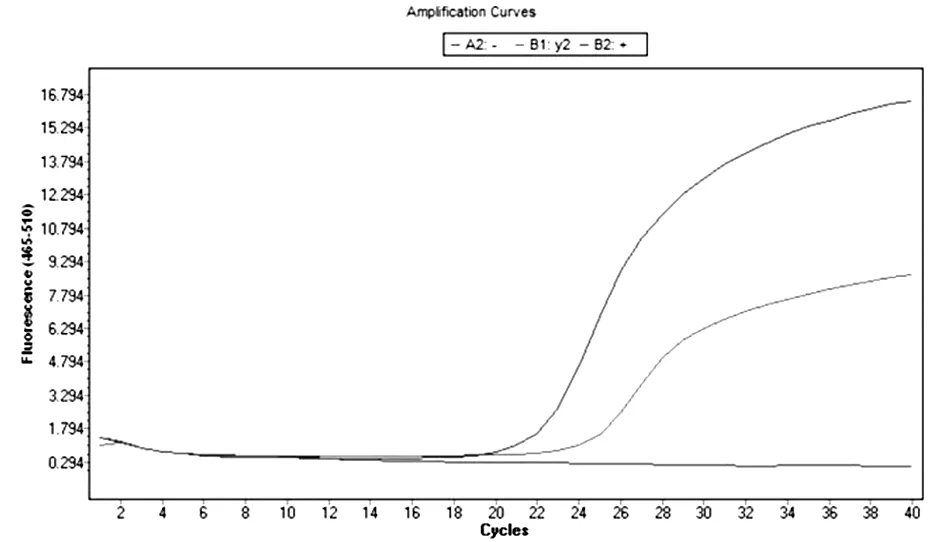
图2 ZJYK-01226菌株荧光定量PCR检测结果

表1 可疑菌株荧光定量PCR检测结果
综合分析ZJYK-01226菌株的菌落形态、生长特性、细菌形态学检查情况和荧光定量PCR检测结果,可以判定该菌株为胸膜肺炎放线杆菌。
2.6药敏试验结果 ZJYK-01226菌株对头孢噻肟、氟苯尼考、氨曲南、头孢呋辛、头孢哌酮等药物敏感;对复方新诺明、链霉素等药物中敏;对青霉素、卡那霉素、四环素、替米考星耐药(表2)。
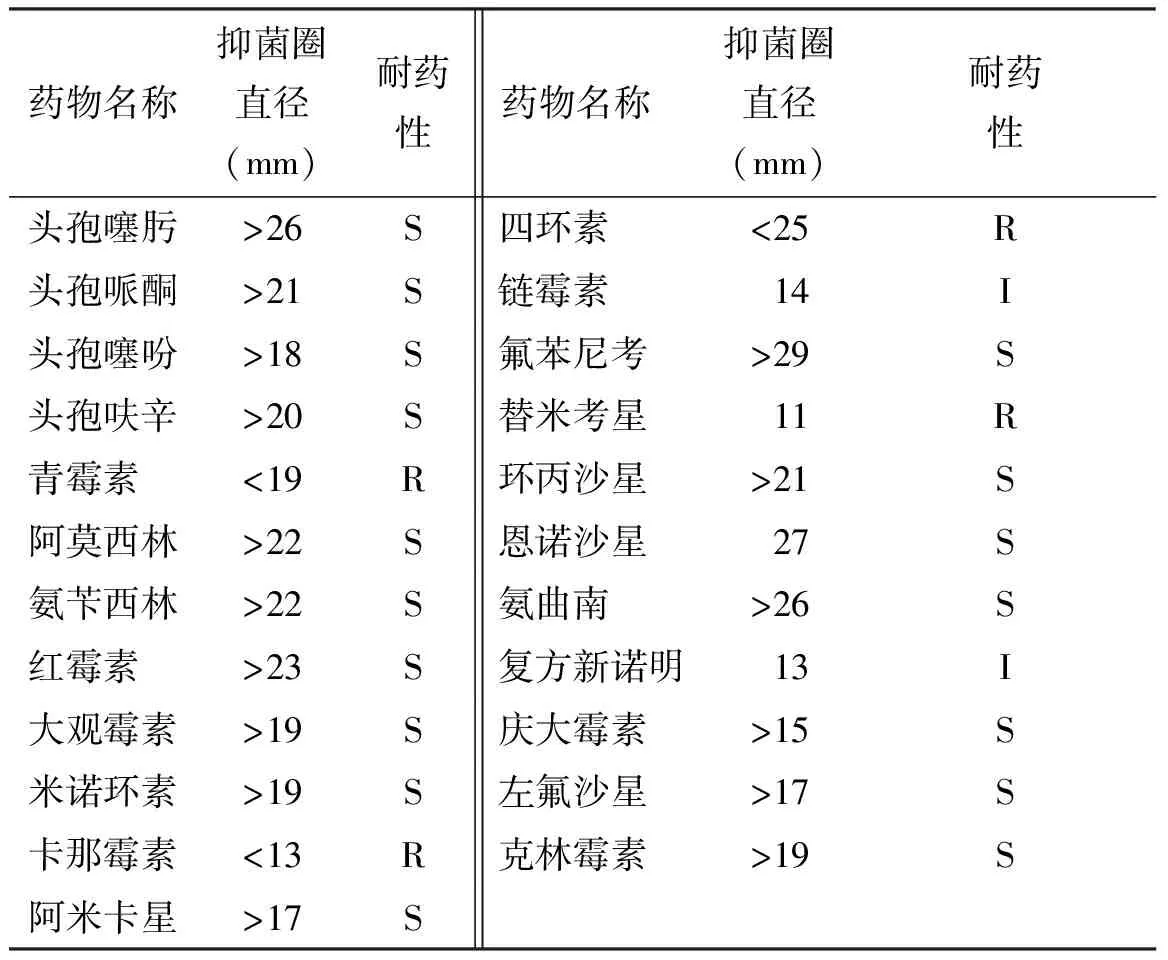
表2 ZJYK-01226菌株药敏试验结果
注:S-敏感;I-中介;R-耐药,不同药物判定标准不同。
3 讨论
胸膜肺炎放线杆菌虽分布广泛,但且仅感染猪。感染病原主要存在于慢性肺损伤和扁桃体中,很少在鼻腔中分离到。猪群间的传播主要通过引入携带病原的动物,传播的主要途径是猪与猪的直接接触或通过短距离的飞沫传播。在地方性传染的畜群中,感染母猪可以通过垂直传播把该病传染给后代,传染的概率可能取决于母猪鼻腔分泌物中的细菌含量和仔猪体内的母源抗体水平。母源抗体可持续2周到2个月[1]。在初次分离胸膜肺炎放线杆菌时,尽量选择病变的肺脏或扁桃体病料,这样可以提高分离率。在初分离时利用该菌在血平板上的“卫星现象”特点,选择可疑菌落是该菌分离的关键步骤。
在 PCP的防控中,对没有感染胸膜肺炎放线杆菌的畜群应严格执行生物安全措施,对畜群而言最大的危险是引进潜在的感染猪,应该从没有发生过胸膜肺炎放线杆菌的地区或血清型阴性的地区引进畜种,新引进的动物应进行隔离和血清学检测。感染胸膜肺炎放线杆菌的猪场爆发胸膜肺炎时,首先应通过治疗控制感染动物的死亡率,继而通过控制环境因素、实行全进全出制度、较早的断奶日龄(少于21 d)等措施,降低发病率,减少损失。
值得注意的是胸膜肺炎放线杆菌也是猪呼吸道疾病综合征(PRDC)的病原体之一[8],该猪场存在PRRS、猪瘟、沙门氏菌、猪圆环病毒2型混合/继发感染,而胸膜肺炎放线杆菌感染是导致育肥猪群发生急性呼吸道感染爆发的最常见原因。抗生素防治是控制保育阶段副猪嗜血杆菌、猪肺炎支原体、胸膜肺炎放线杆菌等细菌继发/混合感染的有效手段,也是防控育成阶段猪传染性胸膜肺炎的有效措施,是减少猪群死淘率的重要措施。由于胸膜肺炎放线杆菌较易产生耐药性,且不同地区的APP分离株对药物的敏感性存在一定的差异。本次药敏试验结果对该发病猪场选择敏感药物提供了依据。
[1] 齐默尔曼(Jeffrey J.Zimmerman)等主编;赵德明等主译.猪病学(第10版)[M].中国农业大学出版社,2014:681-692.
[2] Reiner G, Fresen C, Bronnert S, Haack I, Willems H. Prevalence of Actinobacilluspleuropneumoniae infection in hunted wild boars (Susscrofa) in Germany [J].J Wildl Dis,2010,46(2):551-555.
[3] 杨旭夫,彭发泉.胸膜肺炎嗜血杆菌的分离和鉴定[J].中国畜禽传染病,1990(4):1-3.
[4] 谢艳霞,周学利,沈学怀,等.猪传染性胸膜肺炎在保育猪中的流行病学调查[J].农业灾害研究,2016,6(6):52-53.
[5] 郭志英,李郁,吴浩阳,等.猪胸膜肺炎放线杆菌的分离鉴定及其生物学特征的研究[J].中国兽医科学,2016,46(9):1102-1109.
[6] Tobias TJ, Bouma A,Klinkenberg D,et al. Detection of Actinobacilluspleuropneumoniae in pigs by real-time quantitative PCR for the apxIVA gene[J].Vet J,2012,193(2):557-560.
[7] 张东超,杨宁宁,林静,等.猪传染性胸膜肺炎放线杆菌的分离鉴定及药敏试验[J].中国畜牧兽医,2016,43(6):1604-1609.
[8] Fablet C, Marois-Créhan C,Simon G,et al.Infectious agents associated with respiratory diseases in 125 farrow-to-finish pig herds: a cross-sectional study[J]. Vet Microbiol,2012,157(1-2):152-163.
