甲状腺素对大鼠心肌T型钙通道蛋白和mRNA的影响*
2018-07-02傅润熹杨若松黄雪琴何文明余莜燕韦登明
傅润熹,杨若松,黄雪琴,何文明,余莜燕,韦登明
(宁波大学医学院病理学系, 浙江 宁波 315211)
甲状腺功能亢进性心脏病(hyperthyroid heart disease,HHD)是由于过量分泌的甲状腺素对心脏产生直接或间接毒性而引起的心脏疾病,心肌肥大和心律失常是其主要临床表现[1-2]。细胞内 Ca2+平衡对维持正常心律起到关键作用,目前发现心脏中主要有两大类Ca2+通道,一类是高电压激活的L型Ca2+通道,另一类是低电压激活的T型Ca2+通道。T 型钙通道分为Cav3.1、Cav3.2和Cav3.3,其阈值为-70~-60 mV[3],在起搏细胞去极化和自律性中起到了关键的作用。T 型钙通道在胚胎期广泛分布于心脏各部位,成年后只在传导细胞中表达,心室肌中表达很少,但在病理状态下,例如急性心肌梗塞、升主动脉缩窄、严重缺氧和充血性心力衰竭状况下发现在心室肌中T型钙通道重新表达[4-6]。目前国内外尚未见HHD所致心律失常是否与心室肌细胞T型钙通道表达变化有关的研究报道。本研究在建立HHD大鼠模型基础上,检测心电图和心肌细胞T型钙通道Cav3.1、Cav3.2和Cav3.3的表达变化,旨在探讨T型钙通道表达变化与HHD心律失常发生的关系。
材 料 和 方 法
1 实验材料
健康清洁级SD大鼠20只由宁波大学实验动物中心代购于浙江省动物中心,合格证号No.0102016,体重(200±10) g,雄性。按随机数字表法分为正常对照(normal control)组和HHD组,每组10只。兔抗鼠Cav3.1和Cav3.2多克隆抗体(上海生物工程股份有限公司);兔抗鼠Cav3.3多克隆抗体(Abbkine);L-甲状腺素粉剂和羧甲基纤维素钠(Sigma);山羊抗兔 II 抗(中杉金桥有限公司);RNAfixer常温无液氮RNA样品储存液和高纯总RNA快速提取试剂盒(百泰克生物技术有限公司);RevertAidTMFirst Strand cDNA Synthesis Kit (Fermentas);兔抗鼠Cav3.1和Cav3.2抗体(Absin);抗β-actin抗体(Bioss)。BM-Ⅶ包埋机(宏业医用仪器公司);HM-325石蜡切片机(LEICA);CX40生物显微镜(Olympus);JD801形态学图像分析系统(江苏捷达科技发展有限公司);Centrifuge 5810R台式超高速低温离心机(Eppendorf);DYY-11B型三恒电泳仪(北京六一仪器厂);Molecular Image Gel Doc凝胶成像系统(Bio-Rad);RM6240生物信号采集系统。
2 实验方法
2.1动物模型的建立 参照文献方法[7-8]并进行改良,L-甲状腺素(0.1 g/L)混悬于5 g /L羧甲基纤维素钠,置于冰箱保存待用,使用前充分摇匀。甲亢性心脏病组大鼠每天腹腔注射L-甲状腺素0.5 mg/kg,连续35 d,对照组腹腔注射等体积的羧甲基纤维素钠溶液。所有大鼠均饲常规固体饲料及瓶装饮用水。
2.2标本采集与制取 L-甲状腺素给药35 d后,成功制备甲亢性心脏病大鼠模型,大鼠麻醉后开胸抽取心血5 mL,切取心脏,0.9%氯化钠溶液冲洗干净,称重。冠状面切取心脏,每只大鼠的左、右心房及左、右心室各切取组织3块,分别置于10%福尔马林中固定、-80 ℃冰箱及RNA保存液中保存。脱水浸蜡包埋后制成石蜡切片用于HE染色和免疫组织化学染色,-80 ℃保存的心肌组织用于Western blot检测蛋白,RNA保存液的心肌组织取材块用于RT-PCR检测mRNA。
2.3心电图检测 采用RM6240生物信号采集系统,10%水合氯醛麻醉大鼠,分别于右前肢、右后肢及左后肢皮下插入测量电极测量心电图,HHD组大鼠分别于动物模型造模前及连续腹腔注射L-甲状腺素35 d后2次测量心电图;正常组大鼠相同时间同样方法分别2次测量心电图。
2.4血清T3和T4含量的检测 提取血清5 mL,采用放射免疫分析法测定血清中T3和T4的含量,实验方法严格按照说明书操作。
2.5各组大鼠心脏指数检测 实验第1天,称取各组大鼠体重;实验第35天,称取各组大鼠体重和心脏质量。心脏指数(mg/g)=心脏重量/体重。
2.6左心室心肌细胞横径(left ventricular transdia-meter,LVTDM)测定 石蜡切片常规脱蜡,HE染色,400倍光镜下观察心肌细胞形态变化,选取边界清楚的心肌细胞,通过细胞核水平测量最短横径。每张切片选取5个视野,每个视野选取10个细胞,取平均值作为该动物的心肌细胞横径。
2.7免疫组化检测Cav3.1、Cav3.2和Cav3.3的表达 石蜡切片常规脱蜡,经3% H2O2室温孵育,0.01 mol/L枸橼酸溶液高温抗原修复,加入抗Cav3.1、Cav3.2和Cav3.3抗体免疫组化染色,苏木素复染脱水透明封片。Cav3.1和Cav3.3阳性细胞显示细胞浆出现棕黄色,Cav3.2阳性细胞显示细胞核出现棕色。400倍光镜下,每张切片随机选取5个视野检测,分别计算积分吸光度(IA)作为Cav3.1、Cav3.2和Cav3.3的阳性表达水平。
2.8Western blot检测Cav3.1和Cav3.2蛋白的表达 采用Western blot法测量Cav3.1和Cav3.2蛋白表达,以β-actin作为内参照。加适量RIPA裂解液冰上放置30 min,12 000×g、4 ℃离心35 min,提取心肌组织总蛋白。取5~10 μL上清液BCA法测定蛋白浓度,绘制标准曲线。每孔上样25 μg总蛋白,6% SDS-PAGE分离蛋白。100 V冰盒中湿转2 h转膜于PVDF膜上。5% BSA封闭液室温摇床封闭1 h,加入I 抗(1∶1 000)4 ℃摇床孵育过夜,加入HRP标记的II 抗(1∶2 000)室温摇床孵育1 h,ECL显色60 s,曝光。
2.9RT-PCR检测Cav3.1、Cav3.2和Cav3.3的mRNA表达 采用RT-PCR法测量Cav3.1、Cav3.2和Cav3.3的mRNA表达,以GAPDH作为内参照。常规TRIzol法提取总RNA,根据Fermentas逆转录试剂盒说明书将总RNA逆转录成cDNA,再进行PCR扩增检测。PCR反应体系:2×Power Taq PCR MasterMix 6 μL,cDNA 2 μL,上、下游引物各1 μL,双蒸水15 μL补足至25 μL。循环参数为94 ℃预变性3 min,进入PCR循环为94 ℃变性30 s、55 ℃退火60 s、72 ℃延伸45 s,循环35次;72 ℃退火7 min。以样品条带的IA与相应GAPDH条带IA的比值作为mRNA的丰度。

表1 RT-PCR引物序列Table 1. The sequences of the primens for RT-PCR amplification
F: forward; R: reverse.
3 统计学处理
采用SPSS 17.0软件进行统计分析。计量资料用均数±标准差(mean±SD)表示,组间比较采用t检验,计数资料组间比较采用2检验,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠血清T3、T4值
与正常对照组相比较,甲亢性心脏病大鼠血清T3和T4含量明显高于正常对照组(P<0.01),见表2。
表2各组大鼠血清T3和T4含量、心脏指数及左心室心肌细胞横径的比较
Table 2. The serum contents of T3 and T4, the heart-to-body weight ratio and the transdiameter of left ventricular myocardial cells (LVTDM) (Mean±SD.n=10)

GroupT3 (nmol/L)T4 (nmol/L)Heart/body weight ratio (mg/g)LVTDM (μm)Normal control0.82±0.29157.06±32.553.96±0.3311.56±1.52HHD1.43±0.33∗∗206.71±16.03∗∗5.36±0.93∗18.35±1.98∗∗
*P<0.05,**P<0.01vsnormal control group.
2 各组大鼠心电图检查结果
正常对照组大鼠分别于动物模型造模前、后检测心电图结果均正常;HHD组动物模型造模前心电图检测结果均正常,连续腹腔注射L-甲状腺素35 d后II导联测量心电图结果显示,10例大鼠均出现心电图异常,其中,心房扑动9例(90%),心动过速8例(80%),房室、室内传导阻滞5例(50%),部分大鼠同时出现2种及以上的心律失常,见图1。
3 各组大鼠心脏指数
实验第1天,称取各组大鼠体重,连续腹腔注射L-甲状腺素35 d后,发现HHD组大鼠体重有所下降,而正常组大鼠体重没有明显变化。与正常对照组相比较,HHD组大鼠心脏指数明显增高(P<0.05),表明HHD组大鼠心肌明显肥大,见表2。
4 各组大鼠左心室心肌细胞横径的比较
显微镜下观察,正常对照组心肌细胞结构正常;与正常对照组相比较,HHD组大鼠左、右心室的心肌细胞体积增大,心肌细胞横径明显增加(P<0.01),表明HHD组大鼠心肌细胞明显肥大,见图2、表2。
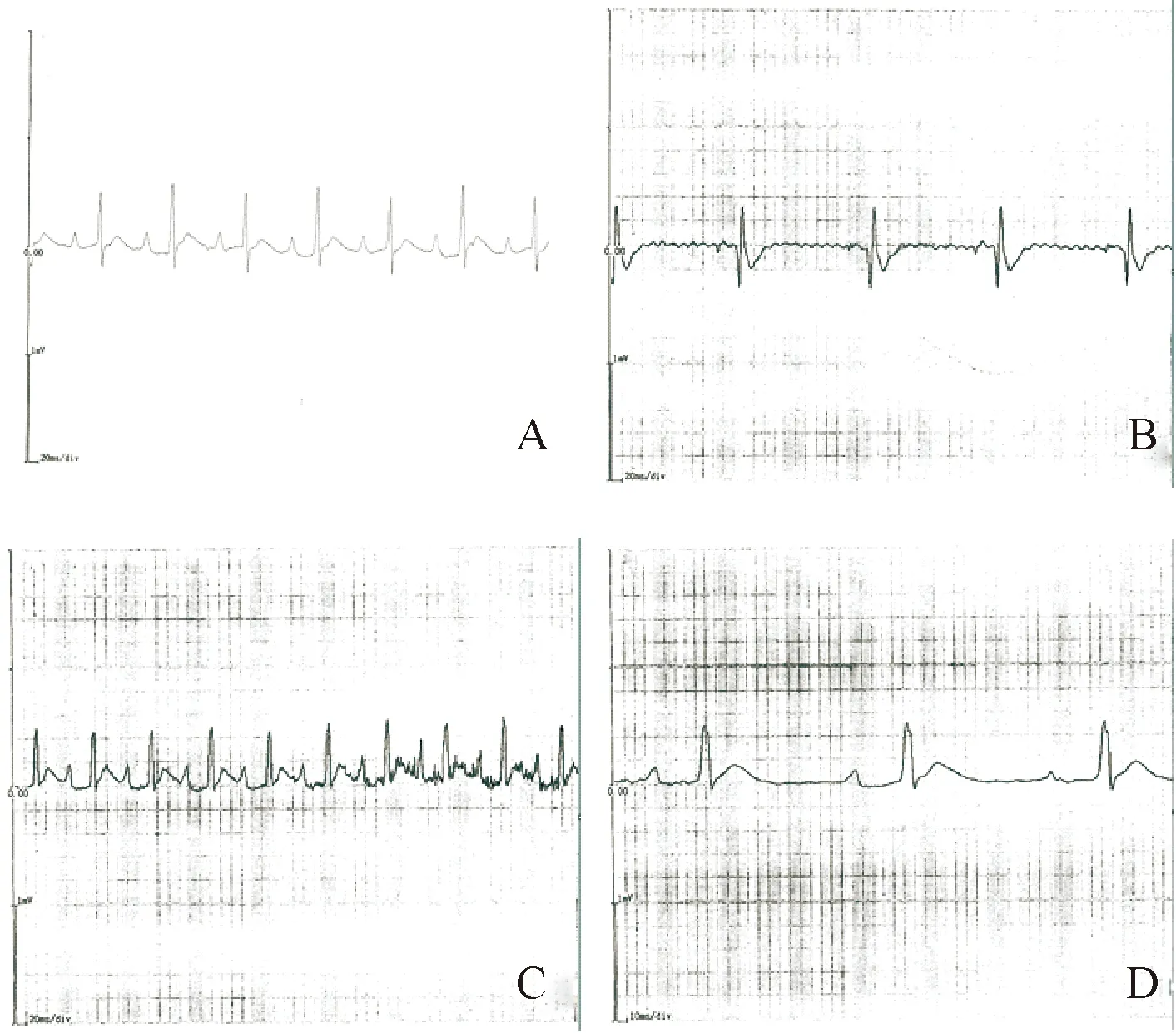
Figure 1. The ECG of hyperthyroid cardiopathy group. A: normal ECG; B: atrial flutter; C: sychnosphygmia; D: I degree atrioventricular block, intraventricular block and atrial electrical wandering.
图1正常组和甲亢组大鼠心电图

Figure 2. The observation of myocardial tissue slices with HE staining (×400).
图2HE染色观察心肌组织切片
5 免疫组化测定各组大鼠心肌组织Cav3.1、Cav3.2和Cav3.3蛋白的表达
与正常对照组相比较,甲亢性心脏病组大鼠Cav3.1蛋白的表达明显增高(P<0.01),Cav3.2蛋白的表达明显降低(P<0.01),Cav3.3蛋白的表达无变化,见图3、表3。
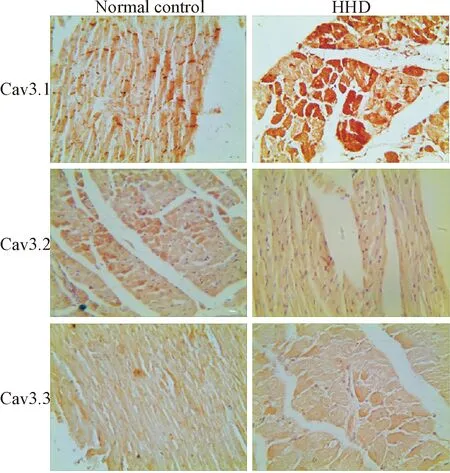
Figure 3. The protein expression of myocardial Cav3.1, Cav3.2 and Cav3.3 detected by immunohistochemical staining (×400).
图3心肌组织Cav3.1、Cav3.2和Cav3.3蛋白表达的免疫组化结果
6 Western blot测定各组大鼠心肌组织Cav3.1和Cav3.2蛋白的表达
与正常对照组相比较,甲亢性心脏病组大鼠Cav3.1蛋白的表达增高(P<0.05),Cav3.2蛋白的表达明显降低(P<0.01),见图4。
表3免疫组化检测Cav3.1、Cav3.2和Cav3.3蛋白在各组大鼠心肌的表达
Table 3. The protein expression of Cav3.1, Cav3.2 and Cav3.3 in the rat myocardial tissues detected by immunohistochemical staining (IA. Mean±SD.n=10)

ProteinNormal ControlHHDCav3.16 503.13±2 473.9641 786.10±13 251.00∗∗Cav3.213 724.73±2 978.222 935.54±1 412.08∗∗Cav3.31 598.05±597.701 554.12±733.50
**P<0.01vsnormal control group.
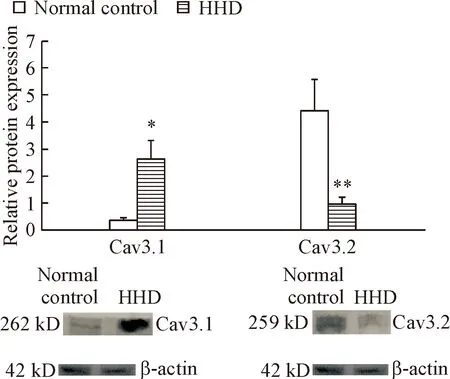
Figure 4. The protein expression of Cav3.1 and Cav3.2 in the rat myocardial tissues detected by Western blot. Mean±SD.n=4.*P<0.05,**P<0.01vsnormal control group.
图4Westernblot检测大鼠心肌组织Cav3.1和Cav3.2蛋白表达的结果
7 RT-PCR检测各组大鼠心肌组织Cav3.1、Cav3.2和Cav3.3的mRNA表达
与正常对照组相比较,甲亢性心脏病组Cav3.1的mRNA表达增加(P<0.05),Cav3.2的mRNA表达明显降低(P<0.01),Cav3.3的mRNA表达则没有变化,见图5。
讨 论
甲状腺素过量分泌可导致甲亢,甚至引起甲亢性心脏病。HHD患者在临床上常出现心肌肥大和心律失常,主要表现为房颤、房扑和房室传导阻滞等,严重的心律失常也可导致患者猝死。研究表明[9-12],HHD猝死者心室肌Cx43蛋白的分布发生明显改变,心肌细胞间失偶联,进一步诱发心律失常。这提示HHD患者心律失常的原因不只局限于传导系统,心室肌离子通道的改变也可能导致严重的心律失常。本实验HHD组大鼠心脏脏器系数、左心室心肌细胞横径明显增大都表明HHD大鼠出现心肌肥大,心电图结果也表明可发生多种心律失常,以心房扑动、心动过速、房室、室内传导阻滞等心律失常为主要表现。
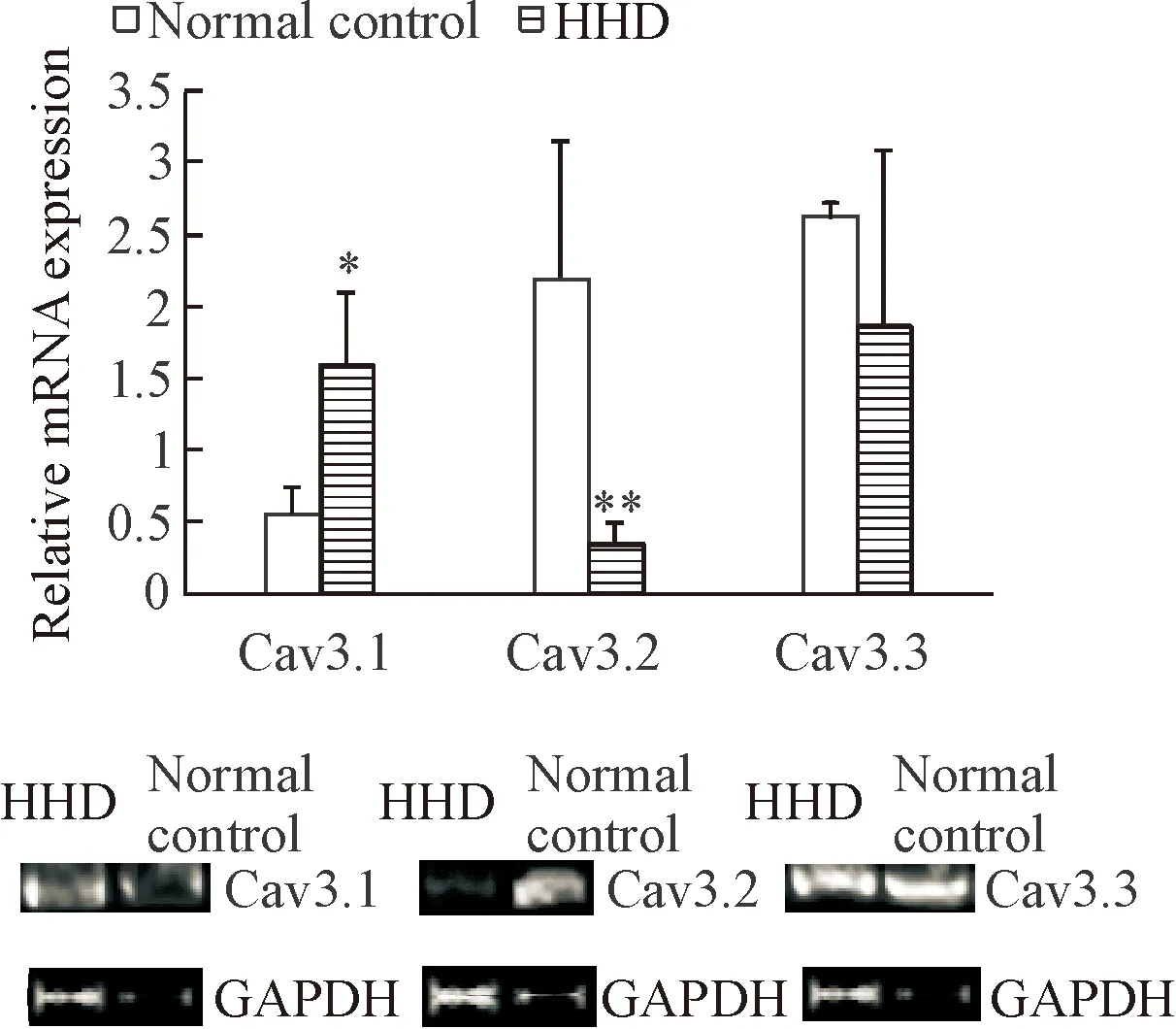
Figure 5. The mRNA expression of Cav3.1, Cav3.2 and Cav3.3 in the myocardial tissues detected by RT-PCR. Mean±SD.n=4.*P<0.05,**P<0.01vsnormal control group.
图5RT-PCR检测大鼠心肌组织Cav3.1、Cav3.2和Cav3.3的mRNA表达
细胞内 Ca2+平衡在维持正常心律中起着重要作用,Ca2+平衡主要依赖于L型和T型钙通道的正常表达。T型钙通道家族包括3 个不同的亚基(α1 亚基α1G、α1H和α1I),分别构成了Cav3.1、Cav3.2和Cav3.3这3种T型钙通道亚型[13]。正常成年大鼠心肌中的Cav3.1和Cav3.2共同参与形成舒张期电流,但其分别参与何期电流的形成尚不明确,Cav3.3在心脏中极少表达[5]。文献报道T 型钙通道的上调或下调,在不同病理状态下受到不同激素、细胞因子的调控,心肌肥厚时神经限制性静止因子(neuron-restrictive silencer factor,NRSF)可通过转录水平来调节T 型钙通道的表达[14];慢性缺氧时通过缺氧诱导因子1α(hypoxia-inducible transcription factor-1α,HIF-1α)可以上调心肌Cav3.2蛋白[15];血管紧张素II可通过G蛋白偶联受体上调心室肌Cav3.1的mRNA表达[16],而雌激素可以负性下调Cav3.2的蛋白水平[17]。上述研究结果提示,不同病因导致的心脏病,其T 型钙通道的表达变化是不同的,其心律失常的发病机理有各自的特异性机制。郑明奇等[18]的研究发现,心肌细胞T型钙通道表达增多,上调ICa-T,增加心脏自律性,触发快速心律失常。Levitsky等[19]的研究同样发现,诱导T型钙通道的表达增加了心肌细胞兴奋性并引发了期前收缩。而在大鼠心律失常模型中使用咪拉地尔、依福地平等T型钙通道阻滞剂替代L型钙通道阻滞剂可以有效减少大鼠心律失常的发生率[20-21]。上述研究结果提示心律失常的原因可能与心室肌T型钙通道表达增多有关。我们的研究结果发现,RT-PCR、Western blot和免疫组化结果显示心室肌Cav3.1表达较正常组明显增加,Cav3.2表达明显下降,提示长期高浓度甲状腺素刺激可以正性或负性调节心室肌T型钙通道各亚型的不同表达,改变心室肌细胞Ca2+平衡,诱发心律失常。
但也有文献表明,T型钙通道的表达减少可以解释为一种保护机制,减少心肌细胞内钙超载所造成的细胞损伤[22]。由于2种T型钙通道功能互相具有代偿性,病理生理条件下Cav3.1和Cav3.2的异常表达与心律失常之间的机制并未完全阐明[6]。因此,关于HHD心律失常与T型钙通道Cav3.1和Cav3.2表达异常之间的具体的生物学机制有待进一步研究加以明确。
[参 考 文 献]
[1] Schmidt-Ott UM, Ascheim DD. Thyroid hormone and heart failure[J]. Curr Heart Fail Rep, 2006, 3(3):114-119.
[2] Vassort G, Talavera K, Alvarez JL. Role of T-type Ca2+channels in the heart [J]. Cell Calcium, 2006, 40(2):205-220.
[3] 孙雁飞, 李 斌, 潘一龙, 等. T型钙通道在心血管疾病领域的研究进展[J]. 中西医结合心血管病电子杂志, 2015, 3(35):19-20.
[4] Yasui K, Niwa N, Takemura H, et al. Pathophysiological significance of T-type Ca2+channels: expression of T-type Ca2+channels in fetal and diseased heart[J]. J Pharm Sci, 2005, 99(3):205-210.
[5] Mesirca P, Torrente AG, Mangoni ME. Functional role of voltage gated Ca2+channels in heart automaticity [J]. Front Physiol, 2015, 6:19.
[6] Cribbs L. T-type calcium channel expression and function in the diseased heart [J]. Channels (Austin), 2010, 4(6):447-452.
[7] 李 超, 刘善红, 张家明, 等. 长期甲状腺素刺激对大鼠心肌Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ的影响 [J]. 中国病理生理杂志, 2012, 28(1):147-151.
[8] 李拜红, 金伟东, 王晓彦, 等. 缬沙坦对FAS/FAS-L在甲状腺素诱导的心脏病大鼠心肌组织表达的干预作用 [J]. 岭南心血管杂志, 2013, 19(1):88-92.
[9] Serve NJ, Bruce AF, Dupont E, et al. Remodelling of gap junctions and connexin expression in diseased myocardium[J]. Cardiovasc Res, 2008, 80(1):9-19.
[10] Sanganalmath SK, Bana J, Takeda N, et al. Antiplatelet therapy mitigates cardiac remodeling and dysfunction in congestive heart failure due to myocardial infarction[J]. Can J Physiol Pharmacol, 2008, 86(4):180-189.
[11] 苏 波, 云 鹏. 甲状腺功能亢进性心脏病猝死者左心室心肌连接蛋白43的分布改变[J]. 南京医科大学学报: 自然科学版, 2013, 33(1):86-89.
[12] Cao ZJ, Xu X, Que LL, et al. Dephosphorylation of cardiomyocyte Cx43 is associated with myocardial ischemia and reperfusion injury[J]. Nanjing Med Univ, 2009, 23(3):163-167.
[13] Erlinda The, Muktanand Vikash Jhummon, 魏毅东. 心脏T型钙离子通道[J]. 中国循证心血管医学杂志, 2011, 3(5):393-397.
[14] Kuwahara K, Saito Y, Takano M, et al. NRSF regulates the fetal cardiac gene program and maintains normal cardiac structure and function [J]. EMBO J, 2003, 22(23):6310-6321.
[15] Del Toro, Levitsky KL, Lopez-Barneo J, et al. Induction of T-type calcium channel gene expression by chronic hypoxia [J]. J Biol Chem, 2003, 278(25):22316-22324.
[16] Xu XP, Best PM. Increase in T-type calcium current in atrial myocytes from adult rats with growth hormone-secreting tumors[J]. Proc Natl Acad Sci U S A, 1990, 87(12):4655-4659.
[17] Marni F, Wang Y, Morishima M, et al. 17β-estradiol modulates expression of low-voltage-activated CaV3.2 T-type calcium channel via extracellularly regulated kinase pathway in cardiomyocytes [J]. Endocrinology, 2009, 150(2):879-888.
[18] 郑明奇, 刘 刚, 田 立, 等. 溶血磷脂酰胆碱对心肌细胞动作电位的影响及其机制研究[J]. 临床心血管病杂志, 2014, 30(9):808-811.
[19] Levitsky K, Lopez-Barneo J. Developmental change of T-type Ca2+channel expression and its role in rat chromaffin cell responsiveness to acute hypoxia [J]. J Physiol, 2009, 587(9):1917-1929.
[20] Maturana A, Lenglet S, Python M, et al. Role of the T-type calcium channel CaV3.2 in the chronotropic action of corticosteroids in isolated rat ventricular myocytes [J]. Endocrinology, 2009, 150(8):3726-3734.
[21] Kinoshita H, Kuwahara K, Takano M,et al. T-type Ca2+channel blockade prevents sudden death in mice with heart failure [J]. Circulation, 2009, 120(9):743-752.
[22] Pastukh V, Chen H, Wu S, et al. Effect of hypernatremia on injury caused by energy deficiency: role of T-type Ca2+channel[J]. Am J Physiol Cell Physiol, 2010, 299(2):C289-C297.
