丁苯酞通过激活VEGF/VEGFR2-Notch1/Dll4信号促进HUVECs形成血管*
2018-07-02官俏兵张晓玲韩晨阳
杨 毅,官俏兵,郭 丽,张晓玲,韩晨阳
(嘉兴市第二医院, 浙江 嘉兴 314001)
缺血性脑卒中是一种急性脑缺血缺氧性疾病,可在短时间造成脑组织中血管闭塞,神经细胞大量死亡,且预后较差,致死致残率较高[1]。目前临床中对于急性缺血性卒中的治疗主要有急性期的溶栓治疗和保守药物治疗。丁苯酞(DL-3-n-butylphthalidle,NBP)是从芹菜中提取的一种单体药物。基础实验证明丁苯酞可以有效抑制急性缺血性卒中脑损伤的多个病理环节,在缺血性脑病中有着广泛的应用。近年来的研究发现丁苯酞还可以缩小梗死的病灶,其作用和微循环的改善有关[2-3]。对于卒中患者而言,侧支血管的形成与开通无疑是有利于预后的,所以本研究着重研究丁苯酞在缺血缺氧(hypoxia and ischemia,H/I)条件下诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)形成血管的体外实验,并探索其机制。
材 料 和 方 法
1 细胞和试剂
丁苯酞标准品购于中检所,批号101035,纯度99%;人脐静脉内皮细胞购于武汉普诺赛生物科技有限公司(批号CL0122);F12K完全培养基与无血清培养基购于武汉普诺赛生物科技有限公司(批号PM150910和PM150910B);CCK-8试剂盒(批号AR1160)、 血管内皮生长因子(vascular endothelial growth factor,VEGF)的ELISA试剂盒(批号EK0539)和BCA蛋白定量试剂盒(批号0146)购于博士德生物技术有限公司;Matrigel购于BD公司(批号356234);抗VEGF受体2(VEGF receptor 2, VEGFR2)、Notch1和Delta样配体4(Delta-like ligand 4,Dll4)的I抗及HRP标记的II抗购于Abcam(批号5473、65297和7280);cDNA试剂盒购于凯基生物技术有限公司(批号KGA1311);实时定量PCR试剂盒/SYBR Green Real-time PCR Master Mix购于SinoBio(批号E090);总RNA提取试剂盒购于BioTek(批号RP2041)。
2 方法
2.1细胞模型的构建及分组 HUVECs使用含10% 胎牛血清的F12K完全培养基培养,待长至80%融合时消化后分组培养。将HUVECs分为正常对照(control)组、H/I组、NBP高剂量(H/I+NBPhigh)组和NBP低剂量(H/I+NBPlow)组。Control组使用F12K完全培养基进行常规培养;H/I组和H/I+NBPhigh组和H/I+NBPlow组的3组细胞使用无血清的F12K培养基并置于缺氧罐中,气体使用氮气置换后于培养箱中培养;H/I+NBPhigh组使用50 μmol/L终浓度的丁苯酞干预;H/I+NBPlow组使用10 μmol/L终浓度的丁苯酞干预。
2.2CCK-8法检测各组细胞活力 在培养后6、12、24和48 h 4个时点分别检测细胞的活力。在每孔中加入10 μL的CCK-8溶液,将培养板在培养箱中孵育1~4 h,用酶标仪测定在450 nm处的吸光度(A)值,同时设置空白对照。细胞活力(%)=(A实验组-A空白对照)/(A对照组-A空白对照)×100%
2.3细胞划痕实验检测HUVECs的迁移能力 将对数期的细胞接种在6孔板中,使其成为单层细胞,弃去常规培养基后用10 μL的移液枪在单层细胞上划“一”字划痕,PBS清洗3次,弃去悬浮的细胞后,换上含有丁苯酞的培养基培养。在镜下观察细胞迁移的程度,利用ImageJ软件进行实验前和实验后细胞迁移率距离(S)测定和迁移率的计算。迁移率(%)=(1-S实验后/S实验前)×100%
2.4HUVECs体外形成血管的能力检测 实验前将融化的Matrigel置于冰上,在ibidi血管生成载玻片上每孔加入10 μL的Matrigel,在培养箱中培养30 min待胶体凝结后每孔加入悬浮细胞1×104个左右,镜下观察细胞贴壁后,在培养箱中培养,镜下观察成管情况,使用IPP 6.0图像软件测定血管总长度,镜下的覆盖面积,成环数以及节点,并统计分析。
2.5ELISA法检测培养基中VEGF的表达水平 取培养后的培养基,经过BCA蛋白定量后,参照ELISA试剂盒说明进行VEGF的测定。
2.6Western blot法检测VEGFR2、Notch1和Dll4的表达水平 收集细胞后弃去培养基,细胞用PBS洗2~3次后加入细胞裂解液,冰上裂解0.5 h,提取总蛋白,经过BCA蛋白定量后,调整各组蛋白浓度后经过SDS-PAGE、转膜、孵育、显色后在Quantity One软件下进行灰度统计。
2.7qPCR检测VEGF、VEGFR2、Notch1和Dll4的mRNA表达水平 按照TRIzol试剂盒操作,提取细胞中总RNA,紫外分光光度法检测总浓度,定量后按照试剂盒方法进行反转录,得到的cRNA在-20 ℃保存,最后利用qPCR检测各个mRNA的表达。每个样本设置3个复孔,计算平均Ct值,设置阴性对照。采用2-ΔΔCt法计算拷贝数,并且以β-actin为内参照。引物序列见表1。
3 统计学处理
采用SPSS 17.0进行统计学处理。实验数据以均数±标准差(mean±SD)表示,对组间比较采用单因素方差分析(one-way ANOVA),并用Bonferoni校正的t检验进行组间两两比较。以P<0.05为差异有统计学意义。

表1 qPCR实验的引物序列Table 1. The primer sequences for qPCR
F: forward; R: reverse.
结 果
1 缺血缺氧条件下丁苯酞对HUVECs活力的影响
H/I条件会导致HUVECs凋亡,随着培养时间的延长,HUVECs的活力下降,而丁苯酞干预后细胞活力显著升高,每个时点与H/I组比较差异均有统计学显著性(P<0.05),但在24 h和48 h时H/I组以及H/I+NBPhigh组和H/I+NBPlow组的细胞相对活力均低于50%,12 h时3组细胞活力较好,所有选择干预12 h的实验时间进行后续实验。细胞相对活力见图1。

Figure 1. The changes of the cell viability. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsH/I group.
图1细胞活力的变化
2 缺血缺氧条件下丁苯酞对HUVECs迁移能力的影响
培养12 h,H/I组和control组的迁移能力无显著差异,而丁苯酞干预后HUVECs的迁移能力显著提高,与H/I组和control组相比差异均有统计学显著性(P<0.05),见图2。
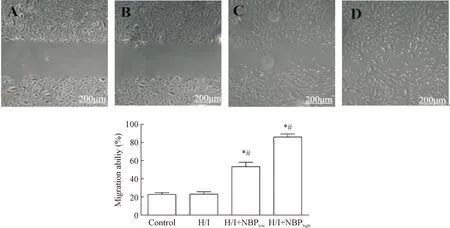
Figure 2. The results of cell migration capacity. A: control group; B: H/I group; C: H/I+NBPlowgroup; D: H/I+NBPhighgroup. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsH/I group.
图2细胞迁移能力的变化
3 缺血缺氧条件下HUVECs体外血管形成能力的比较
培养12 h,镜下观察发现control组和H/I组细胞未见血管形成但是有成管趋势,说明缺血缺氧的培养条件可以促进HUVECs形成管腔,但是作用微弱;丁苯酞干预后,H/I+NBPlow和H/I+NBPhigh的管腔长度、镜下成环数、成环节点和镜下面积均高于control组和H/I组(P<0.05),见图3。
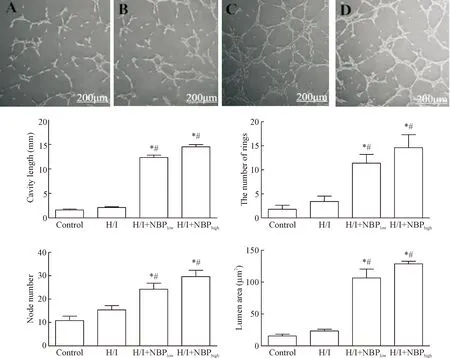
Figure 3. The results ofinvitroangiogenesis assay. A: control group; B: H/I group; C: H/I+NBPlowgroup; D: H/I+NBPhighgroup. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsH/I group.
图3细胞体外成管能力结果
4 缺血缺氧条件下HUVECs分泌VEGF水平的比较
H/I条件 VEGF的表达显著高于control组(P<0.05),说明缺血缺氧环境可以诱导VEGF的产生;而丁苯酞干预后,VEGF的表达显著上调,与control组和H/I组相比差异具有统计学显著性(P<0.05),见图4。

Figure 4. The expression of VEGF in the HUVECs under the conditions of H/I. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsH/I group.
图4缺血缺氧条件下VEGF的表达水平
5 缺血缺氧条件下丁苯酞对VEGFR2、Notch1及Dll4蛋白表达的影响
H/I条件下VEGF2和Dll4蛋白的表达相比对照组显著增高(P<0.05),而Notch1蛋白表达低于对照组,但差异无统计学显著性,说明缺血缺氧可以诱导该信号通路的激活;而丁苯酞干预后,VEGFR2、Notch1和Dll4的表达水平显著高于模型组和对照组(P<0.05),见图5。
6 缺血缺氧条件下丁苯酞对VEGF、VEGFR2、Notch1和Dll4 mRNA表达水平的影响
H/I条件下模型组的VEGF、VEGFR2、Notch1和Dll4的mRNA表达显著高于对照组(P<0.05);而丁苯酞干预后,VEGF、VEGFR2、Notch1和Dll4的mRNA表达相比模型组和对照组显著增高(P<0.05),见图6。
讨 论
丁苯酞是从芹菜中提取的一种有效成分,可以分为左旋体和右旋体,临床常用消旋体[4]。研究发现丁苯酞具有保护神经细胞、增加脑缺血区血流量、改善脑缺血组织的微循环和全脑缺血后的能量代谢和抑制炎症反应等作用[5]。同时还可以抗惊厥、抗癫痫,涉及脑缺血病理的多个环节和靶点[6]。在改善脑微循环的研究中提出了脑微循环的障碍可以造成脑血流量降低,继发引起能量代谢失调,导致脑组织坏死、神经功能缺损及炎症反应发生。研究还表明,丁苯酞预防及治疗性的给药可以增加MCAO后脑微动脉管径和血流速度,改善软脑膜的微循环[7]。临床研究发现丁苯酞可以促进侧支循环的建立,起到改善微循环的作用,减少梗死后出血现象。
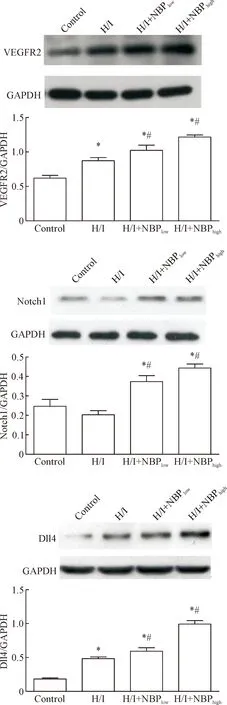
Figure 5. The effect of NBP on VEGF2-Notch1/Dll4 signal expression under H/I conditions. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsH/I group.
图5丁苯酞促进缺血缺氧下VEGF2-Notch1/Dll4信号的表达

Figure 6. The mRNA expression of VEGF, VEGFR2, Notch1 and Dll4 in the HUVECs with different treatments. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsH/I group.
图6丁苯酞促进缺血缺氧下VEGF、VEGFR2、Notch1和Dll4的mRNA表达
侧支循环的开放有赖于侧支血管的形成与开通,而血管形成是一个及其复杂的过程,VEGF是目前公认的在血管再生过程全程发挥作用的一种生长因子,最早在1983年被提出,总共由8个外显子和7个内含子组成[8],VEGF主要是通过激动VEGF受体而发挥作用的。VEGFR有3种亚型,分别是VEGFR1、VEGFR2和VEGFR3,它们均属于酪氨酸激酶受体家族,在细胞膜外大约有750个氨基酸残基[9]。在血管新生的过程中,VEGF与VEGFR2结合后激活下游信号,促进血管内皮细胞上的整合素与配体分离,在局部血管基底膜分解后,内皮细胞在局部可以增殖并向外迁移[10],此时VEGF可以介导Notch1/Dll4信号促进内皮细胞分化为顶端细胞逐渐形成血管芽[11-12],顶端细胞在VEGF的作用下产生伪足结构,有利于迁移,黏附及微血管网络的生成。可以说VEGF/VEGFR2-Notch1在血管的新生中扮演着十分重要的角色。一般的血管新生需要通过此通路。
本研究着重研究丁苯酞对于VEGF/VEGFR2-Notch1/Dll4信号激活与血管新生的作用。缺血性脑卒中中由于缺血缺氧的发生会导致神经细胞以及血管内皮细胞的凋亡,造成不可逆的损伤,所以临床治疗中常常在短时间中开通闭塞血管,挽救神经细胞和内皮细胞。本研究中发现,模拟缺血缺氧的条件下,丁苯酞可以促进HUVECs存活。虽然缺血缺氧条件可以促进HUVECs体外形成血管但是此种趋势不明显,而丁苯酞可以在此环境中显著促进HUVECs体外成管,从血管形成中管腔长度、节点、管腔面积等均显著优于对照组和H/I组,由于VEGF是VEGFR2受体激活的关键信号因子,是促进血管形成的起始关键细胞因子,从实验结果来看,丁苯酞在缺血缺氧环境中诱导VEGF的分泌,激活下游的VEGFR2受体,启动血管生成的信号通路,同时VEGF还可以诱导Notch/Dll4信号的激活,由于Notch/Dll4信号与HUVECs的迁移和血管芽形成相关,这与细胞迁移实验结果相一致。缺血性脑卒中的预后与侧支循环的开放是密切相关的,而侧支循环的开放依赖于微血管的形成和延伸,一般微血管的形成主要经过血管内皮细胞的募集、管腔的形成以及基底细胞的连接而成,在这整个过程中都需要VEGF的参与,而本研究也发现,体外管腔形成过程中,丁苯酞可以提高VEGF表达来同时激活VEGFR2和Notch信号,这样的作用无疑是血管形成的关键,过往研究发现[13],胚胎发育中VEGF的缺失可以造成血管形成障碍,使用Notch信号激活剂可以部分恢复动脉内皮的细胞标记,这提示Notch是VEGF的下游信号,也和本文的研究结果基本一致。
综上所述,本研究发现缺血缺氧条件下,丁苯酞可以通过激活VEGF/VEGFR2-Notch1/Dll4信号促进HUVECs的体外成管能力,这为丁苯酞的临床应用提供了支持,也揭示了丁苯酞治疗缺血性脑卒中的机制。
[参 考 文 献]
[1] 张东圆, 李 明, 王正则, 等. 缺氧诱导因子-1α在缺血性脑卒中模型中介导神经干-祖细胞作用机制的研究进展[J]. 中国康复理论与实践, 2017, 23(3):319-322.
[2] 胡 浩. 丁苯酞软胶囊对改善血管性痴呆患者认知功能的疗效及作用机制分析[J]. 中国实用神经疾病杂志, 2017, 20(1):98-99.
[3] 孔起良, 刘 娟, 杨 震, 等. 早期使用丁苯酞注射液治疗基底节区脑梗死对侧支循环建立及神经功能的影响[J]. 临床神经病学杂志, 2016, 29(4):293-295.
[4] Yin JT, Zhang HL, Yan X. A comparison of neuroprotective effects of DL-NBP on SOD1G93A mice when treatment started at pre-symptoms or late-symptoms[J]. J Apoplexy Nerv Dis, 2012, 29(11):971-973.
[5] Zhao W, Xu S, Peng Y, et al. Potassium 2-(1-hydroxypentyl)-benzoate improves learning and memory deficits in chronic cerebral hypoperfused rats[J]. Neurosci Lett, 2013, 541:155-160.
[6] Wei W, Zhang W, Huang Y, et al. The therapeutic effect of DL-3-n-butylphthalide in rats with chronic cerebral hypoperfusion through downregulation of amyloid precursor protein and matrix metalloproteinase-2[J]. J Int Med Res, 2012, 40(3):967-975.
[7] Chong Z, Feng Y. Effects ofdl-3-n-butylphthalide on arachidonic acid release and phospholipase A2mRNA expression in cerebral cortex after middle cerebral artery occlusion in rats[J]. Acta Pharm Sin, 2000, 35(8):561-565.
[8] Cao D, Hou M, Guan YS, et al. Expression of HIF-1α and VEGF in colorectal cancer: association with clinical outcomes and prognostic implications[J]. BMC Cancer, 2009, 9:432.
[9] Gao DC, Nolan DJ, Mellick AS, et al. Endothelial progenitor cells control the angiogenic switch in mouse lung metastasis[J]. Science, 2008, 319(5860):195-198.
[10] Zhao T, Zhao W, Meng W, et al. VEGF-C/VEGFR-3 pathway promotes myocyte hypertrophy and survival in the infracted myocardium[J].Am J Transl Res, 2015, 7(4):697-709.
[11] Hayashi H, Kume T. Foxc transcription factors directly regulate Dll4 and Hey2 expression by interacting with the VEGF-Notch signaling pathways in endothelial cells[J]. PLoS One, 2008, 3(6):e2401.
[12] 朱震寒, 齐 洁. 依达拉奉通过microRNA-25抑制高糖诱导的SH-SY5Y细胞凋亡[J]. 中国病理生理杂志, 2017, 33(1):92-97.
[13] Wang SH, Yang WK, Lee JD. Increased expression of the sonic hedgehog and vascular endothelial growth factor with co-localization in varicocele veins[J]. Phlebology, 2017, 32(2):115-119.
