草血竭纯化部分对小鼠甲型H1N1流感的疗效
2018-07-02肖芙蓉许小珍张秀春赵贵先
高 慧,肖芙蓉,许小珍,林 锋,张秀春,吴 彪,赵贵先
(海南省人民医院, 海南 海口 570311)
流行性感冒(influenza,Flu)具有高度的传染性,发病率高,病死率高,是危害人类健康的一种重要感染性疾病。特别是近年来甲型H1N1流感病毒感染在全世界范围内暴发流行,引起了全球的重视[1]。虽然奥司他韦是公认治疗甲型流感病毒的有效药物,但已有耐药的报道,且目前对于流感有确切疗效的药物较少,势待研发新的药物。草血竭(Polygonum paleaceum Wall,PPW)为蓼科植物的根茎,已有实验证明其对急性炎症有一定的治疗作用。本文拟在流感病毒感染动物模型上观察其抗流感病毒的效果。
1 材料与方法
1.1 材料 甲型H1N1 流感病毒Yamagata/120/86/H1N1 株由日本福岛医科大学微生物系锡谷达夫教授惠赠,血凝滴度:1∶1 280。动物:4~5 周龄Balb/c 小鼠,体重(11±1)g,购自海南省人民医院实验动物中心,合格证号:SCXK(鄂)4200593224。幼犬肾(Madin-Darby Canine Kidney, MDCK)细胞,本实验室保存(购自上海细胞所)。
1.2 试剂 草血竭纯化部分(0.283 g/mL生药,湖北中医药大学生产)。奥司他韦(达菲,75 mg/粒,巴塞尔豪夫迈·罗氏公司,瑞士)。实验试剂:DMEM 培养基、胎牛血清(GIBCO,美国);青链霉素溶液(100×)(吉诺生物医药技术有限公司);胰酶(Amresco 公司,美国); TRAZOL (Invitrogen公司,美国);逆转录酶M-MLV、随机引物(Promega 公司,美国);2×PCR mix 和PCR Markers[天根生化科技(北京)有限公司];SYBR Green Real-time PCR Master Mix(TOYOBO 公司,日本);dNTPs (华美生物工程公司);AxyPrep DNA 凝胶回收试剂盒[爱思进生物技术(杭州)有限公司]。
1.3 方法
1.3.1 甲型 H1N1流感病毒对Balb/c 小鼠半数致死量(LD50)的测定 将病毒液用稀释液按10 倍梯度稀释,得到10-1、10-2、10-3、10-4、10-5、10-6、10-77 个稀释度。取Balb/c小鼠48 只,随机法分为8 组。乙醚轻度麻醉后,分别给予上述稀释度的病毒液50 μL滴鼻,正常对照组使用无病毒的稀释液滴鼻。每天观察小鼠生存状态,记录14 d内各组小鼠发病状况,统计小鼠死亡数量,根据Reed-Muench 法计算流感病毒的LD50[2-3]。
1.3.2 实验分组 Balb/c 小鼠,随机分为6组:正常对照组、病毒对照组、阳性对照组(达菲45 mg/kg·d)、草血竭高剂量组(1 600 mg/kg·d)、草血竭中剂量组(800 mg/kg·d)、草血竭低剂量组(400 mg/kg·d),每组7只。Balb/c 小鼠实验前禁食禁水4 h,乙醚吸入麻醉后,以10×LD50病毒液滴鼻感染小鼠,每只小鼠的接种剂量为50 μL(正常对照组经鼻腔滴入等量病毒稀释液)。感染后2 h 通过灌胃途径给予上述各剂量药物,0.2 mL/只,连续给药5 d,每天1 次。
1.3.3 疗效评价 观察14 d 内甲型H1N1流感病毒感染模型小鼠的发病情况,记录各组小鼠死亡数及存活日数。肺指数的测定:肺指数=小鼠肺重/小鼠体重×100%;肺指数抑制率=(病毒对照组肺指数-实验组肺指数)/病毒对照组肺指数×100%。最后一次灌胃给药后继续观察24 h,小鼠处死前禁食禁水8 h 以上。称重后先摘除眼球取血,再将小鼠断椎处死,无菌取肺,用生理盐水洗涤2~3 次,摘除气管及肺门淋巴组织,置于滤纸上吸干水分后,精密天平称重。肺组织内病毒核酸载量:对肺组织匀浆提取RNA,采用标准曲线法定量同一样本各组小鼠肺内流感病毒M基因相对于GAPDH的表达量[4]。小鼠肺组织匀浆液,接种至已铺满单层的MDCK细胞上进行流感病毒扩增,血凝试验法检测流感病毒滴度[5-7]。
1.4 统计学方法 应用SPSS 18.0 软件进行统计学分析。数据均以均数±标准差的形式表示。多组间比较采用方差分析,以P≤0.05为差异具有统计学意义。
2 结果
2.1 甲型H1N1流感病毒对Balb/c小鼠LD50的测定 甲型H1N1流感病毒对Balb/c小鼠的LD50为10-6。见表1。
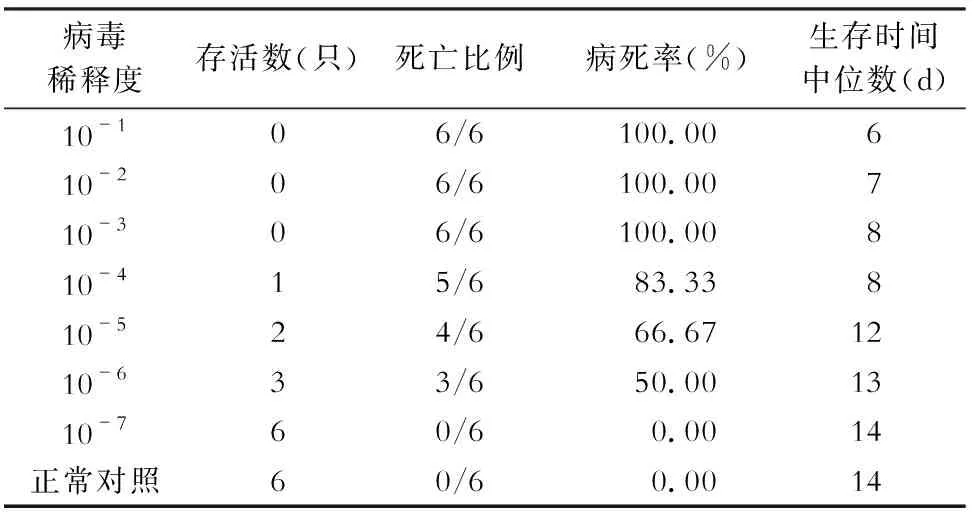
表1 甲型H1N1流感病毒对小鼠的LD50
2.2 草血竭纯化部分对甲型H1N1流感病毒感染小鼠的作用 阳性对照组和草血竭高、中剂量组小鼠的存活率均为100%,平均生存日数均为14 d,草血竭低剂量组小鼠的存活率为42.86%,平均生存日数为9.14 d,而病毒对照组小鼠的存活率及平均生存日数分别为0 和3.57 d。 不同组别小鼠平均生存日数比较,差异有统计学意义(F=8.53,P=0.02);阳性对照组、高剂量组、中剂量组、低剂量组小鼠平均生存日数均高于病毒对照组(P<0.05)。见表2。
2.3 草血竭纯化部分对甲型H1N1流感病毒感染小鼠肺指数、肺组织病毒载量的影响 阳性对照组和草血竭纯化部分各剂量组的肺指数、肺组织内流感病毒核酸相对量和病毒滴度均低于病毒对照组(P<0.05)。而阳性对照组与草血竭纯化部分各剂量组的肺指数、肺组织内流感病毒核酸相对量和病毒滴度比较,差异无统计学意义(P>0.05)。见表3。
表2草血竭纯化部分对甲型H1N1 流感病毒感染小鼠的死亡保护作用
Table2Protection effect of extract of PPW on death of mice infected with influenza A H1N1 virus

组别死亡比例病死率(%)存活率(%)平均生存日数(x±s,d)高剂量组0/70.00100.0014.00±0.00*中剂量组0/70.00100.0014.00±0.00*低剂量组4/757.1442.869.14±4.56*阳性对照组0/70.00100.0014.00±0.00*病毒对照组7/7100.000.003.57±0.79正常组0/70.00-14.00±0.00
*:与病毒组比较,P<0.05
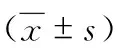


组别肺指数(%)肺指数抑制率(%)病毒核酸相对量病毒滴度高剂量组0.81±0.07*38.35±3.910.42±0.06*2.35±0.29*中剂量组0.84±0.10*34.13±2.250.42±0.06*2.43±0.15*低剂量组0.84±0.10*32.26±1.370.65±0.19*2.46±0.12*阳性对照组0.84±0.07*36.36±4.520.37±0.11*2.49±0.12*病毒对照组1.42±0.12 -1.00±0.062.80±0.16正常组0.77±0.07 - - -F 7.97 17.95 6.64 6.04P 0.03 0.00 0.04 0.04
*:与病毒组比较,P<0.05
3 讨论
草血竭是一种使用广泛的中草药,蓼科植物的根茎,主要产于云南、贵州、四川三省。其味苦、涩,性温和,有散血止血,下气止痛治慢性胃炎,胃、十二指肠溃疡,食积,症瘕积聚,月经不调,浮肿,跌打损伤,外伤出血、收敛止泻之功效[8]。研究发现,草血竭有镇痛抗炎作用[9]。另外,有研究报道草血竭水煮醇沉干浸膏与草血竭纯化部分能够在体外通过直接灭活作用发挥抗流感病毒作用[10]。因此,本研究通过给予甲型H1N1流感病毒感染小鼠不同剂量的草血竭纯化部分,观察其对小鼠的病死率、肺指数、肺组织病毒载量、病毒滴度的影响,综合评价草血竭抗病毒效果。
小鼠是目前较为合适的流感感染动物模型[11]。同时呼吸道感染为流感病毒的自然感染方式。在小鼠和雪貂的动物模型中,通常采用病毒滴鼻的方法感染动物[12]。流感病毒滴鼻感染小鼠,主要引起肺组织单核细胞浸润,肺重增加,体重减少[13-15]。因此流感病毒感染的小鼠肺指数高于正常对照组,说明模型构建成功。从宏观上来看,草血竭纯化部分各剂量组可以不同程度地延长小鼠的平均生存时间,对流感感染小鼠具有明确的治疗作用。从肺组织的病变上来看,在草血竭纯化部分对流感病毒感染小鼠的肺指数抑制作用研究中,草血竭高、中、低剂量组小鼠的肺指数均低于病毒对照组,说明草血竭能够改善流感导致的肺组织病变。从治疗机制上来看,草血竭纯化部分可降低肺组织流感病毒核酸量和病毒的滴度,提示其治疗作用是通过抗病毒实现的。流感病毒感染后,引起感染细胞凋亡,机体炎性细胞因子、趋化因子等活化:外周血中TNF-a、IL-12、IL-18、IFN-a等表达上升,NK细胞等免疫细胞数目增加,推测草血竭抗流感病毒的机制可能与抑制病毒感染引起的组织细胞凋亡、调节免疫相关细胞因子表达、增强免疫细胞的生物学功能有关。此外本研究还提示在降低病死率、改善肺组织损伤、抗病毒方面,草血竭中高剂量和经典抗流感病毒药物奥司他韦的效果基本相当,表明草血竭在对流感病毒感染的治疗上具有良好的应用前景。
综上所述,草血竭纯化部分在体内对甲型H1N1流感病毒具有抑制作用,能够改善甲型H1N1流感小鼠的肺组织的病变,降低病死率。
[参考文献]
[1] Kawaoka Y, Neumann G. Influenza virus: an introduction[J]. Methods Mol Biol, 2012, 865: 1-9.
[2] 蒋明彦, 刘国平, 曾建平, 等.重症及危重症甲型H1N1流感患者发病机制探讨[J].中国感染控制杂志, 2011, 10(5):326-330.
[3] 谢彬, 王雪峰, 岳志军, 等.克隆测序鉴定流感病毒诱导小鼠急性肺炎模型[J].中国当代儿科杂志, 2013, 15(2):145-149.
[4] 邹婷婷, 张智洁, 杨松, 等.流感病毒感染小鼠肺巨噬细胞Dll1和MHC-Ⅰ表达研究[J].中国感染控制杂志, 2014, 13(8):449-453.
[5] 王海, 黄茜华, 彭春梅, 等.实时荧光PCR方法在A型流感病毒检测中的应用[J].热带医学杂志, 2006, 6(10):1077-1080.
[6] 黄国钧.医药实验动物模型:制作与应用[M].北京:化学工业出版社, 2008.
[7] Jin C, Liang M, Ning J, et al. Pathogenesis of emerging severe fever with thrombocytopenia syndrome virus in C57/BL6 mouse model[J]. Proc Natl Acad Sci USA, 2012, 109(25): 10053-10058.
[8] 程乔德美,姚默,申万祥, 等.藏药草血竭的药学研究概况[J].安徽农业科学, 2012, 40(15):8466-8467.
[9] WHO. CDC protocol of real-time RT PCR for influenza A(H1N1)[S]. 2009, 7.
[10] 罗凡, 侯炜, 杨占秋, 等.草血竭抗流感病毒的研究[J].武汉大学学报(医学版), 2007, 27(1): 72-74.
[11] 李枫棣, 许黎黎, 鲍琳琳, 等.季节性流感病毒H1N1 BALB/c鼠肺适应株的建立及其分子机制[J].中国实验动物学报, 2014, 22(1):22-26.
[12] 刘晨风, 吴小红, 赵光宇, 等.人H7N9禽流感病毒、高致病H5N1禽流感病毒及H1N1流感病毒感染小鼠特征分析[J].中国实验动物学报, 2014, 22(1):8-12.
[13] Maines TR, Jayaraman A, Belser JA, et al. Transmission and pathogenesis of swine-origin 2009 A (H1N1) influenza viruses in ferrets and mice[J]. Science, 2009, 325(5939): 484-487.
[14] 王成祥, 曹鸿云, 程淼, 等.黄芩、板蓝根等清热解毒药对流感病毒所致肺炎小鼠炎性因子蛋白表达的影响[J].中华实验和临床病毒学杂志, 2012, 26(6):415-418.
[15] 王盛美, 揭志军.中草药抗流感病毒研究新进展[J].国际呼吸杂志, 2017, 37(10):771-774.
