Akt/GSK-3β/Snail通路在TGF-β1诱导A549/DDP细胞上皮间质转化中的作用*
2018-06-30刘春英
于 丹,王 莹,高 原,刘春英
(辽宁中医药大学基础医学院, 辽宁 沈阳 110032)
近年来,肺癌的发病率和死亡率呈逐年上升的趋势,以顺铂为代表的一线化疗药物在临床上被广泛应用,但化疗耐药和肿瘤细胞转移,使得非小细胞肺癌的5年生存率很低[1]。上皮-间充质转化(epithelial-mesenchymal transition,EMT)是胚胎发育的重要生理现象,也参与创伤愈合、器官纤维化、肿瘤转移和耐药等多种病理过程[2]。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,即Akt)、Wnt及核因子κB(nuclear factor-κB,NF-κB)等信号通路被证明在肿瘤细胞EMT过程中发挥重要作用。Akt/糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)/Snail信号通路作为多个通路的汇聚点,是否参与转化生长因子β1(transforming growth factor-β1,TGF-β1)诱导的顺铂耐药细胞A549/DDP发生EMT尚未见报道。因此,本研究通过检测TGF-β1诱导前后Akt/GSK-3β/Snail信号通路相关分子表达水平,探讨TGF-β1诱导A549/DDP细胞发生EMT的机制。
材 料 和 方 法
1 材料
A549/DDP细胞株购自中国医学科学院肿瘤细胞库。
TGF-β1购自Peprotech;抗Akt和p-Akt 抗体购于南京凯基生物技术有限公司;抗GSK-3β和p-GSK-3βSer9抗体由Abcam公司提供;抗Snail抗体购自北京博奥生物技术有限公司;抗β-actin 抗体购自Proteintech;抗上皮型钙黏蛋白(E-cadherin)和神经型钙黏蛋白(N-cadherin)抗体由博士德生物公司提供。
2 方法
2.1细胞培养 A549/DDP细胞常规培养,待细胞融合度达60%,换RPMI-1640无血清培养饥饿过夜,备用。并将细胞分成3组:TGF-β1(-)组、TGF-β1(+) 组(加入5 μg/L TGF-β1作用48 h)和LY294002组(在加入5 μg/L TGF-β1的同时,每 1 mL培养液中加入5 μL LY294002[3])。
2.2细胞形态观察 细胞爬片,常规培养至融合度达60%~80%,用镊子将玻片取出。用预冷的PBS冲洗3次。4%多聚甲醛固定10 min。PBS冲洗、晾干后,将盖玻片细胞面贴于载玻片上,于倒置显微镜下观察。拍照、记录。
2.3免疫荧光法检测E-cadherin和N-cadherin的表达 A549/DDP细胞经PBS冲洗后,4%多聚甲醛室温固定20 min,0.5% Txiton X-100 处理20 min,PBS冲洗,山羊血清室温封闭30 min。I 抗[E-cadherin(1∶200稀释)和 N-cadherin(1∶200稀释)]4 ℃过夜,次日,PBS冲洗后,II 抗避光孵育2 h,DAPI常温孵育5 min,PBS冲洗,用含抗淬灭剂的封片剂封片。
2.4Western blot法检测蛋白水平 采用RIPA∶PMSF(100∶1)裂解液,冰上操作,离心提取蛋白。采用BCA蛋白测定试剂盒测定蛋白浓度。按30 μL体积上样,电泳、转膜。5%脱脂奶粉室温封闭2 h。I 抗孵育[GSK-3β和p-GSK-3βSer9(1∶1 000);Akt、p-Akt、Snail、E-cadherin和N-cadherin(1∶500);β-actin(1∶1 000)],4 ℃过夜。次日,II 抗室温下孵育2 h后,发光、拍照,Quantity One凝胶图像分析。
3 统计学处理
SPSS 19.0统计软件对数据进行统计学分析。计量资料用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析,以P<0.05 为差异有统计学意义。
结 果
1 TGF-β1诱导前后细胞形态的变化
如图1所示,经TGF-β1作用后,细胞变得更加狭长,呈纺锤形,细胞间无成簇分布的现象,细胞间连接较为松散,失去上皮细胞形态特点。
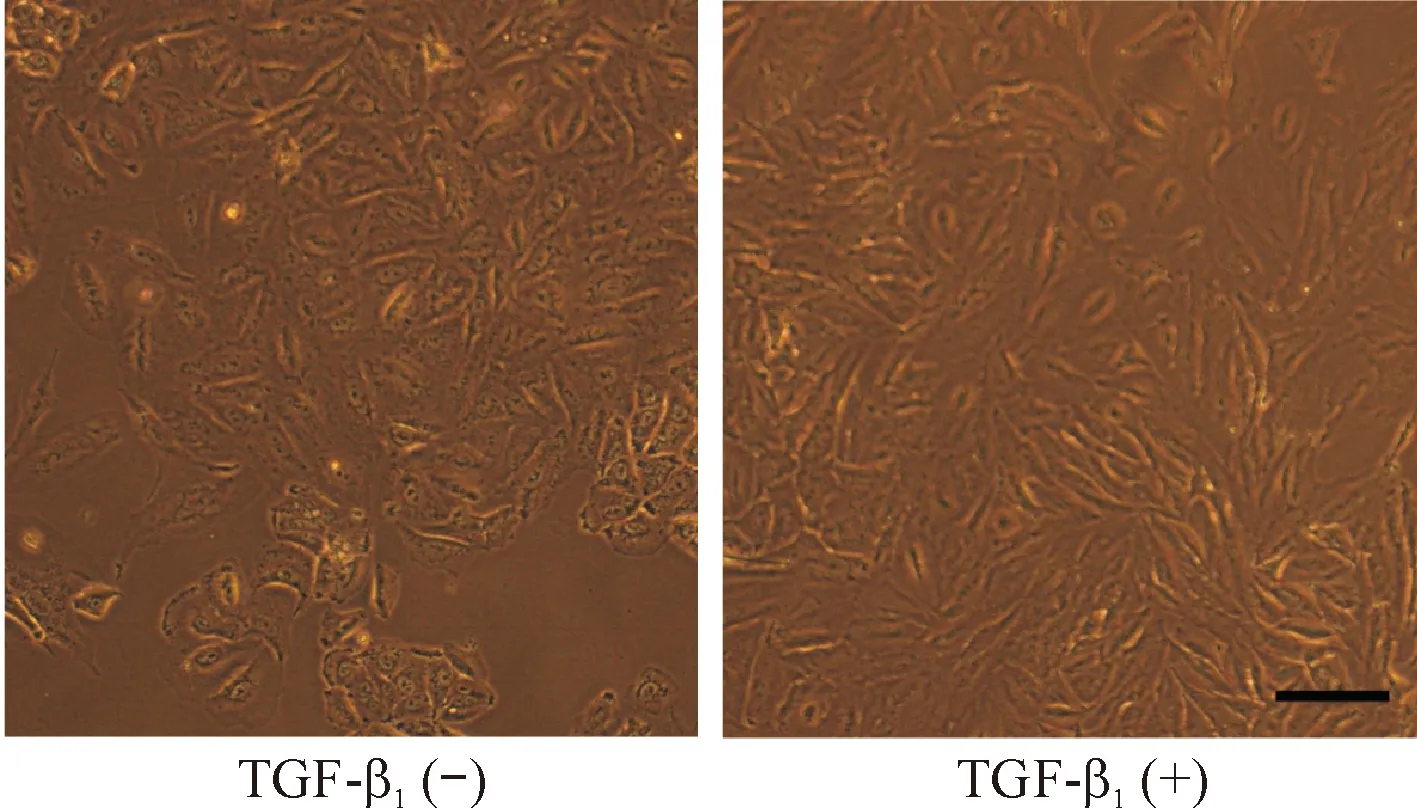
Figure 1. The morphological changes of the A549/DDP cells treated with TGF-β1observed under microscope (×200; scale bar=5 μm).
图1各组细胞的形态学观察
2 免疫荧光检测TGF-β1对 A549/DDP 细胞E-cadherin和N-cadherin表达的影响
实验结果显示E-cadherin和N-cadherin主要定位于A549/DDP细胞的胞浆和胞膜。经5 μg/L TGF-β1作用48 h后,标记E-cadherin的绿色荧光明显减少,仅见微弱的荧光;相反,N-cadherin的表达明显增强,可见大量绿色荧光,见图2。
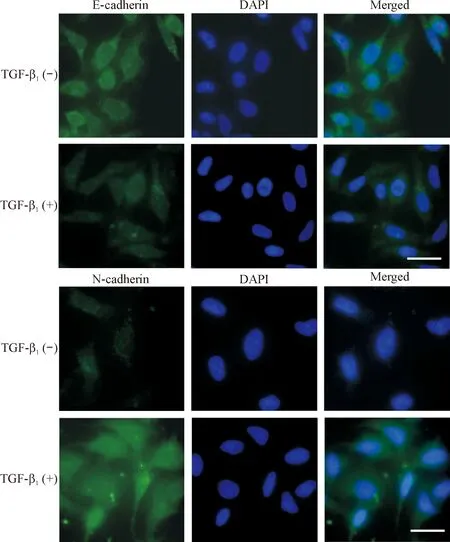
Figure 2. The protein expression of E-cadherin and N-cadherin in all groups (×200; scale bar=5 μm).
图2免疫荧光检测E-cadherin和N-cadherin蛋白的表达
3 Western blot检测TGF-β1对 A549/DDP 细胞E-cadherin和N-cadherin表达的影响
实验结果显示,与TGF-β1(-) 组比较,TGF-β1(+) 组E-cadherin蛋白表达水平下降,N-cadherin表达明显增强(P<0.05),见图3。
4 TGF-β1对 A549/DDP 细胞Akt、p-Akt、GSK-3β、p-GSK-3βSer9和Snail蛋白水平的影响
实验结果显示,与TGF-β1(-) 组比较,TGF-β1(+) 组p-Akt、p-GSK-3βSer9和Snail的蛋白水平明显增强,而用PI3K抑制剂LY294002作用48 h后, p-Akt、p-GSK-3βSer9和Snail的表达水平较TGF-β1(+) 组明显下降(P<0.05),各组间比较Akt和GSK-3β的表达水平无明显差异,见图4。
讨 论
EMT是上皮细胞向间充质细胞转化的现象,该现象由Greeburg等[4]在晶状体上皮细胞中被发现,并于1982年首次提出。发生EMT肿瘤细胞形态呈现出间质细胞形态特点,细胞失去极性,细胞间连接减弱,伸出伪足,细胞获得较高的移动能力。同时,上皮细胞标志物E-cadherin表达下调,间充质细胞标志物N-cadherin表达上调。发生EMT的细胞能够在基底膜上生长并穿透基底膜,提示EMT可能是肿瘤细胞突破基底膜的重要机制之一[5-6]。EMT与乳腺癌和结肠癌的细胞形态改变、细胞间黏附能力下降以及转移灶的形成密切相关[7-8]。Shintani等[9]研究发现,EMT可能是非小细胞肺癌对紫杉醇和顺铂耐药的重要原因。

Figure 3. The protein expression of E-cadherin and N-cadherin in all groups. Mean±SD.n=3.*P<0.05vsTGF-β (-) group.
图3Westernblot检测E-cadherin和N-cadherin的蛋白表达
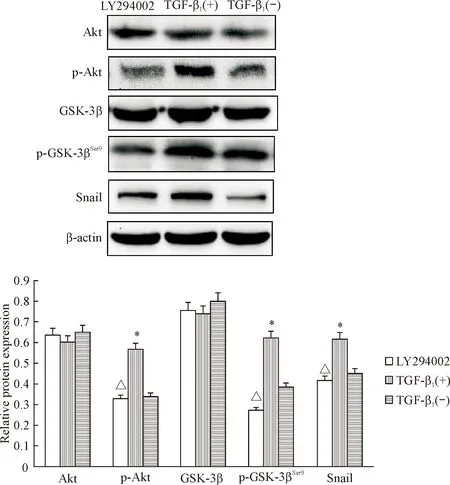
Figure 4. The protein levels of Akt, p-Akt, GSK-3β, p-GSK-3βSer9and Snail in all groups. Mean±SD.n=3.*P<0.05vsTGF-β1(-) group;△P<0.05vsTGF-β1(+) group.
图4Westernblot检测Akt、p-Akt和GSK-3β、p-GSK-3βSer9和Snail的蛋白水平
TGF-β是目前EMT研究常用的诱导剂,被认为是几乎所用上皮细胞发生EMT必不可少的诱导因子[10-11]。TGF-β通过Smad和非Smad通路(PI3K/Aat、NF-κB和Wnt等)发挥效应,诱导EMT发生[12]。大量研究PI3K/Akt 在肿瘤EMT过程中发挥举足轻重的作用,该通路的激活可使GSK-3β第9号位点的丝氨酸被泛素化降解。人Snail序列中存在2个GSK-3β保守位点,GSK-3β与Snail结合使其磷酸化,进而调节Snail在细胞内的定位及稳定性[13]。当GSK-3(Ser9)磷酸化后,可解除对Snail的抑制作用,使得细胞内Snail表达水平升高[14-15]。Snail是一类含有锌指结构的DNA结合蛋白,可以识别E-cadherin启动子上游的E-box区域,抑制E-cadherin的基因表达,促进EMT的发生[16-17]。
本研究结果显示,TGF-β1处理后,A549/DDP细胞发生间充质细胞形态转化,及EMT标志蛋白表达的变化,提示TGF-β1促进A549/DDP细胞EMT的发生。各组Akt和GSK-3β蛋白表达水平无明显差异,而TGF-β1处理后,p-Akt、p-GSK-3βSer9和Snail的表达水平上调,同时添加PI3K抑制剂LY294002可下调p-Akt、p-GSK-3βSer9和Snail的表达,提示TGF-β1并不影响Akt和GSK-3β的转录和表达,而是通过影响磷酸化水平改变其活性,进而提高Snail的表达水平,促使EMT发生。
综上所述,TGF-β1可能通过Akt/GSK-3β/Snail信号通路诱导A549/DDP细胞EMT发生,进而影响细胞扩散及侵袭能力,该通路可能是导致非小细胞肺癌转移及对顺铂耐药的重要环节。
[参 考 文 献]
[1] Bi N, Wang L. Superiority of concomitant chemoradiation over sequential chemoradiation in inoperable, locally advanced non-small cell lung cancer: challenges in the selection of appropriate chemotherapy[J]. Semin Radiat Oncol, 2015, 25(2):122-132.
[2] Foroni C, Broggini M, Generali D, et al. Epithelial-mesenchymal transition and breast cancer:role,molecular mechanisms and clinical impact[J]. Cancer Treat Rev, 2012, 38(6):689-697.
[3] 刘亚莉, 王 莹, 易佳丽, 等. 补中益气汤含药血清对人肺腺癌 A549/DDP 细胞耐药作用的影响[J]. 中国病理生理杂志, 2014, 30(2):223-238.
[4] Greenburg G, Hay ED. Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells[J]. J Cell Biol, 1982, 95(1):333-339.
[5] 张可华, 宋建国. EMT与肿瘤[J]. 生命的化学, 2008, 28(5):523-526.
[6] 王向辉, 黄江平, 崔丰和, 等. 微小RNA-138-5p抑制肺癌细胞增殖、迁移和侵袭能力的机制研究[J]. 中国病理生理杂志, 2017, 33(9):1631-1636.
[7] Thiery JP. Epithelial-mesenchymal transitions in tumour[J]. Curr Opin Cell Biol, 2003, 15(6):740-746.
[8] Boyer B, Valles AM, Edme N. Induction and regulation of epithelial-mesenchymal transitions[J]. Biochem Pharmacol, 2000, 60(8):1091-1099.
[9] Shintani Y, Okimura A, Sato K, et al. Epithelial to mesenchymal transition is a determinant of sensitivity to chemoradio therapy in non-small cell[J]. Ann Thorae Surg, 2011, 92(5):1794-1804.
[10] Massague J. TGFbate in cancer[J]. Cell, 2008, 134(2):215-230.
[11] Zavadil J, Bottinger EP. TGF-beta and epithelial-to-mesenchymal transitions [J]. Oncogene, 2005, 24(37):5764-5774.
[12] 屈 艳, 张 崇, 贾岩龙, 等. 大黄酸通过抑制 miR-21而干预 TGF-β1/Smad通路并减轻博莱霉素所致大鼠肺纤维化[J]. 中国病理生理杂志, 2017, 33(1):149-153.
[13] 吴丽霞, 刘丽江. Snail的结构及功能与肿瘤生长侵袭的研究进展[J]. 江汉大学学报, 2014, 42(1):75-79.
[14] Liu ZC, Chen XH, Song HX, et al. Snail regulated by PKC/GSK-3β pathway is crucial for EGF-induced epithe-lial-mesenchymal transition (EMT) of cancer cells[J]. Cell Tissue Res, 2014, 358(2):491-502.
[15] Bachelder RE, Yoon SO, Franci C, et al. Glycogen synthase kinase-3 is an endogenous inhibitor of Snail transcription: implications for the epithelial-mesenchymal transition[J]. J Cell Biol, 2005, 168(21):29-33.
[16] 肖尤川, 李云峰, 杨之斌. PI3K/Akt信号通路轴在肿瘤上皮细胞间质转化中作用的研究进展[J]. 现代肿瘤医学, 2013, 9(21):2147-2149.
[17] 应赵建, 黄晓敏, 余垭妮, 等. PI3K / CTGF 信号通路在 TGF-β1 诱导 A549细胞表达 collagen I 过程中的作用[J]. 中国病理生理杂志, 2017, 33(3):489-494.
