体外膜肺氧合联合急诊经皮冠状动脉介入治疗抢救急性心肌梗死后心脏骤停患者的临床疗效及其影响因素分析
2018-06-30吴颖张励庭冯力黄炫生耿学斌李莉
吴颖,张励庭,冯力,黄炫生,耿学斌,李莉
急性心肌梗死(AMI)的发病率已呈逐年增高趋势,且趋于年轻化,急诊经皮冠状动脉(冠脉)介入治疗(PCI)为AMI患者的救治提供了有效的治疗途径[1-3],但对于AMI合并心脏骤停的危重患者往往需要先进行心肺复苏后,再行PCI。而急救药物及主动脉内球囊反搏(IABP)等传统的机械循环辅助手段,往往无法维持患者稳定的循环功能,血流动力学不稳定状态可持续恶化[4,5],使患者错过了行急诊PCI的最佳时机,预后结局不佳。因此,如何为AMI合并心脏骤停患者提供有效快速的复苏,理想的循环支持系统和稳定的血流动力学状态,对于急诊PCI的成功与否及患者的临床结局改善具有重要意义。体外膜肺氧合(ECMO)是一种新型的体外呼吸循环辅助装置,通过床旁穿刺血管快速植入为危重患者提供几乎与心排出量相当的循环呼吸支持,提供充足的组织血液灌注和气体交换,已广泛应用于危重症、心脏骤停后经传统心肺复苏治疗无效的AMI患者的抢救中[6-9]。本研究旨在探讨ECMO联合急诊PCI治疗AMI后心脏骤停患者的临床疗效及其影响因素。
1 资料与方法
临床资料:回顾性分析2015-01至2017-01期间于中山市人民医院心内科住院治疗的37例ECMO联合急诊PCI治疗AMI后心脏骤停患者的临床资料,其中男性28例(75.7%),平均年龄(59.7±12.6)岁,入院前已出现心脏骤停患者12例(32.43%),入院后1 h出现心脏骤停患者17例(45.95%),于急诊PCI前出现心脏骤停患者8例(21.62%)。入选标准:(1)所有患者符合中华医学会心血管病学分会制定的关于急性ST段抬高型心肌梗死诊断和治疗指南中关于AMI的诊断标准[1];(2)经心电图或血液动力学监测结果显示出现心脏骤停,并给予持续胸外按压、心肺复苏药物、呼吸机辅助呼吸和电除颤等传统心肺复苏手段救治,并持续观察10~15 min后血流动力学指标仍不稳定,或传统心肺复苏术前心脏骤停时间不超过5 min决定给予紧急植入ECMO。排除标准:(1)因其他疾病引起的AMI或心脏外科手术等原因引起的心脏骤停;(2)给予传统心肺复苏治疗后可恢复自主循环患者,再次出现心原性休克需植入ECMO者;(3)出现难以逆转的脑死亡或多脏器功能衰竭患者;(4)恶性肿瘤及凝血功能异常性疾病患者;(5)存在植入ECMO禁忌证而无法实施手术患者。所有患者家属均签署知情同意,本研究已经我院医学伦理委员会批准。
植入ECMO的应用:所有患者均在外科医师辅助指导下行右侧股动、静脉分离置管,插管前给予0.5 mg/kg肝素静脉注射后行侧股动、静脉置管,建立静脉-动脉体外膜肺氧合(V-A ECMO),选择MAQUET2050或美敦力CBIQ91R6套包(美国Medtronic)进行ECMO的设置,采取V-A ECMO辅助方式建立ECMO环路,若下肢血液循环不通畅,可安装侧路循环装置。选择1 000 ml的人工胶体(其中每500 ml胶体中加入5 mg的普通肝素)作为管路预充液。以股静脉-离心泵-ECMO-股动脉的方向作为转流途径,设置ECMO的初始流速为每分钟4.0~5.0 L,注意转流过程中间断应用小剂量肝素,保持活化凝血时间(ACT)在160 s左右,流量每分钟2~3 L,并根据血流动力学和血氧饱和度指标的变化情况对流速进行调整。
急诊PCI的应用:患者植入ECMO复苏成功,恢复自主心跳,血流动力学稳定后,可给予紧急PCI。在PCI前给予阿司匹林300 mg、氯吡格雷600 mg抗血小板聚集,手术过程中给予2 000 U的肝素经鞘管注射,行冠脉造影确定病变血管后再给予6 000~8 000 U的肝素经鞘管注射,后给予相关病变血管的PCI,治疗后若冠脉的残存狭窄率小于20%视为PCI成功,术后5~7 d继续给予低分子肝素皮下注射,并长期服用氯吡格雷和阿司匹林治疗。
术后ECMO的使用及撤除:术后继续使用ECMO装置进行治疗的患者,当辅助流量降至每分钟500 ml时,多巴胺用量减少至每分钟5 μg/kg,肾上腺素减少至每分钟0.05 μg/kg时,氧合指数大于200 mmHg(1 mmHg=0.133 kPa),血流学动力学仍保持稳定状态,即成人平均动脉压(MAP)>60 mmHg,中心静脉血氧饱和度>60%,左心室射血分数(LVEF)>40%时,可尝试停止ECMO机的运行,若撤除ECMO装置 1 h后血流动力学仍保持稳定,可撤除相应的管道,若不稳定,则需重新转机,待血流动力学稳定后1~3 h后再重新尝试撤机,以此视为撤机成功。若患者血流动力学未达到撤机标准,而被迫撤除ECMO装置,虽未撤机,但已死亡或撤除ECMO装置后病情发生恶化,持续生存时间小于48 h均视为撤机失败。
分组:37例患者中,17例患者撤除ECMO装置后康复出院(存活组),20例撤除ECMO装置后死亡(死亡组,其中1例不能顺利脱机因循环衰竭死亡)。
观察指标:(1)一般临床资料 :观察、记录并比较两组患者的性别、年龄、既往病史(糖尿病、高血压、心肌梗死)等。(2)临床救治情况:观察并比较两组患者冠脉病变分布、心肌梗死相关血管、冠脉病变SYNTAX积分、PCI成功率、血运重建情况、IABP辅助情况、发生心脏骤停至植入ECMO时间、初始辅助流量、ECMO使用时间等。(3)测定并比较两组植入ECMO 24 h、48 h、72 h的临床各项指标:①血流动力学指标:心率、平均动脉压、中心静脉压、中心静脉血氧饱和度、LVEF;②动脉血气分析:动脉血氧分压、二氧化碳分压、乳酸、pH值;③血液指标:白细胞、血红蛋白、血小板、尿素氮、血肌酐、肌酸激酶-MB。(4)并发症: 观察并记录植入ECMO的并发症:肢体并发症、溶血、出血、感染、肾功能不全、神经系统并发症等。
统计学分析:采用SPSS 17.0软件进行统计学分析。计量资料以均数±标准差(±s)表示,两组间均数比较采用两独立样本t检验,同组干预前后均数比较采用配对t检验。率的比较采用χ2检验。多因素分析采用非条件Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
两组患者的一般临床资料的比较(表1):两组在性别构成、平均年龄、平均体重、心肌梗死部位、既往史、吸烟史比较,差异均无统计学意义(P均>0.05)。

表1 两组患者一般资料比较
37例患者术后一般临床资料:(1)37例在植入ECMO后均恢复自主心跳,复苏成功率为100%,其中9例持续心室颤动的患者植入ECMO并心肺复苏后转为窦性自主心律,4例反复室性心动过速患者植入ECMO治疗后未再复发,4例Ⅲ度房室阻滞患者植入ECMO治疗,1例恢复正常窦性心律,3例持续Ⅲ度房室阻滞行右心室临时起搏器安置术。(2)37例患者植入ECMO后给予冠脉造影检查,并行急诊PCI,其中26例行经皮冠脉腔内成形术,11例行PCI,手术成功率达到100%。冠造结果显示,37例患者中,双支血管病变15例,三支血管病变14例,左主干并三支血管病变8例。心肌梗死相关动脉:左主干8例,左前降支15例,右冠状动脉10例,左回旋支4例。SYNTAX评分均值为(31.4±9.2)分。(3)37例患者中,17例患者撤除ECMO装置后康复出院,存活率达到45.9%(17/37);死亡54.1%(20/37),其中19例撤除ECMO装置后死亡(5例患者因出现循环衰竭而死亡,12例因多脏器功能衰竭而死亡,2例因出现脑出血而死亡);1例不能顺利脱机因循环衰竭死亡。(4)37例患者植入ECMO并发症发生及治疗情况:37例患者中出现植管部位出血7例,经完善凝血指标检查,经局部压迫出血停止;植管部位感染1例,经局部换药、应用抗菌药物感染控制;股动脉栓塞并下肢缺血性损害1例,患者发生并发症后出现多脏器功能衰竭死亡。
两组患者植入ECMO情况的比较(表2):与死亡组比较,存活组患者的传统心肺复苏时间、发生心脏骤停至植入ECMO时间较短,心肺监护病房住院时间较长,差异均有统计学意义(P均<0.05);病变血管支数、罪犯血管的分布比较,差异均有统计学意义(P均<0.05),其中存活组的罪犯血管以右冠状动脉比例最高(52.94%),死亡组以左前降支比例最高(60.00%)。两组患者在SYNTAX评分、使用ECMO时间、ECMO初始流量及使用IABP 、传统心肺复苏的比例等比较,差异均无统计学意义(P均>0.05)。
两组患者植入ECOM复苏72 h后的临床各项指标的比较(表3):植入ECMO 24 h、48 h后存活组的平均动脉压显著高于同期死亡组,差异有统计学意义(P<0.05)。其余的血流动力学指标、动脉血气分析及血液指标,两组间差异均无统计学意义(P均> 0.05)。
表2 两组患者ECMO治疗情况的比较(±s)
注:ECMO:体外膜肺氧合;CCPR:传统心肺复苏;CCU:心肺监护病房;IABP:主动脉内球囊反搏;CRRT:连续肾脏替代治疗。-:无
项目 死亡组(n=20)存活组(n=17) 统计值 P值CCPR 时间 (min) 54.6±25.7 31.4±5.2 3.0660.012 SYNTAX 评分 (分 ) 30.3±9.7 35.4±12.1 1.2170.257病变血管支数 [例 (%)] 0.888 0.043单支 0 (0.00) 0 (0.00) - -双支 6 (30.00) 9 (52.94) - -三支 8 (40.00) 6 (35.29) - -左主干 + 三支 6 (30.00) 2 (11.76) - -罪犯血管 [例 (%)] 8.801 0.032左前降支 12 (60.00) 3 (17.64) - -左回旋支 1 (5.00) 3 (17.64) - -右冠状动脉 1 (5.00) 9 (52.94) - -左主干 6 (30.00) 2 (11.76) - -发生心脏骤停至植入ECMO时间 (h,±s)93.6±60.5 47.5±19.5 2.5280.003CCU 住院时间 [d,M (Q1,Q3)] 4.0 (2.0, 12.0)16.0 (8.7, 32.6)2.473 0.015使用 ECMO 时间 (h) 87.5±61.2 141.6±80.5 1.9860.117 ECMO 初始流量 (ml) 3 597.5±655.4 3 714.9±507.20.5100.763使用 IABP[例 (%)] 14 (70.00) 10 (58.82) 0.675 0.411 CRRT[例 (%)] 11 (55.00) 8 (47.06) 0.207 0.603
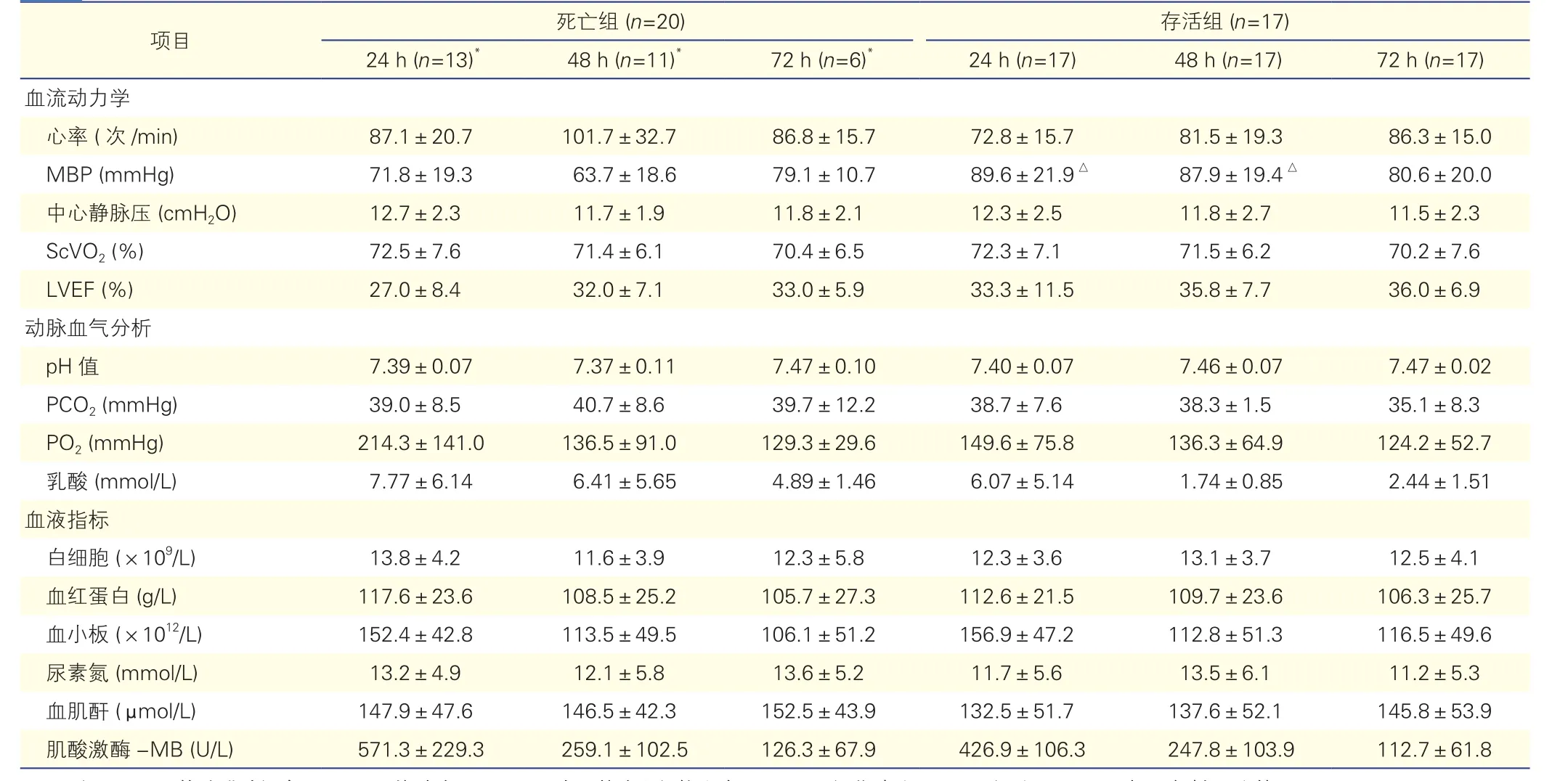
表3 两组患者植入ECMO复苏后72 h内的各项指标的比较( ±s)
多因素非条件Logistic多因素回归分析:以患者临床结局(存活=0,死亡=1)为因变量,将前述两组间差异有统计学意义的指标(传统心肺复苏时间、冠脉罪犯血管及血管支数、发生心脏骤停至植入ECMO时间、心肺监护病房住院时间、24 h、48 h 平均动脉压)为自变量进行多因素非条件Logistic回归分析。其中冠脉罪犯血管及血管支数为分类变量赋值见表4,余变量均以实际值统计。结果显示,罪犯血管为左前降支(OR=0.723,95%CI:0.516~0.947)、病变血管支数(OR=1.638,95%CI:1.107~1.729)、更长的心肺复苏时间(OR=0.712,95%CI:0.436~0.973)、发生心脏骤停至ECMO植入时间(OR=0.698,95%CI:0.411~0.859)与患者死亡密切相关,可能加重患者死亡的风险,ECMO复苏后48 h的平均动脉压较高(OR=0.672,95%CI:0.326~0.693)可能减少患者死亡的风险(表5)。

表4 冠状动脉罪犯血管及血管支数分类变量赋值

表5 多因素非条件Logistic回归分析
3 讨论
传统的心肺复苏用于AMI合并心脏骤停的目的是在威胁生命的问题得到纠正或逆转前维持循环和通气,然而其自主循环的恢复效果并不理想,且血管活性药物的大剂量使用在维持血压的同时,明显的增加心肌氧耗及心律失常发生的风险。冠脉血运尽早重建可明显提高患者的生存率,但血运重建前的血流动力学状态的稳定与否又与患者的术后存活密切相关。因此,能够提供相对稳定的血流动力学的体外循环支持技术,可增加AMI心脏骤停的抢救成功率[5]。
ECMO能通过人工血泵有效的替代心脏功能,维持血流动力学的稳定,并可减轻心脏负担,有利于衰竭心脏的休息,促进其恢复,且ECMO可减低右心室及肺动脉压力,体外循环的静脉血经膜式氧合器的氧合,改善组织器官的缺血缺氧状态,因此AMI心脏骤停患者通过ECMO实现循环和呼吸支持能够为急诊PCI创造条件,实现更高的抢救成功率及患者存活率[6]。美国心脏协会(AHA)指南推荐在循环停止时间短、病因可逆或符合心脏移植指征的患者,可考虑ECMO的治疗[7]。
本研究纳入的AMI后心脏骤停患者37例在植入ECMO后恢复自主心跳,复苏成功率为100%,行急诊PCI存活率达到45.9%(17/37)。本研究的结果显示,存活组患者在传统心肺复苏时间、发生心脏骤停至植入ECMO时间、CCU住院时间、病变血管支数、罪犯血管的分布方面与死亡组比较差异有统计学意义(P<0.05)。本研究存活组患者的传统心肺复苏时间为(31.4±5.2)min,与相关文献报道一致[8],而死亡组的传统心肺复苏时间达到(54.6±25.7)min,显著延长。国外研究显示,传统心肺复苏时间<40 min是存活出院的独立预测因子[9]。本研究通过快速标准化操作规程的建立,缩短ECMO治疗前的低灌注时间,能显著改善患者的心脏预后。AMI导致的心肌受累程度亦会影响患者的存活。罪犯血管为左主干的患者,通常属于高风险患者,病情较重,无法承受手术和麻醉的打击,所以植入ECMO后恢复自主心跳后均行急诊PCI。PCI作为介入手术,较冠脉旁路移植术(CAGB)对患者机体的影响小,因此,对于罪犯血管为左主干的患者,PCI是可选择的最佳治疗方式。植入ECMO 24 h、48 h后存活组的平均动脉压显著高于死亡组,差异有统计学意义(P<0.05),提示上述因素可能与患者的抢救成功率密切相关。进一步通过多因素Logistic回归分析,显示左前降支、病变血管支数、更长的心肺复苏时间、发生心脏骤停至植入ECMO时间可能加重患者死亡的风险,而植入ECMO复苏后48 h的较高的平均动脉压可能减少患者死亡的风险,可能与其供血范围主要为左心室前壁和室间隔,左前降支闭塞对左心功能的影响更大,导致发生不可逆转的心功能衰竭。
有研究显示,植入ECMO后的48 h平均动脉压在一定程度上反映患者血流动力学稳定程度,是患者存活出院的独立预测因子[10]。本研究死亡组中2例患者因脑出血死亡,其原因与抢救过程中血管活性药物的应用、抗凝药物的使用以及植入ECMO后患者自主心跳恢复血压回升,内环境改善,可因药物蓄积,机体对药物的敏感性增加,从而出现血压骤升,导致脑出血或其他脏器出血的可能[11,12],因此,植入ECMO过程中必须密切监测血压,控制血管活性药物的使用剂量及泵入速度。
ECMO装置属于非生物相容性植入型心脏辅助装置,对血液系统的损伤较大,因此在综合判断患者恢复情况下要适时撤离,避免严重并发症的发生[13,14]。本研究37例患者中1例患者出现的较为严重的下肢缺血性损害,考虑原因可能与撤机前肝素用量不足,撤机过程使用取栓器损伤血管内皮有关。但植入ECMO时,下肢并发症病因相对明确,通过及时采取有效的干预措施可降低肢体并发症的发生率。
经过综合回顾性分析,笔者认为植入ECMO抢救需注意以下几点:ECMO的建立必须迅速,研究显示心脏骤停至植入ECMO时间是影响患者存活的重要因素;植入ECMO过程中必须持续传统的心肺复苏;植入ECMO抢救过程中要注意控制血压及血管活性药物的使用剂量及给药速度;在评估患者恢复情况下要实施撤离,可降低严重并发症的发生率[15,16]。
本研究取得了一定的临床疗效,但仍有不足之处,一是本研究的观察时间短,缺少近远期随访,导致患者远期疗效不明确;二是本研究患者病例数较少,代表性较差。
ECMO联合急诊PCI可显著改善梗死心肌的再灌注,扩大心脏骤停患者的救治窗口,提高患者抢救的成功率,且安全性较高,但ECMO在心脏骤停抢救中的应用仍处于起步阶段,且植入ECMO前传统心肺复苏的时间较长,因此,建立完善的ECMO复苏救治体系及流程成为必要[14],有望进一步提高AMI后心脏骤停患者的ECMO救治成功率。
[1]中国医师协会急诊医师分会, 中华医学会心血管病学分会, 中华医学会检验医学分会等. 急性冠脉综合征急诊快速诊疗指南[J].中华急诊医学杂志, 2016, 25(4): 397-404. DOI: 10. 3760/cma. j.issn. 1671-0282. 2016. 04. 002.
[2]Mishra S. Upscaling cardiac assist devices in decompensated heart failure: choice of device and its timing[J]. Indian Heart J, 2016, 68 supp1 1: S1-4. DOI: 10. 1016/j. ihj. 2015. 12. 012.
[3]Wijns W, Kolh P, Danchin N, et al. Guideliness on myocardial revascularization[J]. Eur Heart J, 2010, 31(33): 2501-2555. DOI: 10.1007/s12265-015-9632-6.
[4]崔锦钢, 吴元, 赵冬云, 等. 主动脉内球囊反搏在急性冠状动脉综合征治疗中的临床应用及并发症情况分析[J]. 中国循环杂志,2015, (2): 107-110. DOI: 10. 3969/j. issn. 1000-3614. 2015. 02. 003.
[5]王斯聪, 郑俊波, 于凯江, 等. 主动脉内球囊反搏及动静脉体外膜氧合治疗心源性休克的现状[J]. 中国急救医学, 2016, 36(11):1054-1057. DOI: 10. 3969/j. issn. 1002-1949. 2016. 11. 020.
[6]李宏亮, 孟超, 朱曦, 等. 体外膜肺氧合应用于危重症患者的初步探讨[J]. 中国危重病急救医学, 2012, 24(2): 86-89. DOI: 10. 3760/cma. j. issn. 1003-0603. 2012. 02. 008.
[7]Lee SW, Yu MY, Lee H, et al. Risk factors for acute kidney injury and in-hospital mortality in patients receiving extracorporeal membrance oxygenation[J]. PLoS One , 2015, 10(11): 229-234. DOI: 10. 1186/s13613-017-0275-4.
[8]Lu L, Qi L, Du L, et al. Middle east respiratory syndrome coronavirus(MERS-CoV): challenges in identifying its source and controlling its spread[J]. Microbes Infect, 2013, 15(23): 625-629. DOI:org/10. 1016/j. micinf. 2013. 06. 003. .
[9]Spiro J, Doshi SN. Use of left ventricular support devices during acute coronary syndrome and percutaneous coronary intervention[J].Curr Caidiol Rep, 2014, 16(1): 1-9. DOI: org/10. 1007/s11886-014-0544-x.
[10]尚永志, 冯雁, 秦雷, 等. IABP辅助直接PCI治疗急性ST段抬高型心肌梗死合并心源性休克的效果和危险因素分析[J]. 中国急救医学, 2016, 36(10): 918-923. DOI: 10. 3969/j. issn. 1002-1949.2016. 10. 013.
[11]刘迎午, 李彤, 彭文近, 等. 体外膜肺氧合辅助下介入治疗急性心肌梗死合并心原性休克一例[J]. 中华心血管病杂志, 2015, 43(12):1097-1098. DOI: 10. 3760/cma. j. issn. 0253-3758. 2015. 12. 018.
[12]张燕, 任艺虹, 周超飞, 等. 经皮冠状动脉介入治疗术后急性、亚急性支架内血栓形成的危险因素分析[J]. 中国循环杂志, 2013,23(1): 17-20. DOI: 10. 3969/j. issn. 1000-3614. 2013. 01. 006.
[13]陈永强. 《2015美国心脏协会心肺复苏及心血管急救指南更新》解读[J]. 中华护理杂志, 2016, 51(2): 253-256. DOI: 10. 3761/j. issn.0254-1769. 2016. 02. 022.
[14]刘巍, 周玉杰, 刘宇杨, 等. 有冠状动脉旁路移植术史的急性心肌梗死患者经皮冠状动脉介入治疗的临床预后[J]. 中国循环杂志,2013, 23(3): 179-182. DOI: 10. 3969/j. issn. 1000-3614. 2013. 03.007.
[15]Stub D, Bernard S, Pellegrino V, e1 al. Refractory cardiac arrest treated with mechanical CPR, hypothermia, ECMO and early reperfusion(the CHEER trial ) [J]. Resuscitation, 2015, 86(9): 88-94. DOI: org/10. 1016/j. resuscitation. 2014. 09. 010.
[16]董梅, 任法新, 牟楠, 等. 急性心肌梗死患者经皮冠状动脉介入治疗术后慢血流发生 与梗死相关动脉病变局部白细胞介素-6水平的关系[J]. 中国循环杂志, 2013, 24(3): 185-188. DOI: 10. 3969/j.issn. 1000-3614. 2014. 03. 007.
