CD133联合外周循环肿瘤细胞在结直肠癌预后评估中的应用研究
2018-06-29杨国华郑圣斌林彩锋黄若磊
杨国华 郑圣斌 林彩锋 黄若磊
结直肠癌发病率为恶性肿瘤第三位,病死率位居恶性肿瘤第四位,常见死亡原因为肿瘤复发或转移。近年来,国内外学者研究发现结直肠癌组织中存在一群细胞表面表达CD133的亚组癌细胞,含有该组癌细胞的肿瘤组织其复发率及转移率明显升高。外周循环肿瘤细胞(circulating tumor cell,CTC)指外周循环血液中的肿瘤细胞,学者研究[1-2]发现CTC数量与病人预后呈负相关,数量越多其预后越差。结直肠癌预后判断一直是结直肠癌临床研究热点,本文拟对CD133联合CTC两因素在结直肠癌预后评估应用的可行性作一研究。
资料与方法
一、一般资料
收集自2012年1月至2013年1月福建省立医院胃肠外科及肿瘤外科132例结直肠癌手术标本,年龄为(52.7±13.9)岁,年龄范围为35~86岁。132例均行术前肠镜及术后标本病理证实,其中高分化29例,中分化72例,低分化31例;按美国国立综合癌症网络(NCCN)指南2016年第2版TNM分期Ⅰ期26例,Ⅱ期32例,Ⅲ期51例,Ⅳ期23例。
二、随访方法及内容
采取病人门诊随访及电话随访,术后前2年每3个月复查,第3年每半年复查,复查内容:血常规、生化、癌胚抗原(CEA)、CTC,胸片、腹部B超;每半年复查全腹及胸部CT,每年复查肠镜。
三、标本组织中CD133测定
10%甲醛溶液固定新鲜组织标本,连续薄切厚4 μm病理切片共3张,常规病理HE染色,采用ABC法行免疫组织化学病理染色。步骤如下:切片常规脱蜡后用梯度乙醇水化,3%H2O2灭活内源性过氧化物酶,磷酸盐缓冲液(PBS)冲洗后加入一抗鼠抗人CD133单克隆(1∶40),用二氨基联苯胺(DAB)显色后加入苏木精复染,树脂封片。参考文献[3]标准:CD133阳性表达为境界清晰、突出于背景的棕黄色,定位于细胞质、细胞膜同时呈棕黄色亦为阳性。计分标准参照Hilbe等[4]的方法,随机选取4个高倍视野约200个细胞,计数肿瘤细胞CD133阳性数,取三张阳性切片平均值作为计数结果,细胞数>10%为阳性,≤10%为阴性。
四、CTC测定
术前采外周血10 ml,置于50 ml离心管中1 500 r/min离心,后加入CS1血小板裂解液45 ml后再次离心,去除血清等上清至12 ml,摇匀加入CS2红细胞裂解液裂解红细胞,离心去除上清,留下白细胞与特种细胞沉淀,加300 μl CS1摇匀沉淀细胞,加入磁微粒吸附离心,去除结合白细胞的磁微粒沉淀。再次离心去上清至100 μl,加CF1混匀细胞悬液涂片,置25℃~33℃无风烘箱烘干。染色鉴定:将细胞干片加CF2固定液固定8 min后,浸泡SSC试剂10 min后,加入杂交探针,放入杂交仪杂交1.5 h后,取出浸泡43℃预热后的甲酰胺试剂15 min,再次浸泡SSC试剂10 min,用BSA清洗标本区后加入CD45孵育1 h后取出加入4′,6-二脒基-2-苯基吲哚(DAPA)染色,盖上盖玻片,放置4℃冰箱保存。最后使用荧光显微镜先在蓝色通道下找到靶细胞层面,换到20倍物镜,分别在三种通道(蓝色、红色、橙色或绿色)下观看信号、细胞状态、CD45着色等情况。CTC细胞表现为:单个细胞状态,核质均匀,未发现分层,细胞表面无或仅一颗结合白细胞磁微粒;红色通道下未见CD45红色,CD45阴性。橙色或绿色信号3个或3个以上,且在细胞核上。我们参考文献[5]标准:CTC>3个/7.5 ml为高水平量(H-CTC),≤3个/7.5 ml为低水平量(L-CTC)。
五、观察指标
观察CD133、CTC与临床病理各因素之间的关系,并进一步将实验分为4个组,第1组为CD133阴性(CD133-)L-CTC,第2组为CD133-H-CTC,第3组为CD133阳性(CD133+)L-CTC,第4组为CD133+H-CTC,绘制各组的3年生存曲线。
六、统计学分析
结 果
一、随访情况
本组完整随访了124例,失访8例;随访病例中CD133-L-CTC共59例,CD133-H-CTC共21例,CD133+L-CTC共35例,CD133+H-CTC共9例。
二、临床各因素与CD133、CTC之间的关系
CD133阳性组与CD133阴性组病人在淋巴结转移、远处转移、腹膜种植、组织分化、神经脉管侵犯等因素方面比较,差异均具有统计学意义(P<0.05或P<0.01);而在结肠癌位置(P=0.755)、病人性别(P=0.069)、年龄(P=0.697)、肿瘤浸润深度(P=0.231)、CEA水平(P=0.054)方面两组差异均无统计学意义。CTC高水平量组与CTC低水平量组病人在肿瘤位置、肿瘤浸润深度、淋巴结转移、远处转移、腹膜种植、组织分化、神经脉管侵犯等因素方面比较,差异均具有统计学意义(P<0.05或P<0.01)。(表1)
三、各组生存曲线关系
CD133-L-CTC组生存时间与CD133+L-CTC组之间差异无统计学意义(P=0.452);但明显高于CD133-H-CTC 组(P=0.037)及CD133+H-CTC

表1 临床各因素与CD133、CTC之间的关系(例)
组(P<0.01);CD133+L-CTC组生存时间明显高于CD133-H-CTC组(P=0.042)及CD133+H-CTC组(P<0.01);CD133-H-CTC组生存时间明显高于CD133+H-CTC组,两组之间差异具有统计学意义(P=0.035)。(表2、图1)

表2 各组生存时间及95%可信区间(d)
注:与CD133-L-CTC组比较,aP<0.05;与CD133-H-CTC组比较,bP<0.05;与CD133+L-CTC组比较,cP<0.05
四、CTC镜下特征
CTC在镜下表现:细胞呈单个细胞状态,核质均匀,红色通道下未见CD45红色,CD45阴性。橙色或绿色信号3个或3个以上,且在细胞核上。(图2、3)
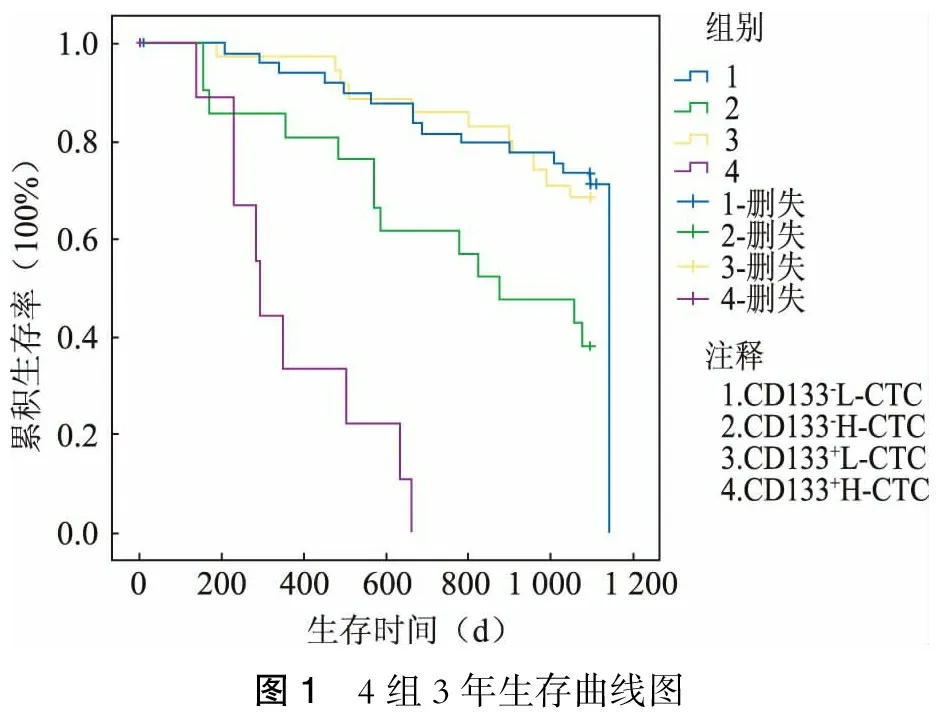
图1 4组3年生存曲线图

图2 CTC在荧光显微镜(×40)镜下表现 A.CTC单个细胞状态,细胞核上呈3个橙色及1个绿色信号,核质均匀,CD45阴性,未见红色;B.CTC单个细胞状态,细胞核上呈3个橙色及2个绿色信号,核质均匀,CD45阴性,未见红色
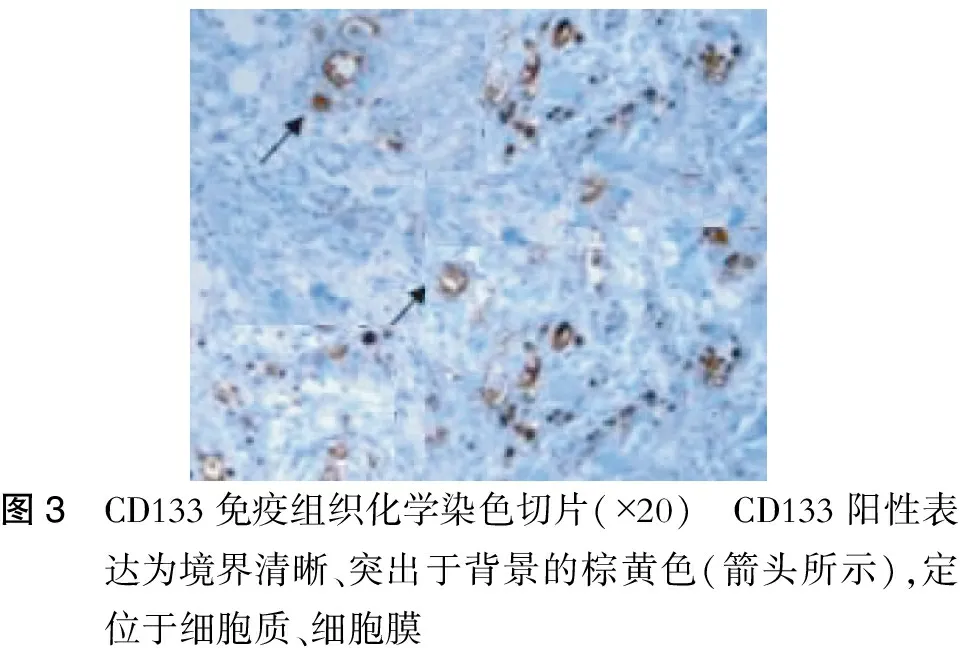
图3 CD133免疫组织化学染色切片(×20) CD133阳性表达为境界清晰、突出于背景的棕黄色(箭头所示),定位于细胞质、细胞膜
讨 论
结直肠癌是全球肿瘤死亡的主要原因之一,其致死的主要原因为肿瘤复发或转移,大约有15%~25%的病人就诊时同时合并肝转移,25%~50%在原发灶切除术后发生肝转移[6-7]。本研究发现:结直肠癌组织中CD133阳性与肿瘤淋巴结转移、远处转移、腹膜种植、组织分化、神经脉管侵犯明显相关。这可能与CD133表达上调在结直肠癌中增高肝转移率,其预后更差;学者研究表明对于结直肠癌CD133阳性干细胞样细胞,它们与结直肠肿瘤的侵袭和分化呈正相关[8-11]。本研究还发现,CD133阳性与阴性病人在术后3年内二者生存曲线无明显差异,但术后2年时CD133阳性病人其生存时间开始低于CD133阴性组,远期生存时间有待进一步随访。
近年来国内外学者从结直肠癌肝转移病人外周血发现CTC,血液中CTC的分子表征提供了替代或补充的非侵入性方法组织活检[12-13];CTC可作为结直肠癌伴肝转移病人的独立预后因素,CTC阳性组的总生存期及无病生存期明显低于阴性组[14]。本研究结果表明:CTC数量与肿瘤浸润深度、淋巴结转移、远处转移、腹膜种植、组织分化、神经脉管侵犯呈明显正相关,而上述几个因素是结直肠癌术后预后不良主要因素[15];本研究结果表明:CTC低水平量组其3年生存期明显好于高水平量组,CD133-L-CTC组生存时间为(1 002.8±39.1) d,CD133+L-CTC-组为(980.5±38.8) d,明显高于CD133-H-CTC组的(782.5±75.8) d及CD133+H-CTC组的(368.6±31.0) d,差异均具有统计学意义,说明CTC高水平的结直肠癌预后差,其原因与上述结直肠癌预后不良因素相关。本研究还发现,CTC还与肿瘤位置有关,左半结肠CTC水平明显高于右半结肠,两组比较差异具有统计学意义。这与临床左半结肠癌预后明显差于右半结肠相符,其具体分子机制目前尚不明,有待进一步分子机制研究。
通过本研究表明,CD133联合CTC可用于结直肠癌术后3年生存时间评估,CD133阴性且CTC低水平量组预后好,而CD133阳性且CTC高水平量组预后差。CD133可能与病人3年生存期无明显相关,可能与远期生存时间有关;而CTC水平与病人近期生存时间明显相关。其远期预后评估有待一步随访。
1 Rahbari NN, Aigner M, Thorlund K, et al. Meta-analysis shows that detection of circulating tumor cells indicates poor prognosis in patients with colorectal cancer. Gastroenterology,2010,138:1714-1726.DOI:10.1053/j.gastro.2010.01.008.
2 Groot Koerkamp B, Rahbari NN,Buchler MW,et al.Circulating tumor cells and prognosis of patients with resectable colorectal liver metastases or widespread metastatic colorectal cancer: a meta-analysis. Ann Surg Oncol,2013,20:2156-2165.DOI:10.1245/s10434-013-2907-8.
3 Mia J,So YJ,Kim IU,et al.CD133 expression is not an independent prognostic factor in stage II and III colorectal cancer but may predict the better outcome in patients with adjuvant therapy.BMC cancer,2013,5:166-176.DOI: 10.1186/1471-2407-13-166.
4 Hilbe W,Dimhofer S,Oberwasserlechner F,et al.CD133 positive endothelial progenitor cells contribute to the tumour vasculature in non-small cell lung cancer.J Clin Pathol,2004,57:965-969.DOI:10.1136/jcp.2004.016444.
5 Matsusaka S,Suenaga M,Mishima Y,et al.Circulating tumor cells as a surrogate marker for determining response to chemotherapy in Japanese patients with metastatic colorectal cancer. Cancer Sci,2011,102:1188-1192.DOI:10.1111/j.1349-7006.2011.01926.
6 Jemal A,Bray F,Center MM,et al. Global cancer statistics. CA Cancer J Clin,2011,61:69-90.DOI:10.3322/caac.20107.
7 Pawlik TM,Choti MA. Surgical therapy for colorectal metastases to the liver. Gastrointest Surg,2007,11:1057-1077.
8 Lim SH,Jang J,Park JO,et al. CD133-positive tumor cell content is a predictor of early recurrence in colorectal cancer.Gastrointest Oncol,2014,5:447-456. DOI: 10.3978/j.issn.2078-6891.2014.071.
9 Kishikawa J,Kazama S, Oba K,et al.CD133 Expression at the metastatic site predicts patients' outcome in colorectal cancer with synchronous liver metastasis.Ann Surg Oncol,2016,23:1916-1923.DOI:10.1245/s10434-016-5099-1.
10Kazama S,Kishikawa J,Yasuda K,et al.CD133 expression in lymph node metastases is associated with tumor aggressiveness during lymph node metastasis in colorectal cancer.Anticancer Res,2015,35:6599-6605.
11Chen S,Song X,Chen Z,et al.CD133 expression and the prognosis of colorectal cancer:a systematic review and meta-analysis.PLoS One,2013,8:e 56380.DOI:10.1371/journal.pone.0056380.
12Maheswaran S,Haber DA.Circulating tumor cells:a window into cancer biology and metastasis.Curr Opin Genet Dev,2010,20:96-99.DOI: 10.1016/j.ajpath.2010.12.003.
13Devriese LA,Voest EE,Beijnen JH,et al.Circulating tumor cells as pharmacodynamic biomarker in early clinical oncological trials.Cancer Treat Rev,2011,37:579-589.DOI:10.1016/j.ctrv.2011.04.006.
14Groot KB,Rahbari NN,Büchler MW,et al.Circulating tumor cells and prognosis of patients with resectable colorectal liver metastases or widespread metastatic colorectal cancer: a meta-analysis.Ann Surg Oncol,2013,20:2156-2165.DOI:10.1245/s10434-013-2907-8.
15Hinz S,Hendricks A,Wittig A,et al.Detection of circulating tumor cells with CK20 RT-PCR is an independent negative prognostic marker in colon cancer patients - a prospective study.BMC Cancer,2017,17:53-64.DOI:10.1186/s12885-016-3035-1.
