硝酸−磷酸混合溶液中钨的萃取
2018-06-29杨金洪李江涛刘文婷赵中伟
杨金洪,李江涛,刘文婷,赵中伟
硝酸−磷酸混合溶液中钨的萃取
杨金洪,李江涛,刘文婷,赵中伟
(中南大学 冶金与环境学院,长沙 410083)
对比研究不同萃取体系下硝酸−磷酸混合溶液中钨的萃取−反萃行为,从萃取效率、分相程度及反萃效率等方面考虑选取仲碳伯胺萃取剂N1923作为钨的萃取剂,系统研究N1923对钨的萃取−反萃行为,确定了最佳的萃取/反萃工艺参数。在最优工艺参数下处理配制含有磷钨酸的硝酸−磷酸混合溶液,即在20%N1923(体积分数)+磺化煤油组成的有机相体系、相比1:1、温度20 ℃、接触时间10 min的条件下,钨萃取率高达99.9%;反萃率条件为:温度50 ℃、相比2:1、氨水浓度12.5%(质量分数)、接触时间10 min,钨单级反萃率可达93.5%。在优化条件下萃取硝酸−磷酸混合溶液浸出白钨矿的实际料液,钨的萃取率达到99.9%以上,反萃时通过提高相比和氨水浓度的手段,使反萃液中WO3浓度提高到200g/L以上,反萃率达到98%以上。
硝酸磷酸混合溶液;白钨矿;磷钨酸;溶剂萃取;N1923
钨的经济矿物主要为黑钨矿[(Fe,Mn)WO4]和白钨矿(CaWO4),其中白钨资源占世界钨资源储量的2/3以上[1]。传统的处理白钨矿工艺为盐酸分解工艺,该工艺存在着操作环境差、Cl−腐蚀等问题,目前已基本上被淘汰[2]。现在国外企业主要采用苏打压煮工 艺[3−4],国内企业广泛应用的是碱压煮工艺[5−6]。苏打压煮和碱压煮工艺主要存在着试剂用量大,钠碱试剂成本高、有害钠盐排放大等问题[7−8]。为此,研究人员提出了硝酸−磷酸络合浸出白钨矿的方法[9−10]。该方法利用磷易与钨形成可溶性杂多酸的特性,使矿物中伴生的磷分解与钨结合从而避免固体钨酸的产生;同时钙以溶解度很大的硝酸钙形式进入溶液,从而避免了固体含钙产物层的阻滞作用;硝酸通过再生实现了循环使用。与盐酸相比,硝酸的腐蚀性和挥发性较小,且避免了浸出液中钨被还原成低价的钨蓝影响后续的提取。
对于硝酸磷酸浸出液中钨的提取,未见有相关的研究报道。目前,白钨矿浸出液中钨的提取技术主要是用来处理从碱压煮工艺或苏打压煮工艺得到的粗钨酸钠溶液。粗钨酸钠溶液中钨呈WO42−离子存在,国内的钨冶炼企业通常用强碱性阴离子交换树脂来从碱压煮工艺的浸出液中提取钨[11]。对于苏打压煮的浸出液,主要采用硫酸来将粗钨酸钠溶液中和至弱酸性(pH为2.5~4),此时钨以聚合的同多酸阴离子形态存在,再采用叔胺类萃取剂萃取(如三辛烷基叔胺N235、三辛胺、三癸胺等),以高碳醇或TBP作为改质剂,以煤油作为稀释剂[12]。也有学者采取盐酸或硫酸直接酸化粗钨酸钠溶液,在高酸的环境下使钨以H2WO4形成沉淀,从而回收钨[12]。近几年,有研究人员[13−14]采用碳酸根型季铵盐从碳酸钠浸出液中直接萃取钨,以NH4HCO3+NH4OH混合溶液为反萃剂,用离心萃取器串级萃取与反萃,从而解决了萃取体系分相性能差、反萃液WO3浓度低的问题。
由上可知,浸出液中钨的提取方法主要与其在溶液中的形态戚戚相关。在硝酸磷酸浸出白钨矿的溶液中,由于磷对钨的络合作用,使得钨主要以磷钨酸(H3PW12O40)的形式存在。YANG等[15]报道了萃取法提取磷钨酸的研究工作,该研究采用Aliquat336+仲辛醇体系从硫酸−磷酸溶液中萃取磷钨酸,在弱酸的环境下(pH=2),磷钨酸的萃取效果最佳,达到99.8%以上,体系的酸度过高将严重影响磷钨酸的萃取效果。LIAO等[16]进行了TBP+仲辛醇/异辛醇/乙酸丁酯体系萃取硫酸−磷酸溶液中磷钨酸的研究工作,指出磷酸浓度增大或陈化时间延长都将不利于磷钨酸的萃取。
考虑到钨在硝酸−磷酸体系的存在形态与在硫酸−磷酸体系中类似,本研究中拟采用萃取的方法来提取磷钨酸。由于本文作者溶液体系的硝酸浓度高(约3.5 mol/L)、且具有强氧化性,需筛选出一种适应高酸高氧化性环境的萃取体系,进一步研究该体系下磷钨酸的萃取/反萃行为,从而实现钨与浸出液的分离,并富集转型得到用于制备APT的高浓度钨酸铵溶液。
1 实验
1.1 实验原料
本研究中使用的实验料液为配制的磷钨酸溶液和柿竹园钨矿浸出液。
1) 配制磷钨酸溶液:将磷钨酸晶体加入到配好的硝酸磷酸混合溶液中,得到的磷钨酸溶液含WO365.0 g/L,HNO3220.5 g /L, H3PO46.9 g/L。实验中所用的试剂硝酸、磷酸和磷钨酸均为分析纯。
2) 柿竹园钨矿浸出液: 采用前期实验研究的白钨矿络合分解的工艺条件来分解柿竹园白钨精矿[10],即硝酸3.5 mol/L,磷与白钨矿中钨的摩尔比为1:4,浸出温度80 ℃,反应时间3 h,液固比10:1(mL:g),分解完成得到的浸出液成分含WO360.39 g/L、H3PO47.24 g/L。
1.2 实验方法
1.2.1 实验操作步骤
萃取实验操作:1) 将配制好的有机相加入到250 mL梨形分液漏斗中;2) 将磷钨酸浸出液加入到梨形分液漏斗中与有机相混合后,放置到预先升温至反应温度的恒温水浴振荡器中,振荡到所需的反应时间后静置分层,记录分相时间;3) 分相完成后取样分析萃余液中的钨浓度,计算钨的萃取率。
负载有机相的反萃实验操作:1) 将50 mL的负载钨的有机相加入到250 mL梨形分液漏斗中;2) 将反萃剂加入到分液漏斗后,再放置到预先升温至所需温度的恒温水浴振荡器中,振荡到所需的反应时间后静置分层,记录分相时间;3) 分相完成后放出反萃液;4) 采用去离子水50 mL洗涤有机相两次与反萃液合并后定容至250mL;若反萃液中出现白色沉淀的情况下,需向反萃液中加入5 g NaOH,然后在电炉上加热至白色沉淀溶解,再定容至250 mL;5) 取样分析反萃液中的钨浓度,计算钨的反萃率。
所有的萃取−反萃实验中的相比均为有机相体积与水相体积之比。
1.2.2 实验检测方法
样品中的钨浓度采用电感耦合等离子发射光谱仪ICP-OES分析,设备型号为IRIS Intrepid II,厂家为Thermo Electron Corporation。
磷钨酸料液中WO3的浓度为f(g/L),所处理的料液体积为f(L)。萃取结束后萃余液中的WO3的浓度为经检测后为r(g/L),萃余液体积为r(L)。负载有机相经反萃后反萃液体积为s(L),反萃结束后反萃液中的WO3的浓度为经检测后为s(g/L)。
萃取率的计算公式为

反萃率的计算公式为
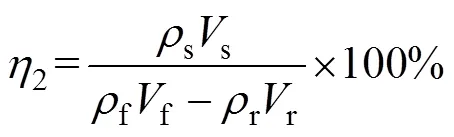
2 结果与讨论
2.1 不同萃取体系对硝酸磷酸混合溶液中钨的萃取−反萃行为
本研究选取了N235、TBP、仲辛醇、N1923体系对钨的萃取−反萃行为进行了研究。萃取条件:料液50 mL、相比O/A 1:1、温度27 ℃、接触时间10 min。不同萃取体系的实验结果如表1所示,表1中的有机相组成均为各组分的体积分数。由表1可看出,萃取剂N235、N1923、仲辛醇和TBP对磷钨酸均有较好的萃取效果,萃取率都在96%以上,其中N235和N1923对钨的萃取效果最好,萃取率接近100%,萃余液的浓度低至0.01 g/L以下。但在实验研究中发现,采用40%N235+磺化煤油体系萃取剂时,有机相分为上下两层,水相在中间层;当有机相配入一定量的TBP作为改质剂时,即采用40%N235+20%TBP(体积分数)+磺化煤油体系萃取时,可有效解决有机相分层的问题。
从萃取效率的角度来看, N235+TBP+磺化煤油体系和N1923+磺化煤油体系均获得了较满意的效果。为此,本研究进一步考察了上述两个体系反萃的效果,反萃条件为:氨水浓度12.5%,相比3:1(约是理论量的4.5倍),反萃时间10 min,温度22 ℃。
40%N235+20%TBP+磺化煤油体系的负载有机相反萃完成后分相,分3层,上层为有机相,中间层为水相,底部有4 mL左右的粘稠物,廖宇龙[17]也报道了负载磷钨酸的15%N235+10%TBP+磺化煤油有机相在采用NaOH反萃时出现胶状粘稠物沉于水相底部的现象。
40%N1923+磺化煤油体系的负载有机相反萃完成后分相快,相界面清晰,反萃液透明清澈,单级反萃率77.6%,经二级反萃,反萃率达到93.6%。从萃取和反萃的综合效果来看,N1923是较为理想的萃取剂,后续的实验均用此作为该萃取剂进行研究。
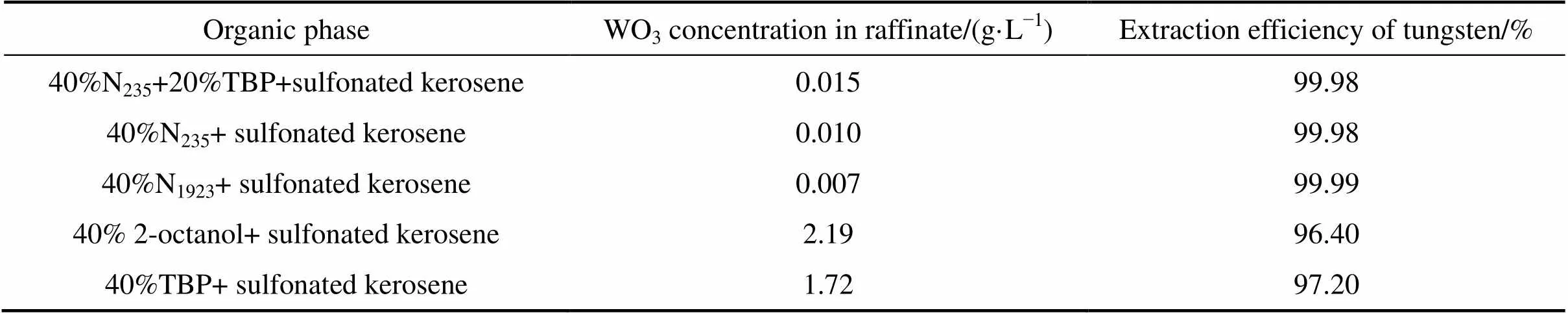
表1 不同萃取体系下钨的萃取效果
2.2 N1923萃取体系对硝酸磷酸混合溶液中钨的萃取行为
本研究中选取N1923作为萃取剂,磺化煤油为稀释剂,考察了N1923浓度、相比、反应温度、接触时间等因素对配制的硝酸磷酸混合溶液中钨的萃取行为影响规律。
2.2.1 N1923浓度对钨萃取效果的影响
不同有机相中N1923体积分数对钨萃取效果的影响如图1所示。萃取操作条件:相比O/A 1:1、温度20 ℃、接触时间10 min。
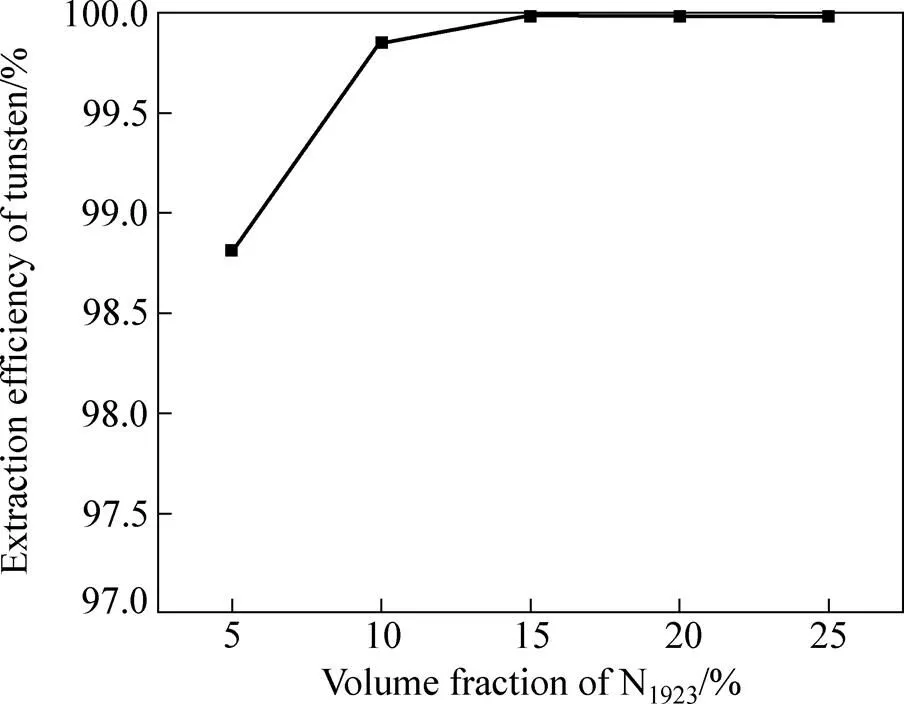
图1 不同N1923浓度对钨萃取效果的影响
从图1中可以看出,随着有机相中N1923含量的增大,钨的萃取率逐渐提高,当有机相中N1923体积分数的增大到15%时,钨萃取率达到99.94%,此时萃余液中钨的浓度降低到0.036 g/L。在实验操作中发现,当有机相中N1923体积分数太低(为5%)时,单位体积的N1923负载的钨则增多,则形成密度较大的钨萃合物从有机相中析出沉积到漏斗底部,形成了有机相−水相−有机相的分层,难以实现萃取分离操作;当N1923体积分数上升至15%时,萃取完成后静置分相快,相界面清晰,未产生第三相。因此,从便于萃取操作和节省有机物成本等方面综合考虑,选用20%N1923(体积分数)+磺化煤油作为有机相。
2.2.2 相比对钨萃取效果的影响
表2所列为不同相比下钨的萃取结果。从表2可以看出,相比O/A从1:4增大到3:1时,钨的萃取率均在99.8%以上。但在萃取过程中发现,随着相比的降低,即处理料液体积的增大,进入有机相中的钨含量也在逐步增加,有机相的密度和水相密度差逐渐缩小,分相时间则越来越长。从相比3:1到1:1时,1 min内则分相完全,相界面清晰;当相比降低到1:2时,则需要5 min才可以分相完全;相比为1:3时分相则需要30 min,而且有机相已经分为两层,水相在中间层。选用相比为1:1~1:2可实现钨的高效萃取,并有利于分相。
2.2.3 温度对钨萃取效果的影响
考察了相比(O/A)为1:1,不同的萃取温度对钨萃取效果的影响,如表3所示。当温度在20~40 ℃范围内变化时,钨萃取率均在99.95%以上,静置分相快、相界面清晰。说明温度对萃取率的影响不大,在室温条件下即可实现钨的高效萃取。
2.2.4 接触时间对钨萃取效果的影响
考察了相比(O/A)为1:1,不同接触时间对钨萃取效果的影响如表4所示。从表4可以看出,钨的萃取非常迅速,在短短的0.5 min内便可达到99.5%以上的萃取率,但是从实验现象来看当接触时间过短时,在静置分相时会出现分相慢、水相浑浊、分相界面不清晰等问题。随着接触时间的增加,上述现象会逐渐消失,当接触时间达到5 min以上时,则静置分相快,水相清晰、分相界面清晰,考虑操作的稳定性,选取了接触时间10 min。
2.2.5 萃取饱和容量的测定
采用相比变化法[18]测定了20 ℃下钨的萃取等温线,如图2所示。图2靠近原点附件的等温线几乎为一条直线,此时有机相过剩,萃余液中钨浓度低。随着平衡水相钨浓度的不断提高,对应有机相中钨浓度也逐渐提高,曲线逐渐趋于水平。对接近水平的曲线段作切线,得到与纵轴的交点即为含N1923(体积分数)20%有机相的钨萃取饱和容量,此条件下钨萃取饱和容量约为276 g/L。图2也直观地说明N1923的萃取容量大、萃取效率高、单级萃取即可使水相中钨的浓度将至0.1 g/L以下。在进行萃取条件优化时,20%N1923+磺化煤油、20 ℃、接触时间10 min、相比1:1条件下钨的操作萃取容量达到了65 g/L;当相比进一步降低到1:2时,仍具有很好的萃取效果,此时钨的操作萃取容量达到了130 g/L,但由于负载钨量的增加,使得有机相和水相密度差进一步缩小,需要静置5 min才可以达到完全分相。
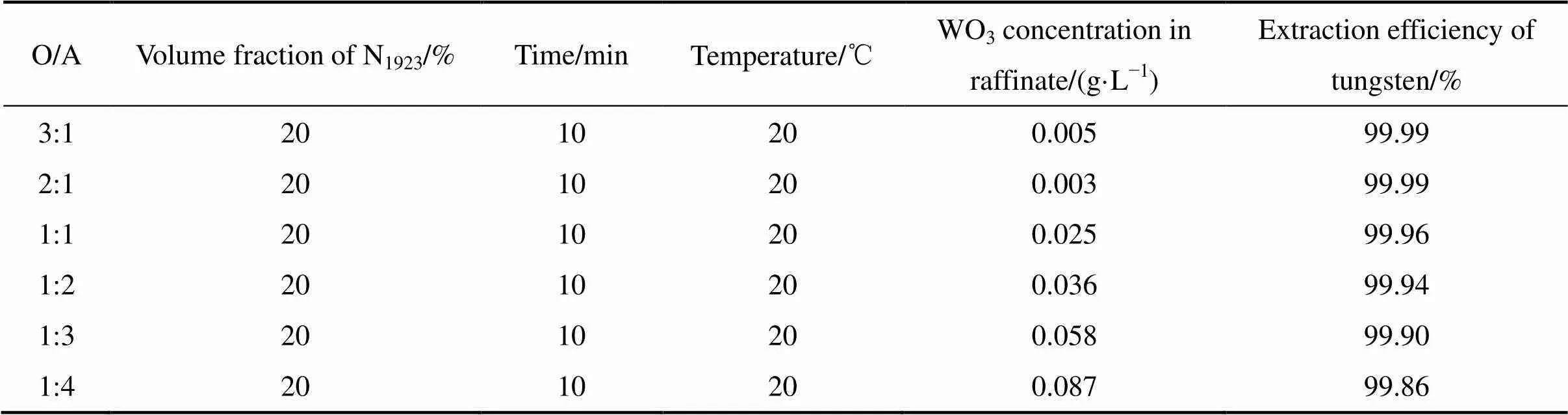
表2 相比对钨萃取效果的影响
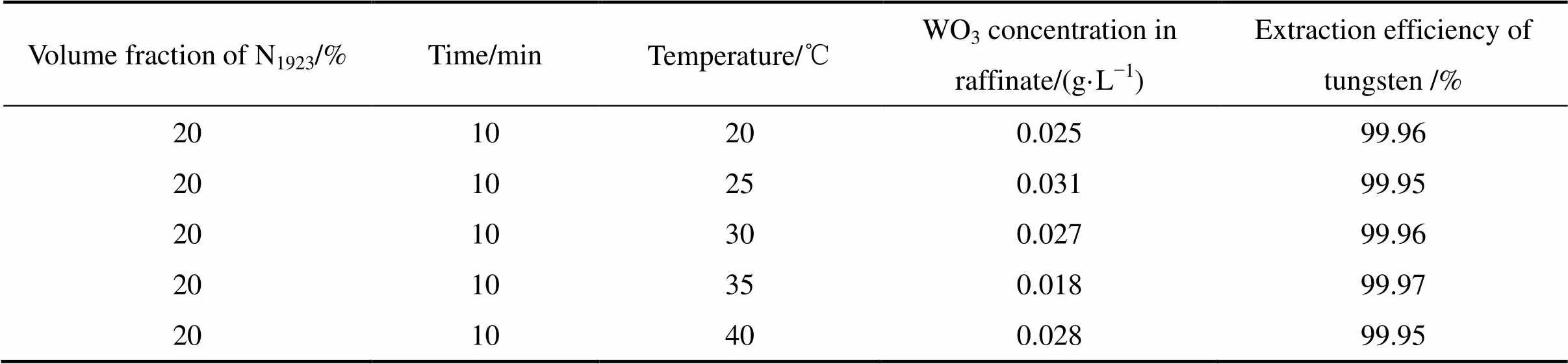
表3 相比1:1时温度对钨萃取效果的影响
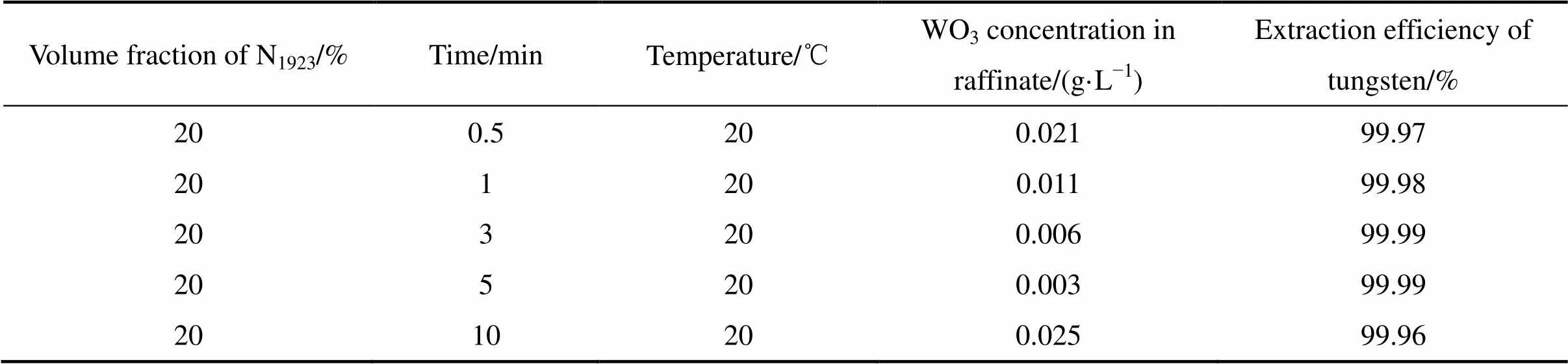
表4 相比1:1时接触时间对钨萃取率的影响
从已有的钨萃取研究报道来看,不同有机相组成的钨饱和萃取容量一般在50~100 g/L范围。例如采用350 g/L N263、20~25%仲辛醇、其余为煤油(200#航空煤油)的萃取体系[12]萃取苛性钠分解体系中的钨,其钨饱和萃取容量为59.14 g/L;柯兆华等[19]采用50%三辛基甲基氯化铵+20%仲辛醇+30%磺化煤油的有机相体系来萃取苛性钠分解体系中的钨,当体系NaOH浓度达100 g/L时钨饱和萃取容量为88.30 g/L,需采用离心萃取设备来解决该萃取过程中重力分相慢问题。
通过与已有的钨萃取相关数据对比,并避免分相慢的问题,本研究可适当控制N1923的操作萃取容量在65~130 g/L,来满足后续钨酸铵溶液的制取。若追求高的萃取容量来获得更高浓度的钨酸铵溶液,则需采用离心萃取分离设备解决分相慢的问题。
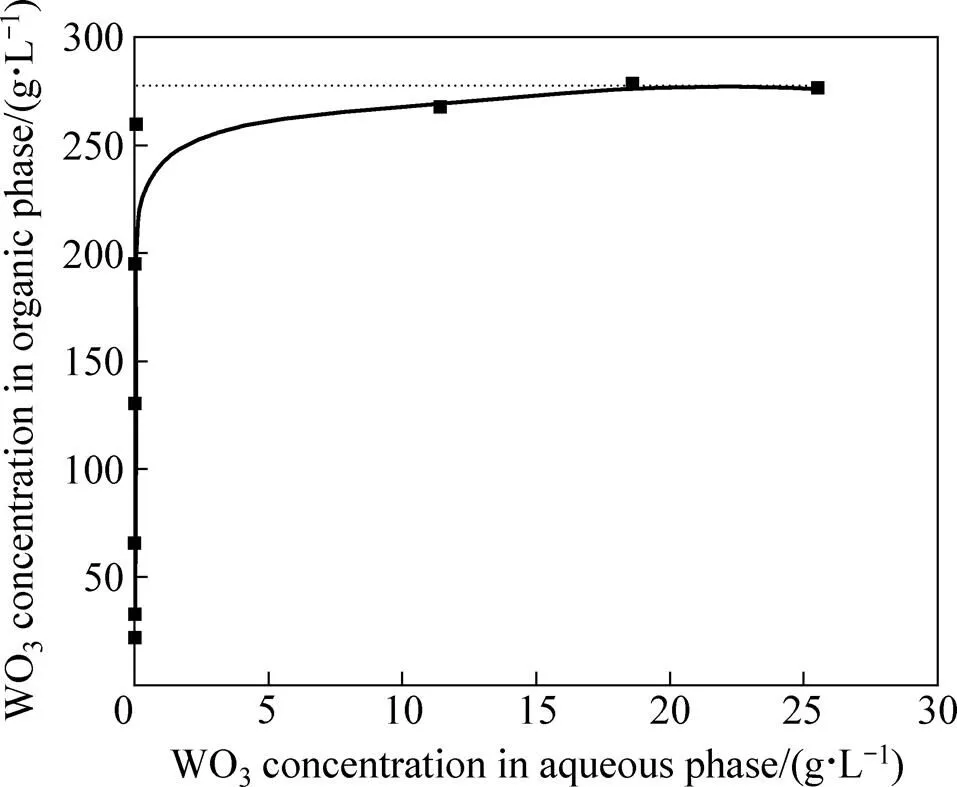
图2 钨的萃取等温线(20%N1923+磺化煤油,20 ℃,接触时间10 min)
2.3 负载钨的N1923有机相中钨的反萃行为
为了研究负载钨的N1923有机相中钨的反萃行为,首先在20%N1923+磺化煤油、相比1:1、温度20 ℃、接触时间10 min的萃取条件下制得了负载钨的有机相。为了获得用于制备仲钨酸铵产品的钨溶液,本研究选用了氨水作为反萃剂、考察不同因素对钨反萃效果的影响。
2.3.1 温度对反萃效果的影响
在不同温度下对钨反取效果的影响如图3所示,反萃条件为负载有机相50 mL、氨水浓度12.5%、接触时间10 min、相比O/A 1:1。由图3可知:温度对钨的反萃效果影响很大,随着温度的升高,钨的反萃率逐渐增加;温度的升高也使得反萃过程中开始出现的白色沉淀(APT结晶)的迅速溶解。但是,过高的温度会加快氨水的挥发,从而恶化操作环境。综合考虑选择50 ℃作为反萃的温度。
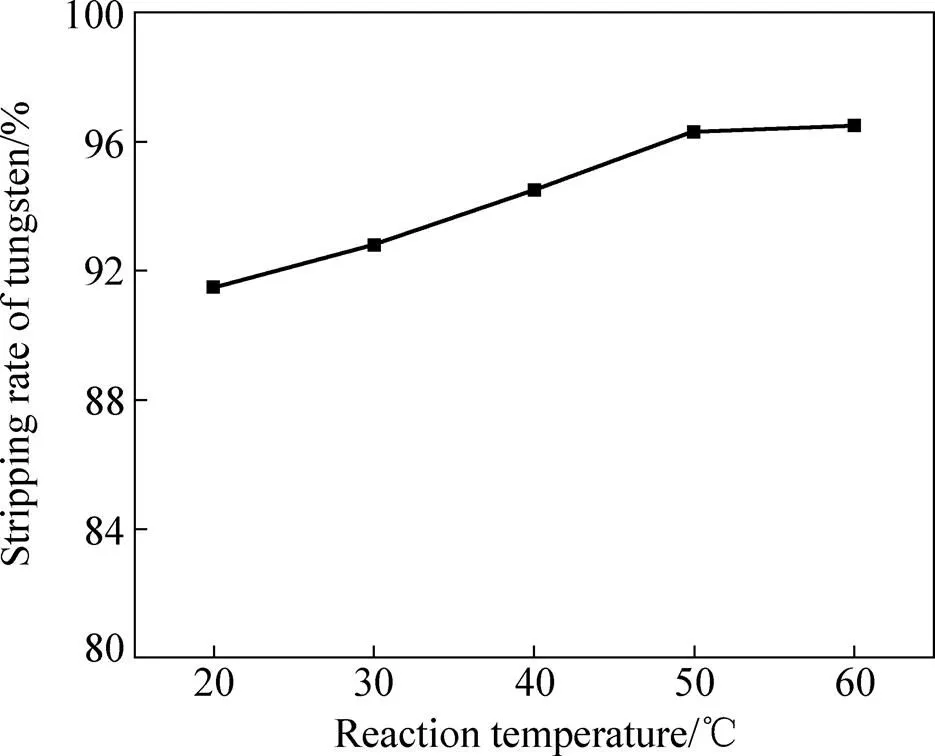
图3 温度对钨反萃率的影响
2.3.2 相比对反萃效果的影响
在负载有机相50 mL、氨水浓度12.5%、接触时间10 min、温度50 ℃的条件下考察了不同相比对钨反萃效果的影响,其结果如图4所示。从图4可以看出,相比对钨的反萃率影响不大,钨的反萃率均在93%以上,这主要是由于上述实验所用的反萃剂氨水均为大大过量(相比5:1时,氨水的过量系数仍为2.6)。随着相比的增加,反萃液中钨的浓度逐渐升高,影响了沉淀APT的溶解,在相比为3:1时,仍有少量的沉淀未溶解完全。为了促进APT的溶解可考虑采取提高氨水浓度和延长时间的措施,并考察了氨水浓度和时间的影响。
2.3.3 氨水浓度对钨反萃效果的影响
氨水浓度对钨反萃效果的影响如图5所示。反萃条件如下:负载有机相50 mL、相比O/A 1:1、接触时间10 min、反萃温度50 ℃。从图5中可以看出,随着氨水浓度的增加,钨反萃率先上升后趋于平缓。当氨水浓度为5%时,该条件下氨水的过量系数为2.6,反应完成后剩余氨水浓度约为1.8 mol/L,此时有机相和水相均为淡蓝色,水相中仍有少量APT结晶未溶解。当所用氨水浓度逐渐升高到12.5%后,反萃得到的钨酸铵溶液呈黄色澄清。为了减少氨水的用量,一般选用12.5~15%的氨水浓度即可达到较好的反萃效果。
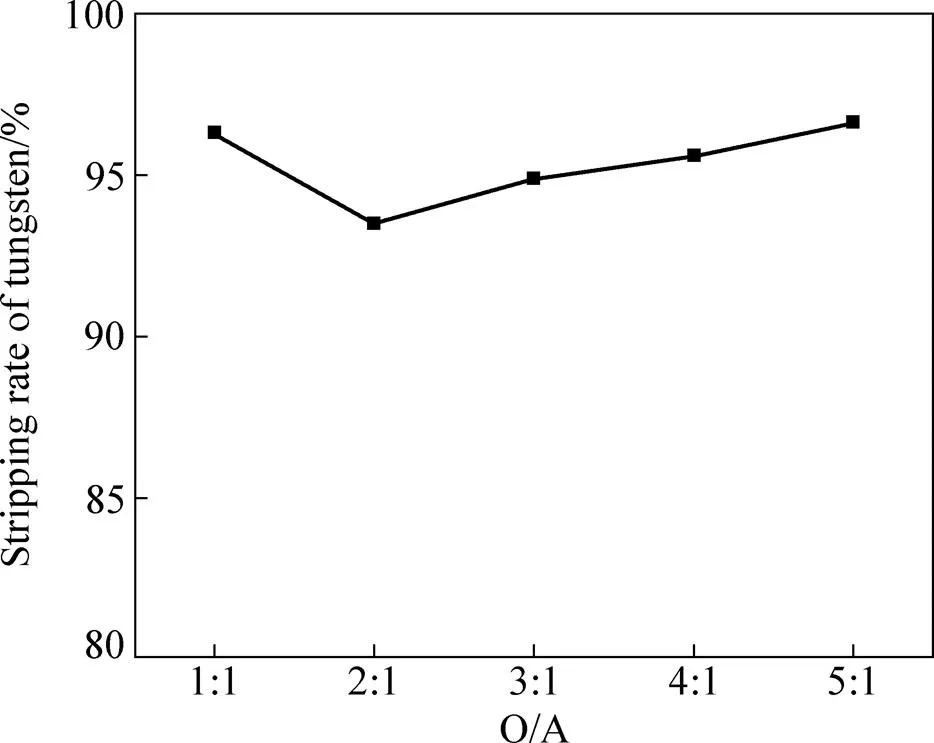
图4 相比对钨反萃率的影响
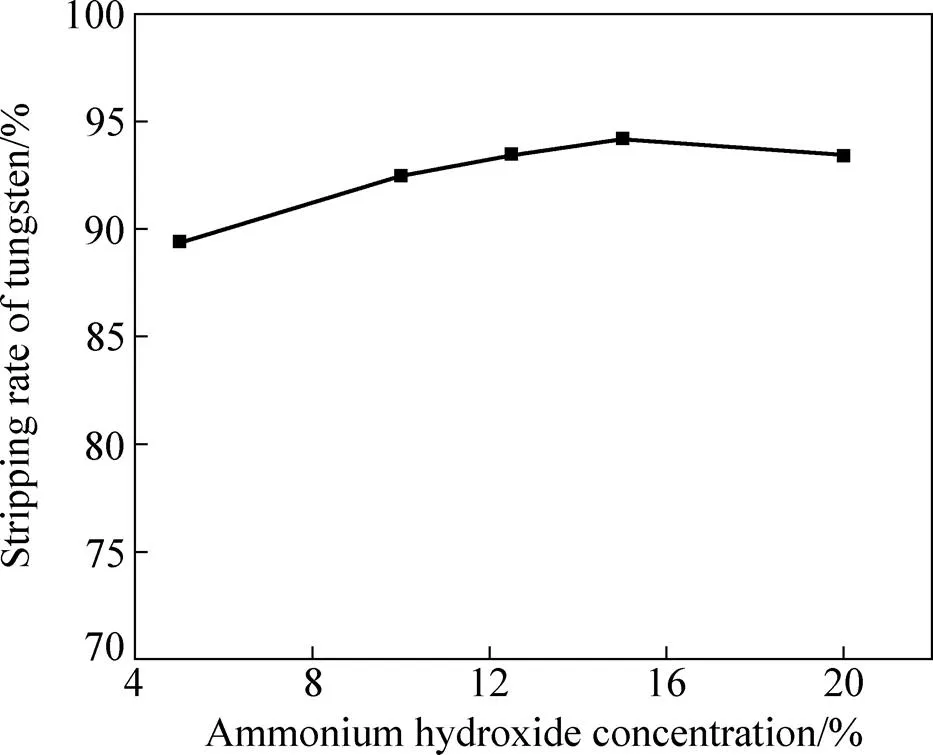
图5 氨水浓度对钨反萃率的影响
2.3.4 接触时间对钨反萃效果的影响
不同接触时间对钨反萃效果的影响如图6所示。反萃条件如下:负载有机相50 mL、相比O/A 1:1、氨水浓度12.5%、反萃温度50 ℃。当氨水与负载有机相开始接触时便立即出现白色沉淀,接触时间为1 min时产生的白色沉淀还未来得及溶解完全,因此静置分相后水相中仍有大量的白色沉淀。随着接触时间的延长,白色沉淀逐渐溶解,当延长至5 min后得到的反萃液均为黄色澄清溶液。为了保证反萃过程的顺利进行,实验选取10 min的接触时间。
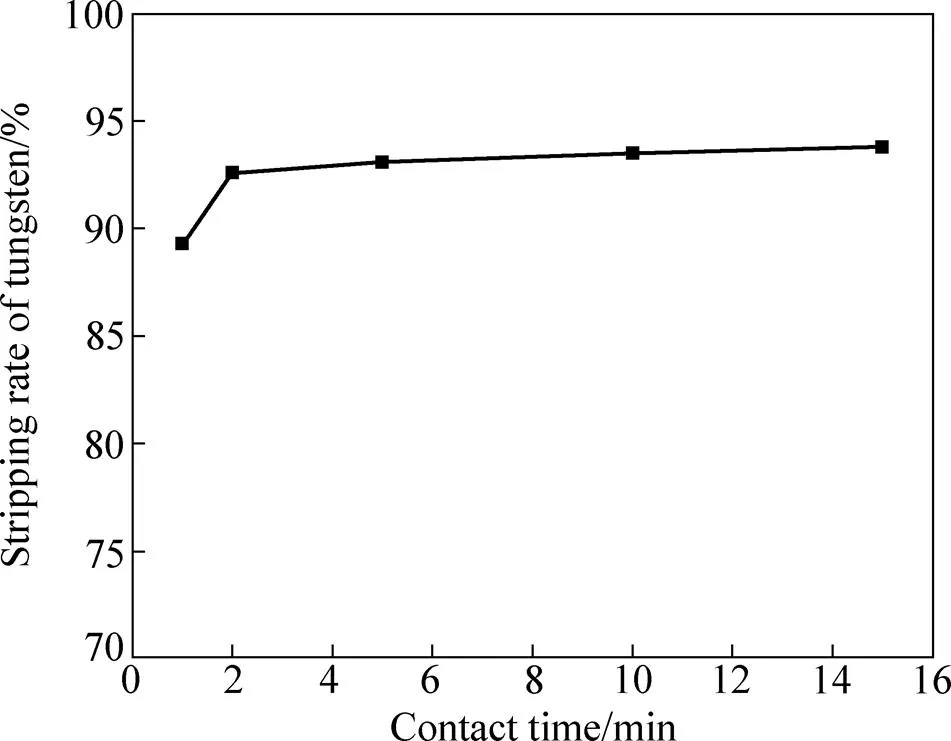
图6 接触时间对钨反萃率的影响
2.4 N1923萃取体系的循环
为了考察萃取剂在高酸强氧化性环境下的循环使用性能,本研究中进行了6次萃取−反萃的循环操作实验,其结果如表5所示。每次循环具体操作条件顺序为:萃取→水洗→一次反萃→二次反萃→一次水 洗→二次水洗。萃取:磷钨酸溶液50 mL、20%N1923+磺化煤油、温度20 ℃、接触时间10 min、相比1:1;水洗:洗水体积50 mL、接触时间5 min、温度20 ℃;反萃(两次操作相同):氨水12.5% 25 mL、温度50 ℃、接触时间10 min;反萃后水洗:洗水体积50 mL、接触时间5 min、温度20 ℃。
从表5可以看出,有机相经6次循环操作仍维持很好的萃取效果,钨的萃取率稳定在99.98%以上,萃余液中钨浓度保持在0.1 g/L以下。负载有机相经两次氨水反萃后,钨的反萃率达到95.5%以上,反萃液黄色澄清。反萃后的有机相经两次水洗后返回萃取时未出现磷钨酸铵沉淀,说明反萃时引入有机相中的氨已被彻底冲洗干净。
2.5 N1923萃取体系的实际应用
在进行了配制料液中磷钨酸的萃取−反萃行为研究的基础上,开展了白钨矿浸出液中钨的萃取与反萃实验,其结果如表6和7所示。在优化的萃取条件下,即有机相组成20%N1923+磺化煤油、相比为1:1~1:2、室温20~23 ℃、接触时间10 min的情况下,钨萃取率均达到高达99.9%以上。为了提高反萃液中钨的浓度,采取了适当降低萃取相比的措施,从而提高有机相中的负载钨的量。当相比降低到1:2时,钨的萃取率仍高达99.4%,但静置分相时,经5 min才完全分相。经检测此时的有机相密度达到了0.910 g/cm3,水相密度为1.114 g/cm3,两相的密度相差不大,为了实现快速分相,可采用离心萃取设备。
在有机相组成20%N1923+磺化煤油、相比1:1.5、室温23 ℃、接触时间10 min的条件下的得到的负载有机相,经不同浓度的氨水反萃,其结果如表7所示。为了获得较高浓度的钨酸铵溶液,达到减少APT制备工序的蒸发量目的,本研究通过进一步提高反萃时的相比来实现。当相比增加到2.5:1时,反萃液中易出现APT结晶,则通过加大氨水浓度来避免。在相比2.5:1、温度50 ℃、氨水浓度25%、接触时间10 min的条件下反萃,得到的钨酸铵溶液中WO3浓度达到了220 g/L。
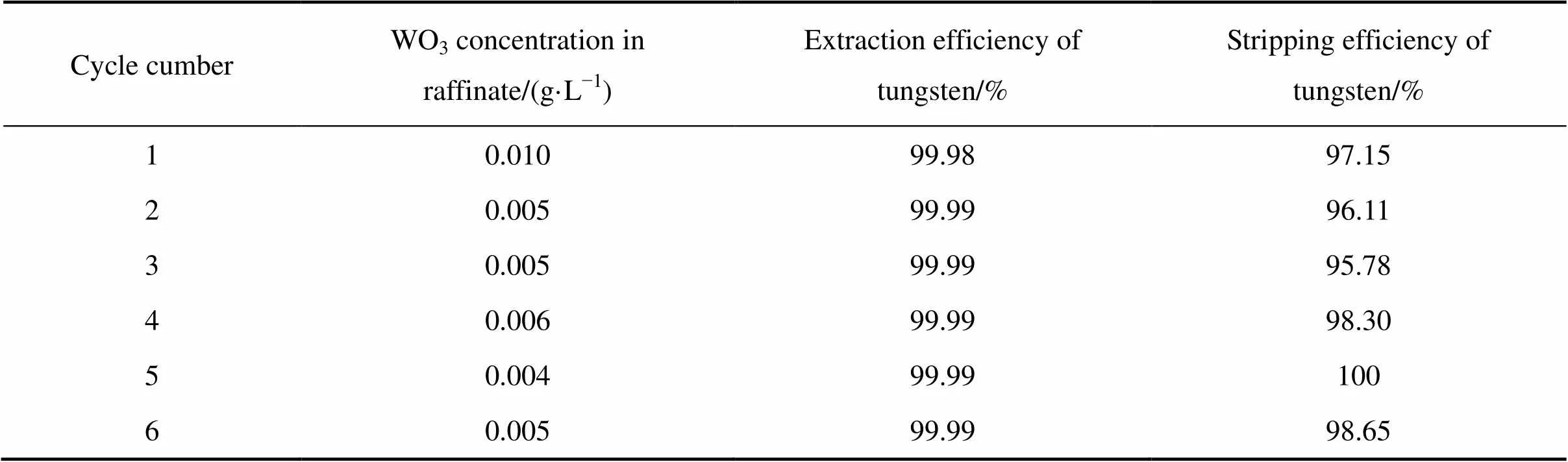
表5 N1923循环萃取实验结果
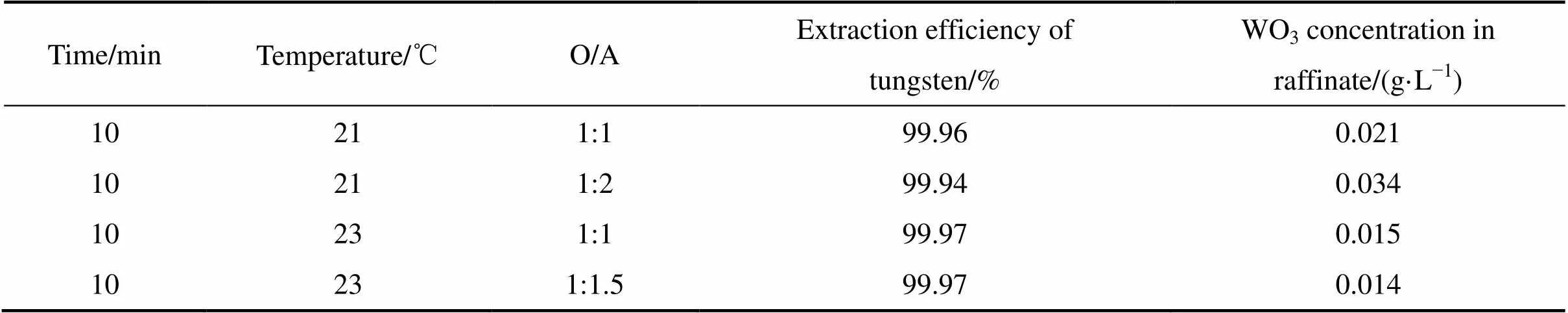
表6 白钨矿浸出液中钨的萃取效果
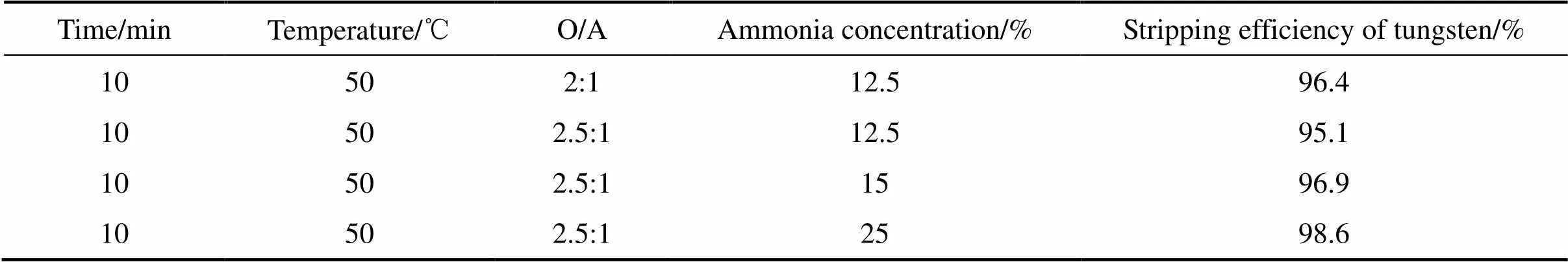
表7 白钨矿浸出液中钨的反萃效果
3 结论
1) 与常用的钨萃取剂N235、仲辛醇和TBP相比,N1923萃取剂对钨具有高萃取率、易反萃的优势。
2) N1923在常温下可实现钨的快速萃取,萃取结束后静置分相快、相界面清晰;反萃率高,通过提供反萃剂的浓度和温度可解决反萃液中APT结晶的问题。
3) 通过降低N1923萃取体系的相比、提高反萃的相比和氨水浓度的措施,可获得较高浓度的钨酸铵反萃液。
[1] 肖连生. 中国钨提取冶金技术的进步与展望[J]. 有色金属科学与工程, 2013, 4(5): 6−9. XIAO Lian-sheng. Progress and prospect of tungsten extraction metallurgy in China[J]. Nonferrous Metals Science and Engineering, 2013, 4(5): 6−9.
[2] 赵中伟. 钨冶炼的理论与应用[M]. 北京: 清华大学出版社, 2013: 10−20. ZHAO Zhong-wei. Tungsten metallurgy: Fundamentals and applications[M]. Beijing: Tsinghua University Press, 2013: 10−20.
[3] RAJ P S. Modern hydrometallurgical production methods for tungsten[J]. JOM, 2006, 58: 45−49.
[4] MARTIN J P. Kinetics of soda ash leaching of low-grade scheelite concentrates[J]. Hydrometallurgy, 1996, 42: 221−236.
[5] LI Hong-gui. Production of high purity APT from scheelite and complextungsten raw material with high Mo content[J]. Transactions of Nonferrous Metals Society of China, 2004, 14(2): 367−369.
[6] CHEN Min,LI Zhao,LI Xue-wei,QU Jun,ZHANG Qi-wu. Mechanochemically extracting tungsten through caustic processing of scheelite by controlling calcium dissolution[J]. International Journal of Refractory Metals and Hard Materials, 2016, 58: 211−215.
[7] 万林生, 邓登飞, 赵立夫, 李红超, 徐国钻, 梁 勇. 钨绿色冶炼工艺研究方向和技术进展[J]. 有色金属科学与工程, 2013, 4(5): 15−18. WAN Lin-sheng, DENG Deng-fei, ZHAO Li-fu, LI Hong-cha, XU Guo-zuan, LIANG Yong. Research direction and technical progress of green tungsten metallurgy[J]. Nonferrous Metals Science and Engineering, 2013, 4(5): 15−18.
[8] ZHAO Zhong-wei, LI Jiang-tao, WANG Shi-bo, LI Hong-gui, LIU Mao-sheng, SUN Pei-mei, LI Yun-jiao. Extracting tungsten from scheelite concentrate with caustic soda by autoclaving process[J]. Hydrometallurgy, 2011, 108: 152−156.
[9] ZHANG Wen-juan, YANG Jin-hong, ZHAO Zhong-wei, WANG Wen-qiang, LI Jiang-tao. Coordination leaching of tungsten from scheelite concentrate with phosphorus in nitric acid[J]. J Cent South Univ, 2016, 23: 1312−1317.
[10] ZHANG Wen-juan, LI Jiang-tao, ZHAO Zhong-wei. Leaching kinetics of scheelite with nitric acid and phosphoric acid[J]. International Journal of Refractory Metals and Hard Materials, 2015, 52: 78−84.
[11] ZHAO Zhong-wei, HU Fang, HU Yu-jie, WANG Shi-bo, SUN Pei-mei, HUO Guang-sheng, LI Hong-gui. Adsorption behaviour of WO42−onto 201×7 resin in highly concentrated tungstate solutions[J]. International Journal of Refractory Metals and Hard Materials, 2010, 28(5): 633−637.
[12] 李洪桂, 羊建高, 李 昆. 钨冶金学[M]. 长沙: 中南大学出版社, 2010: 155−200. LI Hong-gui, YANG Jian-gao, LI Kun. Tungsten metallurgy[M]. Changsha: Central South University Industry Press, 2010: 155−200.
[13] 关文娟, 张贵清. 用季铵盐从模拟钨矿苏打浸出液中直接萃取钨[J]. 中国有色金属学报, 2011, 21(7): 1757−1762. GUAN Wen-juan, ZHANG Gui-qing. Extraction of tungsten from simulated autoclave-soda leaching liquor of scheelite with quaternary ammonium salt[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(7): 1757−1762.
[14] 陈世梁, 张贵清, 肖连生, 关文娟. 采用HCO3−-CO32−混合型季铵盐从模拟钨矿苏打高压浸出液中萃取钨[J]. 中国有色金属学报, 2014, 24(12): 3155−3160. CHEN Shi-liang, ZHANG Gui-qing, XIAO Lian-sheng, GUAN Wen-juan. Extraction of tungsten from simulated autoclave-soda leaching liquor of tungsten ore with quaternary ammonium salt of bicarbonate and carbonate[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(12): 3155−3160.
[15] YANG Yue, XIE Bo-yi, WANG Rui-xiang, XU Sheng-ming, WANG Jian-long, XU Zheng-he. Extraction and separation of tungsten from acidic high-phosphorus solution[J]. Hydrometallurgy, 2016, 164: 97−102.
[16] LIAO Yu-long, ZHAO Zhong-wei. Effects of phosphoric acid and ageing time on solvent extraction behavior of phosphotungstic acid[J]. Hydrometallurgy, 2017, 169: 515−519.
[17] 廖宇龙. 高钼白钨中矿酸性化学选矿浸出液的钨钼萃取研究[D]. 长沙: 中南大学, 2011: 35−37. LIAO Yu-long. Solvent extraction of tungsten and molybdenum from chemical beneficiation acid leach solution of scheelite middling with high content of molybdenum[D]. Changsha: Central South University, 2011: 35−37.
[18] 张启修, 张贵清, 唐瑞仁. 萃取冶金原理与实践[M]. 长沙: 中南大学出版社, 2014: 294−295. ZHANG Qi-xiu, ZHANG Gui-qing, TANG Rui-ren. Fundamentals and practice of solvent extraction in hydrometallurgy[M]. Changsha: Central South University Press, 2014: 294−295.
[19] 柯兆华, 张贵清, 关文娟, 尚广浩. 季铵盐从碱性钨酸钠溶液中萃取钨的研究[J]. 稀有金属与硬质合金, 2012, 40(6): 1−4. KE Zhao-hua, ZHANG Gui-qing, GUAN Wen-juan, SHANG Guang-hao. Research on tungsten extraction from alkali sodium tungstate solution with quaternary ammonium salt[J]. Rare Metals and Cemented Carbides, 2012, 40(6): 1−4.
Extracting tungsten from nitric acid-phosphoric acidmixed solution by solvent extraction method
YANG Jin-hong, LI Jiang-tao, LIU Wen-ting, ZHAO Zhong-wei
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
The extraction behavior of tungsten in nitric acid-phosphoric acid mixed solution was examined with different extraction agents. The results indicate that extraction agent secondary amine extractant N1923has a satisfied extraction and stripping efficiency of tungsten. Then, the extracting and stripping process of tungsten by N1923was investigated. During the extracting process, over 99.9% tungsten can be extracted under 20% N1923(volume fraction) in organic phase system, phase ratio 1:1, temperature 20 ℃ and contact time 10 min. During the stripping process, over 93.5% tungsten loaded on organic phase is stripped with 12.5% ammonium hydroxide under the conditions of phase ratio 2:1, temperature 50 ℃ and contact time 10 min. Based on the research of extracting tungsten from simulate leach solution of scheelite concentrates, N1923is used to treat the leach solution of scheelite concentrates which is digested bynitric acid phosphate mixture. The applications show that 99.9% tungsten is extracted and a relatively high concentration of ammonium tungstate solution (WO3is over 200g/L) can be obtained through increasing phase ratio and ammonium hydroxide concentration with a satisfied stripping efficiency of 98%.
nitric acid-phosphoric acid mixed solution; scheelite concentrate; phosphotungstic acid; solvent extraction; N1923
Project(51334008) supported by the National Natural Science Foundation of China; Project(KQ1707018)supported by the Outstanding Youth Training Program of Changsha City, China
2017-09-05;
2017-12-26
LI Jiang-tao; Tel: +86-731-88830476; E-mail:jiangtao-lee@csu.edu.cn
国家自然科学基金重点项目(51334008);长沙市杰出创新青年培养计划资助项目(KQ1707018)
2017-09-05;
2017-12-26
李江涛,讲师,博士;电话:0731-88830476;E-mail:jiangtao-lee@csu.edu.cn
10.19476/j.ysxb.1004.0609.2018.05.19
1004-0609(2018)-05-1024-09
TF801
A
(编辑 李艳红)
