NK-lysin在人工感染绵羊肺腺瘤病毒肺组织的表达及其在不同品种绵羊的多态性分析
2018-06-28,,,,
,, ,,
(河南省漯河市召陵区畜牧局,河南 漯河 462300)
动物的肿瘤病治疗和抗病选育一直是畜牧业发展需要解决的难题。 NK-lysin是一种具有抗微生物和肿瘤细胞的活性蛋白,是机体天然免疫的重要成分,具有极大的应用价值[1]。研究表明,猪NK-lysin对大肠杆菌、巨大芽孢杆菌等多种病原微生物以及肿瘤细胞具有抗性[2-4]。
绵羊肺腺瘤病(OPA)是绵羊的一种慢性、进行性、接触性传染的肺脏肿瘤性疾病[5-10],是世界动物卫生组织确定的B类传染病。该病以患羊咳嗽、呼吸困难、消瘦、大量浆液性鼻漏、II型肺泡上皮细胞和无纤毛细支气管上皮细胞肿瘤性增生为主要特征[10]。“小推车试验”是诊断 OPA的典型试验,即抬高病羊的前腿,病羊的鼻腔会有一些液体流出,这是OPA具有的典型临床症状[11-14]。该病病原为外源性绵羊肺腺瘤病毒(JSRV),该病毒属于反转录病毒科[15]。NK-lysin基因主要与某些肿瘤细胞、病毒感染细胞、某些自身组织细胞(如血细胞)等相关,是机体抗肿瘤、抗感染的重要免疫因素,也参与第Ⅱ型超敏反应和移植抗宿主反应。近年来,新疆地区部分种羊场发生了绵羊肺腺瘤病,病羊可以通过咳嗽和喘气将病毒排出, 经呼吸道传染给易感羊,造成羊群长期带毒,难以净化,给畜牧业生产造成严重的危害。资料表明,不同品种绵羊该病的易感性不同,其中美利奴绵羊的易感性最高[16]。本研究采集新疆两个绵羊品种(哈萨克羊、萨福克羊)血液提取总RNA,经PCR扩增绵羊NK-lysin基因全长CDS区段进行测序,分析NK-Lysin在品种间和品种内SNP的多态性,弄清新疆不同品种绵羊NK-lysin的多态性。另外,通过对建立的绵羊肺腺瘤病人工感染模型肺组织提取总RNA,经荧光定量RT-PCR检测发病和健康绵羊肺组织中NK-lysin基因的表达量,对比不同病理条件下绵羊NK-lysin基因的表达差异,对研究 NK-lysin基因突变与疾病的易感关系具有重大意义,为绵羊抗肿瘤分子机制研究提供理论基础。
1 材料和方法
1.1 材料
1.1.1 实验动物材料 采集人工感染绵羊肺腺瘤绵羊肺组织和正常绵羊肺组织,所有组织样品均保存于-80℃。另外,采集哈萨克羊、萨福克羊血液样本各50份,并迅速置于-20℃保存备用。
1.1.2 主要仪器 生化培养箱(一恒科技公司,上海);L1低温连接仪(黑马医学仪器公司,中国);PCR仪(D-370,德国); DYY-6C型电泳仪(六一生物公司,北京);Universal Hood II凝胶成像系统(Biorad公司,美国);实时荧光定量PCR仪(罗氏公司,上海)
1.1.3 主要试剂 PCR试剂盒、DNA Marker购自TAKARA公司;Taq Master Mix、RNA提取试剂盒购自北京天根生物工程有限公司;其他常规试剂来自石河子大学动物科技学院病理实验室。
1.2 方法
1.2.1 总DNA提取和样品组织的总RNA提取及反转录 样品的总DNA、RNA提取均参照使用TIANGEN公司的提取试剂盒说明书进行。需反转录再进行反转cDNA,同样参照说明书进行(表1)。

表1 RT-PCR反应体系
1.2.2 引物的设计与合成 根据GenBank 登陆的NK-Lysin和ATPaseRV基因序列,用Primer Premier 5.0软件设计引物(表2)。由华大基因生物公司合成。
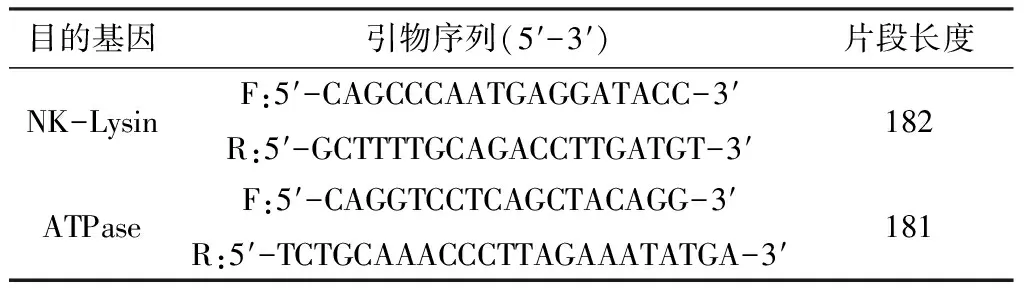
表2 NK-Lysin和ATPaseRV引物
1.2.3 PCR扩增及产物检测 (1)PCR扩增体系为25μl:2×buffer Mix 12μl;上、下游引物F/R各1μl;cDNA模板2μl;ddH2O 9μl;PCR反应条件如下:95 ℃预变性5min后,进入95 ℃变性30 s,55 ℃退火30 s,72 ℃ 30s的循环,共循环35次;最后72 ℃延伸10 min,4 ℃保存。
(2)PCR产物用2%的琼脂糖凝胶电泳检测。
用2%琼脂糖凝胶电泳检测,在紫外灯下观察是否扩增出目的片段。
配制5TBE,用Tris54g,硼酸27.5g,0.5mol/L EDTA(PH=8)20mL,依次加入蒸馏水中,充分溶解,定容至1000mL,4℃保存。
将5TBE电泳缓冲液稀释成1×TBE配制2%的琼脂糖凝胶,以MarkerⅠ进行分子量对照。1×TBE电泳缓冲液,150V,55mA电泳20min;打开凝胶成像仪的紫外灯拍照保存。
1.2.4 荧光定量RT-PCR 按照RT-PCRPromega公司qPCR Master试剂盒说明书进行,具体操作如下(表3):
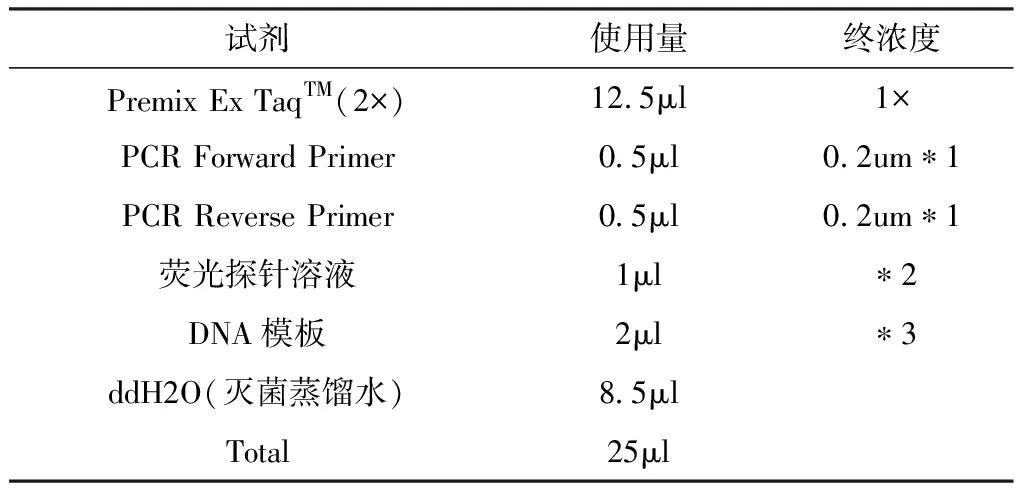
表3 RT-PCR反应体系
1.2.5 序列测定及分析 将检测样品送至上海生物技术公司进行序列测定。测序结果应用DNAMAN软件进行分析,分析绵羊NK-lysin基因SNP多态性,确定位点突变。利用生物信息学方法对NK-lysin基因SNP突变导致氨基酸序列改变后的蛋白构象和功能进行预测和分析,推测突变体和主要功能区段的结构和功能并进行筛选。
1.2.6 数据分析 以患病肺组织和正常肺组织获得cDNA为模板,采用域值法(2-ΔΔCt)进行相对定量[17]。该方法不需要绘制标准曲线,且较为方便和节省时间。本实验由实时荧光定量PCR仪测得各实验孔的Ct值,再分别算出同一cDNA样本3个重复孔的Ct值的平均值,并以同一样本的ATPaseCt值为内参,按照公式2-ΔΔCt= 2- [( 实验组NK-Lysin Ct- 实验组ATPaseCt) -( 对照组NK-LysinCt- 对照组ATPase Ct) ]式中F即为NK-Lysin基因拷贝数[18]。计算各实验组的2-ΔΔCt ,将对照的2-ΔΔCt设成1,然后将实验组与对照组相比,进行相对定量。
2 结果和分析
2.1 总DNA提取结果及RNA检测浓度
本实验采集哈萨克羊、萨福克羊血液样本作为实验材料提取总DNA,对所获得的总DNA进行浓度检测。结果表明,获得了质量较好的总DNA,无污染,能够满足实验操作的要求(表4)。
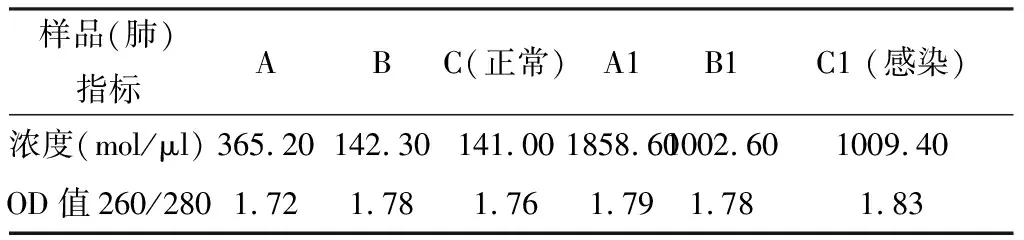
表4 各样品DNA检测浓度
2.2 PCR检测结果
(1)对样本进行PCR 扩增,电泳结果表明,PCR扩增产物符合预期目的片段的大小,可扩增出与 441bp 预期值大小相符的核酸电泳带(图1)
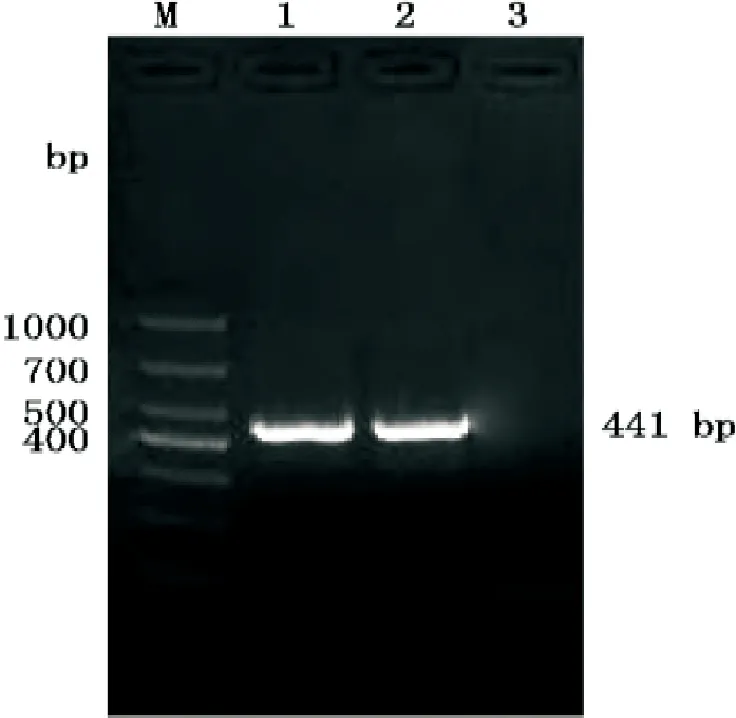
图1 PCR扩增电泳图M:DNA Marker 1:哈萨克羊NK-lysin基因 2:萨福克羊NK-lysin基因
(2)对正常绵羊和感染绵羊的cDNA样本进行PCR扩增。结果显示,所扩增出的条带与预期的目的片段长度相符,条带清晰且无杂带(图2,图3)。

图2 NK-Lysin基因扩增M:DNA Marker 1-3:为患病羊;4-6:为健康羊
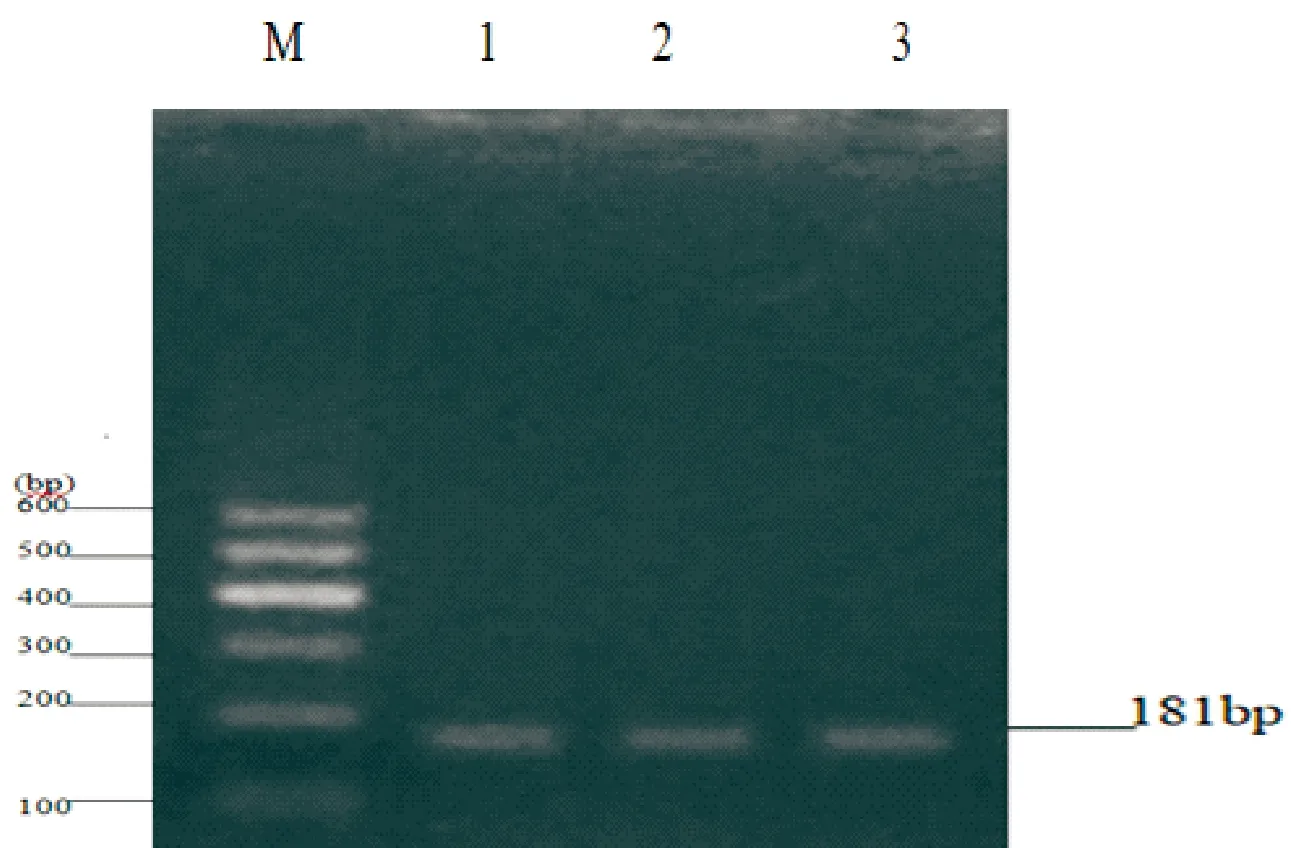
图3 ATPase基因扩增M:DNA Marker 1-2:为患病羊;3为健康羊
2.3 软件分析结果
测序所得核苷酸序列比对结果表明,萨福克羊和哈萨克羊 NK-lysin基因存在多态性,存在突变。经测序分析发现萨福克羊有 6 个点突变,而哈萨克羊只有 4 个突变,均为错义突变。错义突变分别是146碱基由 G变为 A和 171碱基由 A变为 G,也发现一个同义突变位点,分别是 74 碱基由 C 变 T(图4)。
氨基酸序列比对结果显示,氨基酸序列中的32氨基酸由丝氨酸变为天冬酰胺,35氨基酸由赖氨酸变为脯氨酸(图5)。

图4 哈萨克羊和萨福克羊核苷酸比对结果

图5 哈萨克羊和萨福克羊氨基酸比对结果
2.4 荧光定量
为了确定绵羊NK-lysin组织表达与疾病形成的关系,我们建立NK-Lysin荧光定量检测方法(图6)。
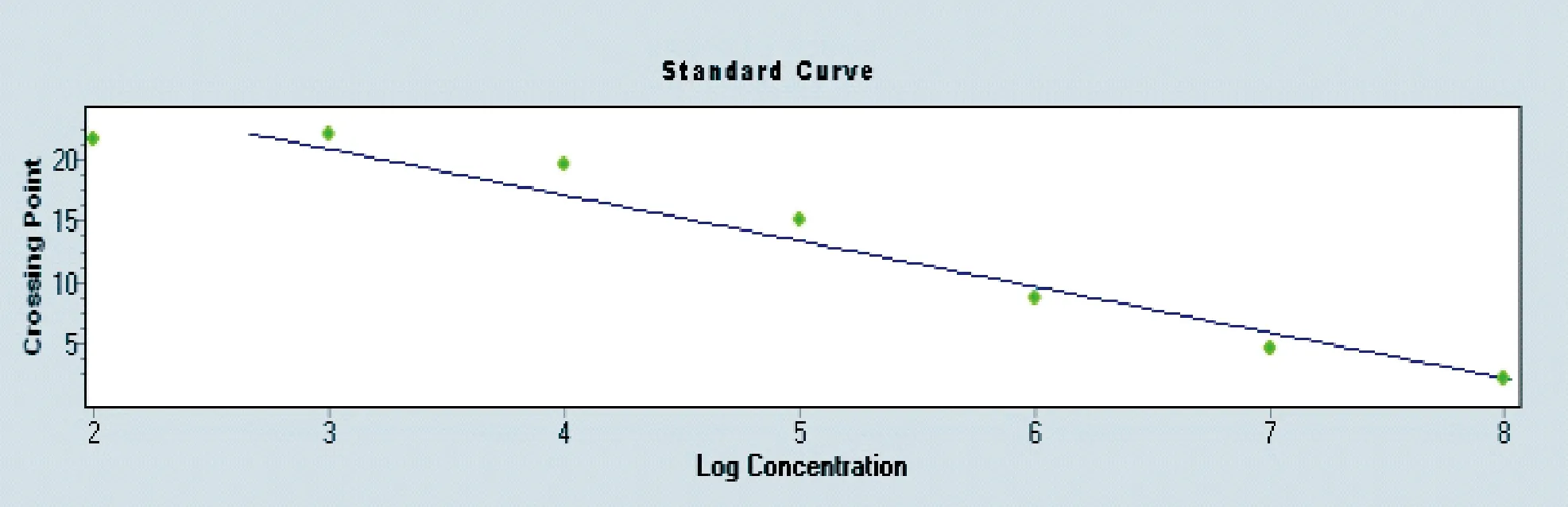
图6 绵羊NK-lysin荧光定量标准曲线
扩增曲线由Light Cycler 96 荧光定量PCR仪自动生成(图7,图8)。本实验中,目标基因和内参基因的溶解曲线分析结果显示,溶解曲线峰为单一峰形,未见其它峰值,并且峰的形状也比较锐利。提示,各基因溶解温度均一,扩增产物特异性好,未见非特异性的双链DNA产物或引物二聚体。
用2-ΔΔCt法分别对患病组三个样本和对照组的Ct值进行计算,结果(图9)表明,患病组的表达量低于对照组。对肺腺瘤绵羊肺脏NK-lysin基因表达与健康绵羊对比,其表达量明显低于健康绵羊(图10),说明NK-lysin参与了肺腺瘤的病理形成,其机制有待进一步研究。
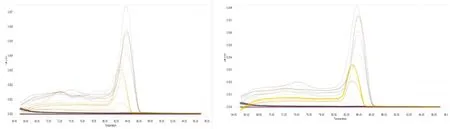
图7 绵羊NK-LysinA和TPase cDNA实时荧光定量PCR扩增溶解曲线
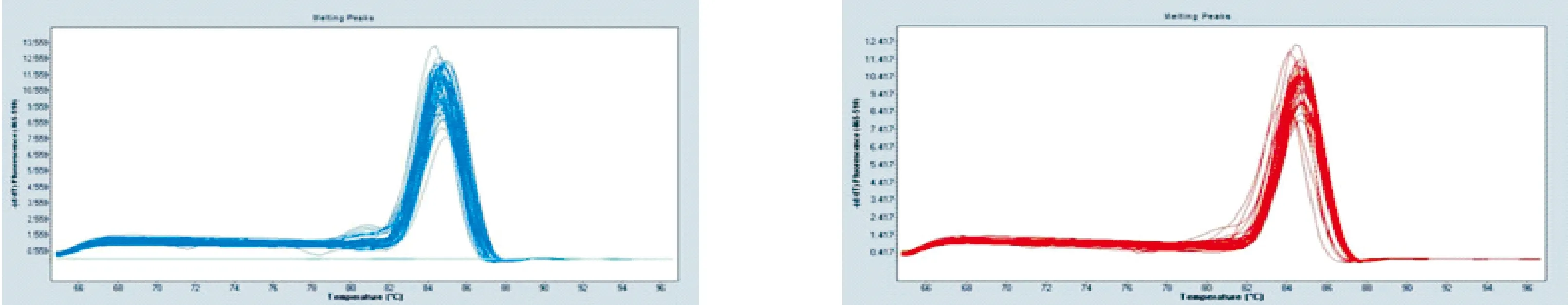
图8 NK-LysinA和TPase 的熔解曲线峰值图
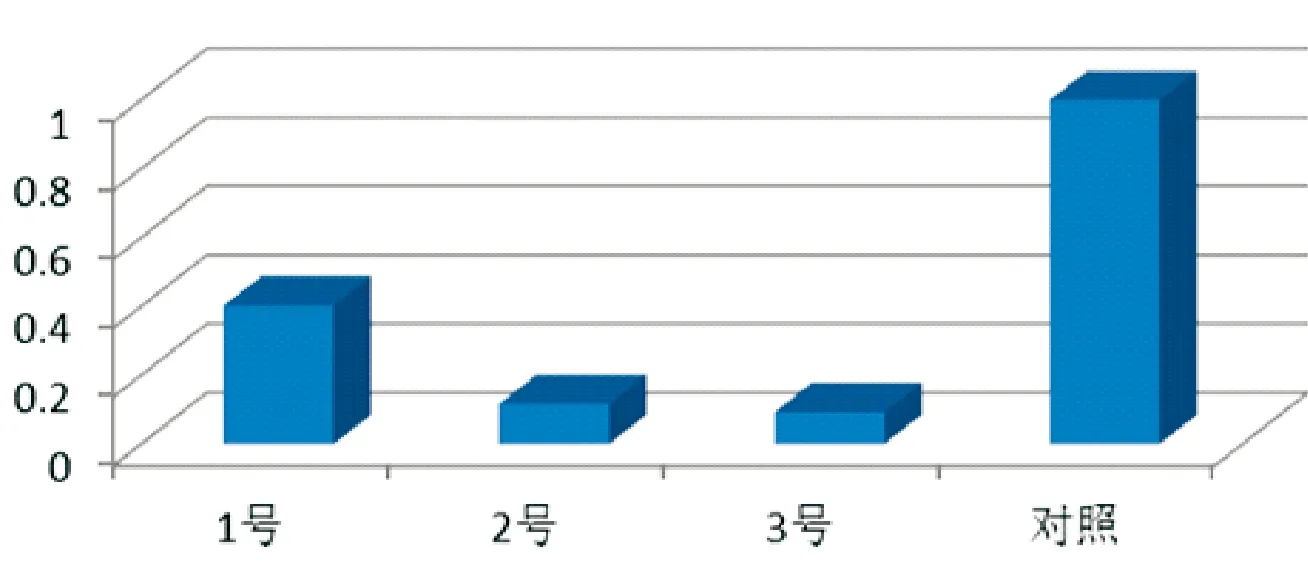
图9 NK-Lysin cDNA拷贝数相对定量结果(注:1-3为患病组)
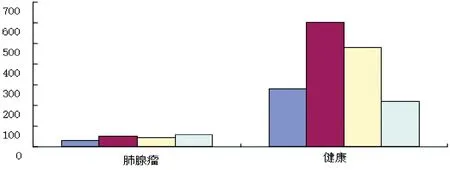
图10 健康羊与肺腺瘤绵羊肺脏NK-lysin的表达
经计算,1号患病绵羊的基因拷贝数为0.403,2号患病绵羊的基因拷贝数为0.117,3号患病绵羊的基因拷贝数为0.093。对照组正常绵羊的基因拷贝数为1,对照组/患病组的比值(表5)。

表5 对照组与患病组的比值
3 讨论
资料表明,NK-Lysin在动物不同品种的多态性使其结构和功能上存在差异,并且与多种感染性疾病病理过程密切相关。人的NK-Lysin能够杀死胞内的结核分枝杆菌,与结核病的病理形成有关[19]。Mi Ok Leea等对白色来航鸡和考尼什鸡的NK-lysin基因的多态性研究表明,NK-lysin基因在271位的A-G的突变导致一个氨基酸由 Asn (N)突变为 Asp (D),这种SNP突变导致其合成多肽的杀菌和抗肿瘤能力存在明显差异,NK-lysin基因的遗传多样性研究为抗肿瘤选育提供了新思路[20]。
Kandasamy等的研究结果显示,水牛NK-Lysin基因的表达量在脾脏、淋巴结较高,在子宫内膜中等,在肝脏、肾脏较低[21]。张殿卿等[19]研究结果显示,绵羊NK-Lysin基因在肩前淋巴结、脾脏及血液中有不同程度的表达,其在脾脏中的表达量最高,并显著影响免疫反应。本实验经荧光定量PCR检测患绵羊肺腺瘤病绵羊和正常绵羊的肺组织中NK-Lysin基因的表达量,结果表明,NK-Lysin基因在发病绵羊肺组织中的表达量低于健康绵羊肺组织中的表达量。
本实验采用的实时荧光定量PCR可以免受酶活性、扩增效率、尤其是平台效应等诸多因素的影响,因此检测结果更加精确。另外此方法还避免了待检样本的污染,防止假阳性结果上升,可以做到实时观测。综上所述,这个方法是最适合检测不同状态下肺组织中NK-Lysin基因的表达水平。
4 结论
(1)新疆哈萨克羊和萨福克羊NK-lysin基因存在多态性,这些突变可能改变NK-lysin基因的功能,对研究 NK-lysin基因突变与疾病的易感关系具有重要意义。
(2)通过实时荧光定量PCR对患病组和对照组肺组织的NK-Lysin基因进行相对定量,NK-Lysin基因在健康绵羊肺组织中的表达量高于发病绵羊肺组织中的表达量,说明患绵羊肺腺瘤的绵羊的NK细胞和细胞毒性淋巴细胞(CTL)抑制了NK-Lysin基因的表达,推测NK-Lysin基因可能参与了机体抗病毒的防御机制。
参考文献:
[1]胡建和,杭柏林,徐彦召等.动物源抗菌肽[M].北京:科学出版社,2015.
[2] Sun Q, Rober L, Burton, et al. Cytokine production and cytolytic mechanism of CD4 cytotoxic T-lymphocytes in ex-vivo expanded therapeutic Epstein-Barr virus-specific T-cell cultures [J]. Blood, 2002, 99(9): 3302-3309.
[3]Kaspar A A, Okada S, Kumar J, etal. Adistinct path way of cell mediated apoptosis initiated by granulsin [J]. Immounol, 2001, 167(1): 350-356.
[4] Andersson, M., H. Gunne, B. Agerberth, A. et al. NK-lysin, a novel effector peptide of cytotoxic T and NK cells. Structure and cDNA cloning of the porcine form, induction by interleukin 2, antibacterial and antitumour activity [J]. EMBO J.1995(14):1615-1625.
[5]朱福余,于立新,么宏强,等.绵羊肺腺瘤病毒检测方法的研究进展[J].中国畜牧兽医,2011,41(4):236-237.
[6]张宇飞,刘月,王专家,等.绵羊肺腺瘤病毒pEGFP-C1/exJSRV-env构建及引起NIH3T3细胞恶性转化的研究[J].病毒学报,2014,30(3):268-277.
[7]平万军.绵羊肺腺瘤病的流行及诊治[J].养殖技术顾问,2011(6):163.
[8]王金良.德克赛尔杂交绵羊肺腺瘤病毒病的诊断[A].中国畜牧兽医学会畜牧兽医生物技术学分会、中国免疫学会兽医免疫分会.2010:2.
[9]刘畅,敖威华,李磊,等.绵羊肺腺瘤病毒致瘤机制研究进展[J].动物医学进展,2015,36(1):79-82.
[10]冉双存.绵羊肺腺瘤病研究进展[J].畜牧兽医科技信息,2010(04):16-17.
[11] Palmarini M, Sharp J M,De Las Heras M,et al. Jaagsiekte sheep retrovirus is necessary and sufficient to in-duce a contagious lung canaer in sheep[J]. J Virol. 1999,73(8): 6964-6972.
[12] Consens C, Thonur L, Imlachs, et al. Jaagsiekte sheep retrovirus is present at high concentration in lung fluid produced by ovine pulmonary adenocarcinoma affected sheep and can survive for several weeks at ambient temperatures[J]. Res Vet Sci, 2009( 87):154-156.
[13]司俊强,杨素芳,梁田,等.新疆绵羊肺腺瘤病临床诊断与组织病理学观察[J].畜牧兽医杂志,2017, 36(03):119-122.
[14]张亚坤,刘淑英.绵羊肺腺瘤病毒囊膜蛋白致癌作用的研究进展[J].中国兽医科学,2012, 42(12):1315-1320.
[15] 刘霄卉, 罗军荣, 斯日古楞, 等.稳定表达绵羊肺腺瘤病毒表面蛋白A549细胞系的建立[J].中国预防兽医学报,2011,33(05):395-398.
[16] 荆文魁,王颖,张怀宇,等.绵羊肺腺瘤病,中国兽医杂志,2010,46(5):88-91.
[17] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 Delta C(T)Method [J]. Methods,2001, 25(4):402-408.
[18] 张殿卿, 李蕊, 陈鹏博, 等.不同浓度脂多糖诱导绵羊免疫器官中NK-Lysin基因表达的研究 [J]. 中国畜牧兽医,2014,41(7):44-48.
[19] 张殿卿. 合成绵羊抗菌肽NK-Lysin的生物学功能及其对雏鸡沙门氏菌感染的治疗研究[D].新疆:石河子大学,2014.
[20] Andersson, M., A. Holmgren, and G. Spyrou. NK-lysin, a disulfide containing effector peptide of T-lymphocytes, is reduced and inactivated by human thioredoxin reductase. Implication for a protective mechanism against NK-lysin cytotoxicity[J]. Biol. Chem.1996(271):10116-10120
[21] Kandasamy S, Mitra H, Yavagal S, et al. Characterization and expression profile of complete functional domain of granulysin/NK-Lysin homologue gene of water buffalo[J]. Vet Immunol, 2009, 128(4):413-417.
