5-氟尿嘧啶诱导小鼠化疗性肠黏膜炎模型的建立
2018-06-26谭婉贤熊晏赖莉敏颜霞陈超瞿礼萍邹文俊
谭婉贤,熊晏,赖莉敏,颜霞,陈超,瞿礼萍*,邹文俊*
(1. 成都中医药大学药学院,成都 611137; 2. 地奥集团成都药业股份有限公司,成都 610000)
化疗性肠黏膜炎(chemotherapy-induced intestinal mucositis,CIM)是肿瘤患者化疗时常见的剂量限制性不良反应。欧洲肿瘤医学协会(European Society for Medical Oncology,ESMO)将其定义为由肿瘤治疗引起的肠道炎性病变,其病理特征为肠绒毛萎缩、隐窝破坏及炎性细胞浸润,临床症状主要表现为厌食、恶心、呕吐、腹泻和腹痛等[1]。CIM不仅直接影响化疗效果,而且降低肿瘤患者的生存质量。目前CIM发病机制尚不明确,且缺乏有效的临床治疗药物。合适的动物模型对疾病研究和药物筛选尤为重要。目前已有多篇化疗诱导动物肠黏膜炎模型的研究报道[2],其中,5-氟尿嘧啶(5-fluorouracil,5-FU)诱导建立小鼠肠黏膜炎模型方法简便快速,且基本符合患者化疗后胃肠黏膜炎的病理特点,为CIM研究常用动物模型。进一步查阅文献发现,5-FU诱导小鼠肠黏膜炎模型的造模方法主要涉及单次或连续腹腔注射,但其给药剂量差异较大,其中,单次给药剂量范围为100~450 mg/kg[3-6];连续给药剂量范围为30~150 mg/kg[7-11]。因此,为进一步研究化疗性肠黏膜炎动物模型,本实验模拟了5-FU在临床应用中单次大剂量及分次维持剂量的给药方法[12-14],观察不同剂量5-FU单次或连续5 d腹腔注射对小鼠肠黏膜损伤的影响。考虑文献报道连续给药周期多为5 d,因此本实验以5 d作为连续给药的周期。
1 材料与方法
1.1 材料
1.1.1实验动物
SPF级ICR小鼠96只,雄性,体重23~26 g,购买于成都达硕实验动物有限公司【SCXK (川) 2015-030】。饲养于成都中医药大学药学院动物观察室【SYXK(川)2014-124】。动物饲养环境:温度 (25±1)℃,相对湿度 (60±5)%,12 h/12 h 明暗周期交替,标准饲料喂养,自由饮水。
1.1.2试剂与仪器
5-FU(美国Sigma公司,批号WXBC2 167 V);4%多聚甲醛固定液(北京Biosharp公司,批号1704464);血细胞分析用溶血剂(上海光电医用电子仪器有限公司,批号17060582);血细胞分析用稀释液(上海光电医用电子仪器有限公司,批号17070830)等。
Sorvall ST-16R离心机(美国Thermo公司);BS323S 电子天平(德国Sartorius公司);全自动血液分析仪(日本光电公司);光学显微镜(日本Nikon 公司)等。
1.2 方法
1.2.1造模方法
(1)动物分组
96只雄性ICR小鼠适应性饲养3 d,按体重随机分为8组,包括单次给药造模和连续给药造模实验各4组,每组12只。单次给药造模实验分为正常组、5-FU 100 mg/kg组、5-FU 200 mg/kg组和5-FU 400 mg/kg组。连续给药造模实验分为正常组、5-FU 30 mg/kg组、5-FU 50 mg/kg组和5-FU 100 mg/kg组。
(2)模型制作
单次给药造模各组小鼠分别单次腹腔注射5-FU 100、200和400 mg/kg。连续给药造模各组小鼠分别腹腔注射5-FU 30、50和100 mg/kg,连续5 d。正常组小鼠腹腔注射等体积的生理盐水,给药体积为20 mL/kg。
1.2.2观察指标
(1)一般状态观察
5-FU给药第1天起,每天观察小鼠的体重、饮食、毛色、活动、精神状态及死亡等情况。
(2)小鼠腹泻情况
5-FU给药第1天起,每天观察小鼠腹泻情况,并参考Akinobu Kurita[15]报道方法进行评分:0 分,大便正常或没有;1 分,轻度腹泻,大便可见轻微湿软; 2 分,中度腹泻,大便较湿且不成形并伴有轻度肛周污迹;3 分,重度腹泻,水样便并伴有重度肛周污迹。
(3)小鼠外周血象
单次给药造模和连续给药造模各组小鼠分别于末次给药后72 h 和24 h,小鼠眼底静脉丛取血20 μL,加入预装2 mL稀释液的EP管中,混匀,使用血细胞分析仪检测各组小鼠白细胞、红细胞、血红蛋白、血小板等血常规指标。
(4)组织病理学观察
单次给药造模和连续给药造模各组小鼠分别于末次给药后72 h和24 h,各处死4只小鼠,剖开腹腔,取距回肠末端3 cm处的回肠2 cm,4%多聚甲醛固定、石蜡包埋、切片(4 μm)、HE染色,光学显微镜下观察小肠组织结构的病理变化。
1.3 统计方法
2 结果
2.1 一般状态、体重和腹泻观察
正常组小鼠反应灵敏、毛发光泽,饮食及活动均正常。单次或连续给予不同剂量5-FU后,小鼠出现不同程度的腹泻、体重降低、进食减少、毛发枯槁、精神萎靡及活动减少。单次给予5-FU,100、200 mg/kg组无动物死亡,400 mg/kg组小鼠死亡率为63%;连续给予5-FU 5 d后,30 mg/kg组无动物死亡,50、100 mg/kg组动物死亡率分别为38% 和100%。
体重方面,单次或连续给予5-FU后,与正常组比较,各剂量组小鼠体重在第2或3天出现明显降低(P< 0.05或P< 0.01),其中,单次给予5-FU,400、200 mg/kg组小鼠体重分别在给药后第12或14天仍明显低于正常组(P< 0.05或P< 0.01);连续给予5-FU 5 d后,50 mg/kg组小鼠在给药后第16天仍有显著差异(P< 0.01),100 mg/kg组小鼠体重一直持续下降,直至动物死亡。见图1。
腹泻方面,与正常组比较,单次给予5-FU后,100 mg/kg组未出现明显腹泻症状,200、400 mg/kg组小鼠在给药后第3天出现明显腹泻(P< 0.05),其中,400 mg/kg组腹泻维持时间较长;连续给予5-FU 5 d,各剂量组小鼠在给药第3或4天出现明显腹泻(P< 0.05),50 mg/kg组腹泻评分在给药后第13天仍有显著差异(P< 0.05),100 mg/kg组小鼠腹泻一直持续加重,直至动物死亡。见图2。

注:A. 5-FU单次给药对小鼠体重的影响;B. 5-FU连续给药对小鼠体重影响。 与正常组比较,*P< 0.05,**P< 0.01。图1 5-FU单次及连续给药对小鼠体重的影响Note. A. Single administration of 5-FU. B. Continuous administration of 5-FU. Compared with the control group, *P<0.05; **P<0.01.Fig.1 Effect of single and continuous administration of 5-FU on the body weight of mice n=8)
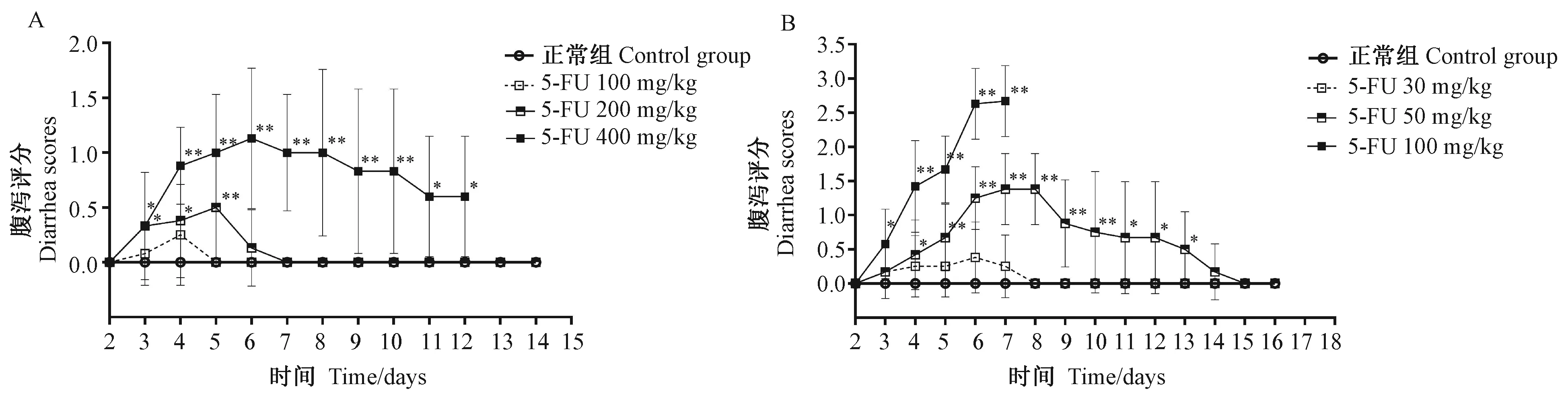
注:A. 5-FU单次给药对小鼠腹泻评分的影响;B. 5-FU连续给药对小鼠腹泻评分的影响。与正常组比较,*P< 0.05,**P< 0.01。图2 5-FU单次及连续给药对小鼠腹泻评分的影响Note. A. Single administration of 5-FU. B. Continuous administration of 5-FU. Compared with the control group, *P< 0.05;**P< 0.01.Fig.2 Effect of single and continuous administration of 5-FU on scores of diarrhoea in the mice n=8)
2.2 不同剂量5-FU单次及连续给药对小鼠外周血象的影响
结果见表1和表2。与正常组比较,单次给予5-FU,各剂量组小鼠白细胞和血小板水平均显著降低(P< 0.05或P< 0.01),红细胞和血红蛋白水平无明显变化;连续给予5-FU 5 d,各剂量组小鼠血小板均明显降低(P< 0.01),50、100 mg/kg组小鼠白细胞显著降低(P< 0.05或P< 0.01),100 mg/kg组小鼠红细胞和血红蛋白水平出现明显升高(P< 0.01)。
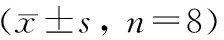
表1 5-FU单次给药对小鼠外周血象的影响Tab.1 Effect of single administration of 5-FU on peripheral blood of the mice n=8)
注:与正常组比较,*P< 0.05;**P< 0.01。
Note. Compared with the control group,*P< 0.05;**P< 0.01.
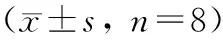
表2 5-FU连续给药对小鼠外周血象的影响Tab.2 Effect of continual administration of 5-FU on peripheral blood of the mice n=8)
注: 与正常组比较,*P< 0.05,**P< 0.01。
Note. Compared with the control group,*P< 0.05,**P< 0.01.

注:A. 正常组;B. 5-FU 100 mg/kg组;C. 5-FU 200 mg/kg组;D.5-FU 400 mg/kg组。图3 5-FU单次给药对小鼠小肠组织形态病理改变的影响(HE, ×200)Note. A. Control group. B. 5-FU 100 mg/kg group. C. 5-FU 200 mg/kg group. D. 5-FU 200 mg/kg group.Fig.3 Effect of single administration of 5-FU on pathological changes in the small intestinal tissues of the mice(HE, ×200)
2.3 不同剂量5-FU单次及连续给药对小鼠小肠组织形态病理改变的影响
正常组小鼠肠黏膜组织结构完整,腺体形态完好,绒毛上皮细胞排列整齐,无炎性细胞浸润。单次给予5-FU后,100 mg/kg组小鼠肠绒毛上皮细胞部分脱落;200 mg/kg组可见脱落的绒毛上皮细胞,肠腺结构消失,少量炎性细胞浸润;400 mg/kg组肠绒毛缩短、萎缩,肠腺结构消失,结缔组织增生,可见大量炎性细胞浸润。连续给予5-FU 5 d,30 mg/kg组肠绒毛结构破坏,隐窝细胞数量减少,伴有少量炎性细胞浸润;50 mg/kg组肠绒毛上皮细胞脱落,隐窝结构破坏,可见炎性细胞浸润;100 mg/kg组大量肠绒毛及隐窝结构消失,结缔组织增生,可见大量炎性细胞浸润。结果见图3和图4。

注:A. 正常组;B.5-FU 30 mg/kg组;C. 5-FU 50 mg/kg组;D. 5-FU 100 mg/kg组。 图4 5-FU连续给药对小鼠小肠组织形态病理改变的影响(HE, ×200) Note. A. Control group. B. 5-FU 30 mg/kg group. C. 5-FU 50 mg/kg group. D. 5-FU 100 mg/kg group.Fig.4 Effect of continual administration of 5-FU on pathological changes in the small intestinal tissues of the mice(HE, ×200)
3 讨论
5- FU是临床常用抗消化道肿瘤药物,约80%患者在接受治疗后出现肠黏膜炎[16],是复制化疗性肠黏膜炎的常见造模药物。本研究前期文献查阅发现5-FU诱导小鼠肠黏膜炎模型的给药剂量差异较大,因此本实验采用不同剂量的5-FU单次或连续5 d腹腔注射给予小鼠,并通过观察小鼠体重、腹泻、外周血象及病理组织形态改变等指标进行综合评价。
实验结果表明,单次或连续5 d给予不同剂量的5-FU,小鼠出现不同程度的腹泻及体重下降。单次给予5-FU,100、200 mg/kg组小鼠腹泻评分偏低,病理损伤较轻,未见或少见炎性细胞浸润;400 mg/kg组小鼠出现明显腹泻,肠绒毛脱落,隐窝消失,可见大量炎性细胞浸润,符合肠黏膜炎病理特征。连续给予5-FU 5 d,30 mg/kg组小鼠未出现明显腹泻,病理损伤较轻,少见炎性细胞浸润;50 mg/kg组小鼠肠绒毛上皮细胞脱落,隐窝结构破坏,可见炎性细胞浸润,且腹泻维持时间较长;100 mg/kg组小鼠出现严重腹泻,大量肠绒毛上皮细胞脱落,隐窝结构消失,但由于剂量过大,动物死亡率高达100%。
此外,骨髓抑制也是化疗常见的不良反应之一,主要表现为白细胞、血小板、红细胞减少,严重时会引起血红蛋白降低甚至全血细胞减少[17]。因而,本研究对外周血象也进行了观察。结果显示,单次给药各剂量组和连续给药30、50 mg/kg组小鼠白细胞和血小板水平均明显降低,红细胞和血红蛋白无明显变化,连续给药100 mg/kg组小鼠白细胞和血小板水平显著降低,红细胞和血红蛋白水平却明显升高。血细胞中红细胞平均寿命最长,血小板次之,白细胞最短,因而,当骨髓造血功能受损后,白细胞及血小板首先受到影响,而对寿命较长的红细胞影响相对滞后。本实验主要观察到白细胞和血小板水平下降,推测可能与此有关。同时,本研究中连续给药5-FU 100 mg/kg引起红细胞升高,可能与白细胞和血小板急剧减少,造血干细胞更多分化为红系祖细胞,进而导致红细胞暂时升高有关,但还需进一步证实。
综上所述,单次或连续5 d给予5-FU 诱导小鼠肠黏膜炎的作用呈剂量相关性,其中单次给药以400 mg/kg为造模合适剂量,连续5 d给药以50 mg/kg为造模合适剂量。
