重组人源Kunitz型蛋白酶抑制剂治疗大鼠脑皮质缺血/再灌注损伤
2018-06-26孙晓杰郭宝锋王冰
孙晓杰,郭宝锋,王冰
(吉林大学中日联谊医院整形外科,长春 130021)
牛胰蛋白酶抑制剂(bovine pancreatic trypsin inhibitor)BPTI作为Kunitz属丝氨酸蛋白酶抑制剂,是目前研究的最广泛的蛋白酶抑制剂之一[1]。人Aβ淀粉样蛋白前体(APP)包含的一段57个氨基酸序列结构,与Kunitz型丝氨酸蛋白酶抑制剂家族高度同源[2]。我们前期利用同源重组技术制备了人源丝氨酸蛋白酶抑制剂(rhKD/APP),并在体外研究了它的三级结构、空间构象和活性中心,证实了它的丝氨酸蛋白酶的抑制功能活性[3 ]。缺血/再灌注(ischemia/reperfusion, I/R)损伤是指机体器官缺血一定时间后再恢复血液灌注,组织损伤反而进行性加重的病理生理学现象,其中,保护神经元缺血/再灌注损伤,是缺血性脑血管病挽救半暗带神经功能的核心要素。既往研究显示,BPTI能通过降低脑细胞水肿[4],保护血脑屏障,发挥明确的神经保护作用[5-6]。然而,作为从牛肺中提纯的碱性蛋白酶,异体蛋白BPTI具有高抗原性[7]。本研究旨在大鼠脑缺血/再灌注动物模型上,探索人源重组丝氨酸蛋白酶抑制剂rhKD/APP治疗缺血/再灌注损伤的临床效果和潜在分子调控机制。
1 材料与方法
1.1 材料
1.1.1实验动物
2~3月龄清洁级Sprage-Dawley (SD)大鼠60只,雄性,体重270~300 g,来源于吉林大学实验动物部【SCXK(吉)2015-0001】,无菌手术在吉林大学实验动物科学部动物实验室进行【SYXK(吉)2015-0001】。饲养期间给予大鼠标准饲料和洁净饮用水,饲养环境:昼夜各半节律,湿度恒定,所有操作均符合实验动物伦理学要求。
1.1.2实验试剂
rhKD/APP (吉林大学药学院贺巾超博士惠赠),尼莫地平针剂 (Bayer, 德国),氯化三苯基四氮唑 (TTC) (北京化学试剂厂),SOD测定试剂盒 (Sigma,美国),Na+-K+-ATP酶活性试剂盒 (Sigma,美国),MDA检测试剂盒 (Sigma,美国),MPO测定试剂盒(南京建成生物公司),TUNEL检测试剂盒(宝灵曼,德国),ICAM-1单抗、E-selectin多抗、caspase-3免疫组化、Bcl-2和Bax的western blot试剂盒,均购置Santa Cruz,美国。
1.2 方法
1.2.1大脑缺血/再灌注大鼠模型的构建和评估
参照Zealonga线栓法制备大鼠右侧大脑中动脉阻断 (middle cerebral artery occlusion,MCAO)的局灶脑缺血/再灌注模型,神经功能缺损用双盲法进行评分。取60只大鼠随机均分为6组,每组10只。3个干预组分别为低剂量干预组 (rhKD/APP, 4 mg/kg);中剂量干预组 (rhKD/APP, 8 mg/kg));高剂量干预组(rhKD/APP, 16 mg/kg));尼莫地平治疗组 (Nimodipine, 0.7 mg/kg腹腔注射)为阳性对照;同时设置MCAO缺血/再灌注模型组作为阴性对照,伪手术组作为空白对照。
1.2.2病理学评估
取缺血3 h再灌注24 h大鼠,麻醉牺牲后取脑。常规苏木素-伊红(H&E)染色进行病理评估。冠状逐片切取脑片进行TTC磷酸缓冲液染色,评估脑片梗死面积。染色前后称湿重和干重,计算脑片含水量。
1.2.3自由基链、中性粒细胞酶MPO以及粘附因子表达的分组检测
制备5%脑组织匀浆,分别检测反映经典自由基激活程度的三个指标超氧物歧化酶 (SOD) 活性,Na+-K+-ATP酶活性、膜氧代谢产物丙二醇 (MDA) 含量,以及反映中性粒细胞激活程度的髓过氧化物酶(MPO)活性。脑片常规固定,免疫组化试剂盒检测脑片ICAM-1和E-selectin表达。所有检测均根据试剂盒说明书操作。
1.2.4神经细胞的凋亡评估
常规制备缺血/再灌注石蜡切片,计数TUNEL阳性细胞为凋亡细胞,图像分析计算凋亡细胞个数。caspase-3的免疫组化检测在4%多聚甲醛处理的30 μm厚冠状切片上完成。脑组织冰上分离即刻制备匀浆,右侧损伤区为被检测区,对侧作为对照区,常规Western blot法检测caspase-3、Bcl-2以及Bax的蛋白表达。

注:A. 假手术组;B.缺血/再灌注模型组;C. rhKD/A PP低剂量干预组(4 mg/kg);D. rhKD/APP中剂量干预组(8 mg/kg); E. rhKD/APP高剂量干预组(16 mg/kg);F. 尼莫地平组。图1 各组缺血/再灌注大鼠脑片的TTC染色结果Note. A. Sham group. B. I/R reperfusion group. C. rhKD/APP (4 mg/kg) treatment group. D. rhKD/APP (8 mg/kg) treatment group. E. rhKD/APP (16 mg/kg) treatment group. F. Nimodipine group.Fig.1 Representative TTC-staining results in the cerebral cortex tissues of rats with ischemia/reperfusion injury
1.3 统计学方法
2 结果
各剂量rhKD/APP干预组的预治疗,均能改善脑缺血/再灌注大鼠的神经缺损症状,降低脑梗死面积和脑水肿,且存在一定的剂量/效应相关性,此神经保护作用,可能通过清除自由基超载,拮抗炎性中性粒细胞呼吸爆炸,延迟神经元凋亡等综合实现。
2.1 rhKD/APP干预的缺血/再灌注大鼠临床分组评估
缺血3 h/再灌注24 h模型组大鼠的神经功能缺损明显,模型组评分为(5.98±1.00),低、中、高剂量组的神经功能缺损评分分别为(1.80±0.25)、(1.63±0.05)和(1.30±0.25)(P< 0.05)。与尼莫地平组(1.92±0.50)比较,组间差异无显著性 (P> 0.05)。模型组死亡率达26.5%,低、中、高剂量干预组的死亡率分别为18.5%、16.7%和14.0%(P< 0.05),但与尼莫地平组(18.2%)比较,组间差异无显著性(P> 0.05)。
2.2 rhKD/APP干预的大鼠脑缺血/再灌注脑皮质区病理改变和脑水肿的分组评估
缺血/再灌注右脑皮质中心可见脑梗死灶,周围出现半暗带区和脑水肿区。各个干预组和尼莫地平组大鼠,缺血中心区神经元坏死均减轻,半暗带区神经元数量均增多,周围细胞水肿均改善。经TTC染色的脑片梗死面积,低、中、高剂量干预组分别为(21.82±2.96)、(20.43±2.33)和(14.71±3.12),与模型组(35.42±2.21)比较均显著减少(P< 0.05),但是与尼莫地平组(19.92±3.47)比较,差异均无显著性 (P> 0.05)(图1)。脑含水量定量检测结果的分组比较,与上述梗死面积的结果一致:低、中、高剂量干预组分别为(17.63±1.54)、(13.52±2.38)和(10.24±1.42),与模型组(20.81±2.37)比较显著降低(P< 0.05),但是与尼莫地平组(14.72±2.54)比较差异无显著性 (P> 0.05)。
2.3 各组脑片氧自由基的指标和髓过氧化物酶活性水平
分组检测脑匀浆反映氧自由基活化程度的三个指标(SOD活性、Na+-K+-ATP酶活性、MDA含量)以及反映脑匀浆内中性粒细胞激活程度的髓过氧化物酶MPO活性,各组平均水平见表1。其中,每活性单位MPO的意义为每毫克每小时脑匀浆H2O2在标准条件下被分解为1 nmol/L的酶活性。由表可见,三个干预组的中性粒细胞MPO酶活性降低,与R/I模型组比较,均呈现显著降低(P< 0.05),而尼莫地平组MPO活性,与模型组比较差异无显著性(P> 0.05)。与尼莫地平组比较,各个剂量rhKD/APP降低MPO活性的能力均有显著优势(P< 0.05)。

表1 脑匀浆SOD、MDA、Na+-K+-ATPase、MPO的分组表达Tab.1 Expression of SOD, MDA, Na+-K+-ATPase and MPO activity in the cerebral cortex tissues of the rhKD/APP-treated rats with
注:与模型组比较,*P< 0.05;与尼莫地平比较,#P< 0.05。
Note.*P< 0.05, vs. the model group;#P< 0.05,vsthe Nimodipine group.
2.4 各组脑片ICAM-1和E-selectin免疫组化表达
重组人源丝氨酸酶抑制剂干预组和尼莫地平治疗组I/R大鼠脑片的ICAM-1/E-selectin的阳性血管表达情况见图2,本图选择中剂量组rhKD/APP抑制剂组和尼莫地平治疗组的表达比较。在表达ICAM-1的视野内,抑制剂组阳性血管数量略少,且细胞表达强度略弱;在表达E-seletin的视野内,抑制剂组的阳性血管数略少,但是表达强度和尼莫地平组并无差异。I/R模型组表达ICAM-1和E-selectin阳性血管,每视野不低于5个(结果未显示)。

注:A. rhKD/APP干预组ICAM-1阳性表达; B. 尼莫地平组ICAM-1阳性表达; C. rhKD/APP干预组E-selectin阳性表达; D. 尼莫地平组E-selectin阳性表达。图2 干预组和尼莫地平组脑片内皮细胞粘附因子ICAM-1与E-selectin的表达比较Note. A. Expression of ICAM-1 in the rhKD/APP group. B. Expression of ICAM-1 in the Nimodipine group. C. Expression of E-selectin in the rhKD/APP Group. D. Expression of E-selectin in the Nimodipine Group.Fig.2 Expression of ICAM-1 and E-selectin in the cerebral cortex tissues of rhKD/APP-treated rats with ischemia/reperfusion injury(Immunohistochemical staining)
2.5 rhKD/APP干预的大鼠缺血/再灌注神经细胞凋亡信号蛋白的分组表达
低、中、高剂量干预组大鼠脑组织TUNEL阳性细胞分别为(56.8±3.6),(33.2±4.6),(29.6±2.1),尼莫地平组为(36.4±4.3),与模型组 (69.6±4.6) 相比,四组神经凋亡细胞均明显减少(P< 0.05)。重组人源丝氨酸酶抑制剂干预组和尼莫地平治疗组脑片TUNEL阳性细胞的表达结果见图3,这里展示了中剂量组rhKD/APP和尼莫地平组的比较。展示的视野中,中剂量干预组凋亡细胞数量虽较尼莫地平组少,但局部脑组织的水肿程度略重。
重组人源丝氨酸酶抑制剂干预组和尼莫地平治疗组I/R大鼠脑片caspase-3的表达结果见图4。这里展示的仍是中剂量组rhKD/APP干预组和尼莫地平组的比较。展示的视野中,中剂量干预组caspase-3阳性数量较尼莫地平组多,但表达强度降低,提示凋亡信号的复杂性。

注:A. rhKD/APP干预组TUEL阳性细胞;B. 尼莫地平组TUEL阳性细胞。图3 干预组与尼莫地平组大鼠脑片TUNEL阳性细胞表达比较Note: A. TUNEL-positive cells in the rhKD/APP Group. B. TUNEL-positive cells in the Nimodipine group.Fig.3 TUNEL-positive cells in the cerebral cortex tissues of rhKD/APP-treated rats with cerebral ischemia/reperfusion injury (Immunohistochemical staining)
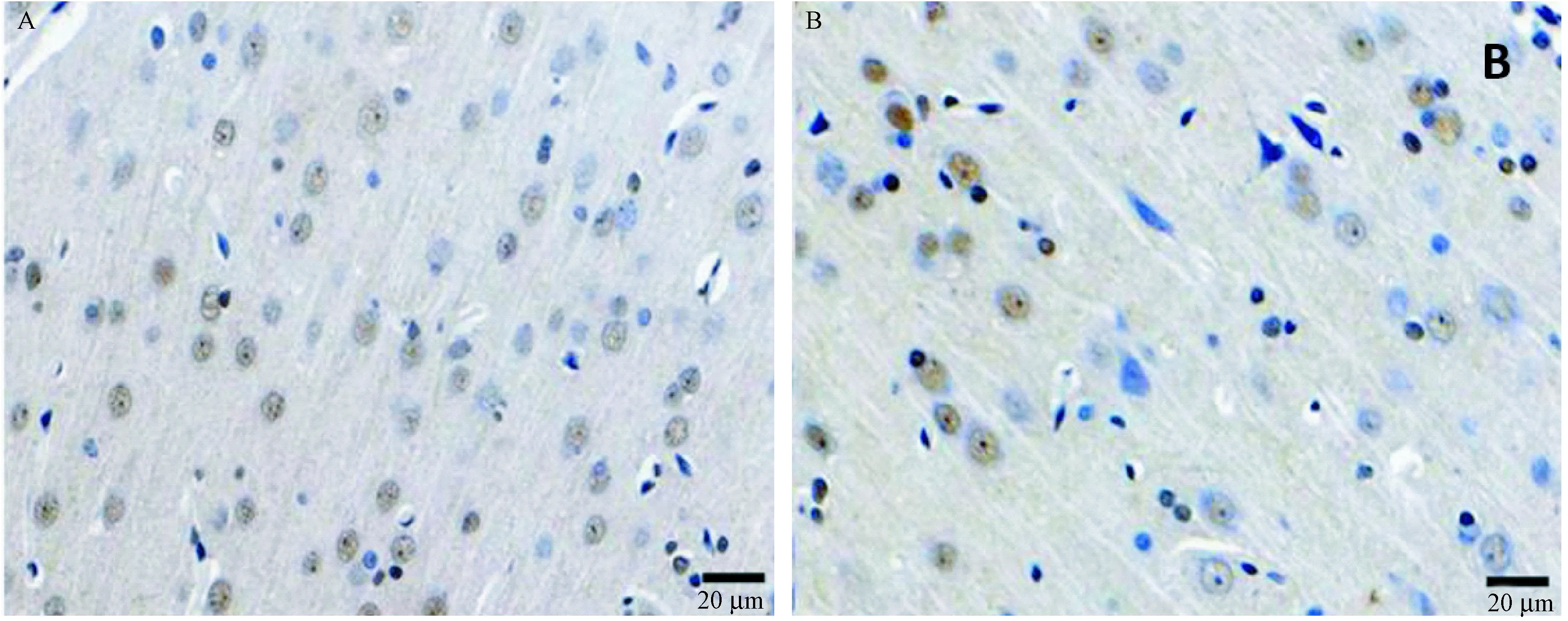
注: A. rhKD/APP干预组caspase3阳性表达细胞;B. 尼莫地平组caspase3阳性表达细胞。图4 干预组与尼莫地平组大鼠脑片Caspase-3阳性细胞表达比较Note: A. Caspase 3-positive cells in the rhKD/APP group. B. Caspase 3-positive cells in the Nimodipine group.Fig.4 Caspase 3-positive cells in the cerebral cortex tissues of rhKD/APP-treated and Nimodipine-treated rats with ischemia/reperfusion injury (Immunohistochemical staining)
为了进一步探索caspase依赖的凋亡信号的开启程度,对各组脑脑皮质凋亡蛋白进行定量检测(见图5)。Western Blot蛋白条带的数值化通过灰度分析进行,每个条带的定量结果均经各自内参配平,蛋白定量结果由在线软件分析后自动算出 (Image J)。图5 A是caspase-3及其降解产物P17的表达条带。如图可见,伪手术组神经细胞内仅表达未降解激活的caspase-32片段,I/R模型组则可看到降解产物P17的高表达。中、高剂量干预和尼莫地平治疗后,P17的表达减少,说明神经细胞凋亡caspase降解信号得到了拮抗,尼莫地平组和中、高剂量组之间P17的定量表达,组间差异无显著性。图5B和5C分别为Bcl-2和Bax的定量表达水平,无论Blc-2还是Bax的表达,尼莫地平组的表达量均与中剂量干预组的表达量接近,然而,尼莫地平治疗组和中、高剂量干预组比较,三组间差异仍无显著性。综上,伴随丝氨酸酶抑制剂治疗量的增加,caspase-P17表达下调,Bcl-2/Bax比值呈现同步上调变化,这些凋亡蛋白在中、高剂量干预组与尼莫地平组的表达灰度,组间差异无显著性。

注:A. Caspase-3及其降解产物P17的Western Blot表达条带;B和C. bcl-2以及bax的Western blot表达条带。图5 各组Caspase-3、bcl-2以及bax的Western blot表达结果Note: A. Quantitative expression of caspase-3 and its degenerated P-17. B and C. Quantitative expression of Bcl-2 and Bax.Fig.5 Western blot analysis of the expression of caspase-3, Bcl-2 and Bax in the cerebral cortex tissues after ischemia/reperfusion injury
3 讨论
本实验应用人源重组丝氨酸酶抑制剂rhKD/APP临床治疗大鼠脑缺血/再灌注的脑皮质神经损伤,显示出良好的神经保护效应,且有剂量-疗效相关性。缺血/再灌注损伤的神经元凋亡调控网络具有明确的雌激素依赖的性别差异[8-9],而丝氨酸蛋白酶抑制剂可广泛下调性激素蛋白受体的表达,因此,本研究仅选择雄鼠进行动物模型的制备,以消除本底雌激素差异对研究结果的影响。丝氨酸酶抑制剂临床最广泛应用是调控凝血功能和炎性反应。脑缺血/再灌注损伤的机制则非常复杂,至少涉及缺血期的氧化应激异常、自由基超载、钙超载,以及再灌注期的中性粒细胞激活(呼吸爆发)等多个信号网络的交叉调控。结合上述两个方向,本研究选择了以拮抗钙超载为核心的经典神经保护药物尼莫地平为阳性对照,在神经细胞缺血/再灌注损伤的检测指标选择上,我们分别入选了针对缺血超早期的氧化应激和自由基超载指标,以及针对再灌注超早期的中性粒细胞激活指标MPO以及促进中性粒细胞激活的血管内皮分泌的粘附因子。线粒体功能异常是缺血期的启动核心,它直接激活了细胞色素C依赖的细胞凋亡信号。细胞膜Na+-K+-ATP酶虽然对缺血缺氧的敏感性不高,但是对再灌注损伤非常敏感,这些细胞膜离子转运蛋白的再灌注损伤,加重了细胞内钙超载以及自由基连锁反应,同时激活了细胞表面受体依赖的凋亡信号。因此,如何拮抗神经元的凋亡,是挽救脑缺血/再灌注半暗带损伤的重心。既往研究显示,丝氨酸酶抑制剂能够拮抗多个凋亡信号,抑制神经元凋亡[10-12]。本实验结果也显示,各个剂量人源重组丝氨酸酶抑制剂的干预,均能够拮抗大鼠缺血/半暗带区受损细胞的凋亡,表现为caspase-17表达降低,Bcl-2/Bax比值下调。从缺血期的分子机制看,丝氨酸酶抑制剂下调了自由基超载,酶抑制剂通过抑制溶酶体的破坏稳定细胞膜,同时抑制了溶酶体释放出来的具有丝氨酸中心的活性酶的激活[13]。Na+-K+-ATP系列酶中也有以丝氨酸为活性中心的关键酶,因此,rhKD/APP能延缓ATP的降解速度,改善缺血乏氧。同时,丝氨酸蛋白酶抑制剂能下调激酶和缓肽酶的生成,抑制次黄嘌呤脱氢酶转化为黄嘌呤氧化酶,对抗氧自由基的损伤。从再灌注期的机制看,丝氨酸酶抑制剂能显著降低再灌注区反映中性粒细胞激活的MPO酶活性[14],而且显著优于尼莫地平。激活的中性粒细胞会产生大量活性氧,使炎症与自由基形成正反馈,共同加重脑组织缺血/再灌注损伤[15]。在这个激活环路中,ICAM-1和E-选择素的上调尤为关键,敲除ICAM-1基因的大鼠对缺血/再灌注损伤的易感性降低[16]。同时,ICAM-1的表达下调,也可以降低缺血/再灌注脑皮质的凋亡信号。丝氨酸蛋白酶抑制剂可以抑制粘附因子表达过程以丝氨酸为活性中心蛋白,减少血管内皮细胞表达粘附因子[5],进一步下调中性粒细胞的过激活。综上,丝氨酸酶抑制剂在大脑缺血/再灌注损伤的双期,均显示出临床治疗机制[17]。
虽然各个剂量的丝氨酸酶抑制剂干预均展示出神经保护疗效,但是,只有反映中性粒细胞激活程度的MPO酶活性这一个指标,与尼莫地平治疗比较,有显著优势。这可能是因为丝氨酸酶抑制剂分子量大,通过血脑屏障效率低,但是中性粒细胞呼吸爆发不需要通过血脑屏障,所以该指标对酶抑制剂的敏感度高。除这个指标外,反映氧自由基超载、粘附因子表达和神经凋亡的各个指标,酶抑制剂干预与尼莫地平治疗并无显著差异。从整体上看,中剂量rhKD/APP干预组的各个均数与尼莫地平组基本接近,而高剂量组则显示出一定的优势。
综上,丝氨酸蛋白酶抑制剂通过抑制多种以丝氨酸为活性中心的蛋白酶,拮抗缺血期的自由基损伤,降低再灌注期的中性粒细胞过度活化,双信号拮抗神经细胞凋亡,发挥对脑缺血/再灌注的神经保护作用,与经典神经保护药物尼莫地平比较,临床疗效无明显差异。虽然我们的研究结果显示一定的剂量/效应相关,而且本研究中未见明显毒副作用,但是由于丝氨酸酶抑制剂的广谱性,应该慎重提高给药剂量。我们拟加大样本量,延长临床观察窗,继续相关的临床治疗研究。得益于人源重组丝氨酸酶抑制剂的低免疫原性,该生物工程药物rhKD/APP应用人脑缺血/半暗带的神经保护的临床前景值得期待。
